高三化学实验练习
一、选择题(每题有1个正确选项)
1、以下仪器中,可以不在室温下使用的是
A.漏斗 B.量筒 C.移液管 D.滴定管
2、容量瓶中需标有①温度 ②浓度 ③容量 ④压强 ⑤刻度线⑥酸式或碱式六项中的
A.③⑤⑥ B.②④⑥ C.①③⑤ D.①②④
3、下列事故处理不当的是
A.酒精着火立即用沙覆盖扑灭
B.浓硝酸沾到皮肤上立即用水冲洗
C.汽油着火立即用水浇灭
D.少量酸或碱溶液滴在桌上立即用湿抹布擦净,再用水冲洗抹布
4、某学生用量筒量取液体,将量筒平放且面对刻度平视测量。初次视线与量筒内凹液面的最低处保持水平,读数为20毫升。倒出部分液体后,俯视凹液面的最低处,读数为5毫升,则该学生实际倒出液体的体积
A.大于15毫升 B.小于15毫升 C.等于15毫升 D.无法确定
5、有一关于实验操作的谜语:“我入水中较安全,水入我中真危险,我与水合多放热,实验牢记保平安。”这一实验操作是指
A.将金属钠保存在水中 B.将盛有一粒白磷的一烧杯水加热至60℃
C.用压强计测某一深度处的水压 D.稀释浓硫酸
6.某溶液含有较多的Na2SO4和少量的Fe2(SO4)3。若用该溶液制取芒硝,可供选择的操作有:①加适量硫酸溶液,②加金属钠,③结晶④加过量氢氧化钠溶液,⑤加强热脱结晶水,⑥过滤。正确的操作步骤是
A.②③⑥ B.④⑥①③ C.④⑥③⑤ D.②⑥①③⑤
7.
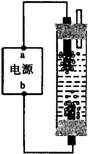 某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
8、在实验室不宜长期保存,必须现用现配的是
①溴水 ②银氨溶液 ③石灰水 ④氯水 ⑤氢硫酸 ⑥NaOH溶液 ⑦FeSO4溶液 ⑧FeCl3溶液 ⑨CuSO4溶液 ⑩醋酸
A.②③④⑧⑨ B.⑤⑦⑧⑨⑩ C.②③④⑤⑦ D.①⑥⑧
二.选择题(每题有1-2个正确选项)
9、下列各组溶液中,不用任何其它试剂就能鉴别的是
A、Na2SO4,H2SO4,AlCl3,BaCl2 B、NaAlO2,KHCO3,NaCl,NaHSO4
C、 HCl、NaOH、K2SO4、NaHCO3 D、NaOH、FeCl3、MgCl2、K2SO4
10、实验室测定CuSO4·nH2O晶体里结晶水的n值时,出现了3种情况:①晶体中含有受热不分解的物质;②晶体尚带蓝色即停止加热;③晶体脱水后放在台上冷却后再称量。使实验结果n值偏低的原因是
A.①和② B.①和③ C .②和③ D.①、②和③
11、某实验室只有烧碱、铜片、大理石和蒸馏水,而无其它试剂,从欠缺试剂的角度看,欲进行以下物质的制取或实验。其中无法进行的是
A. 制取纯碱 B. 制取氯化铜 C. 测定烧碱的物质的量浓度 D. 制取氢气
12、.图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示
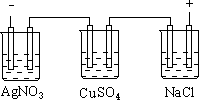
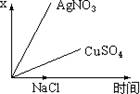
甲 乙
A.各电池析出气体体积总数的变化 B.各电解池阳极质量的增加
C.各电解池阴极质量的增加 D.各电极上放电的离子总数的变化
13、有两瓶pH值都等于2的酸溶液,一瓶是强酸,另一瓶是弱酸,可用来鉴别它们的一组试剂是
A.石蕊试液和水 B.pH试纸和水 C.酚酞试液和水 D.酚酞试液和苛性钠溶液
14、烟道气的主要成分是①CO2 ②CO③N2 ④O2,为了测定各组分气体的百分含量,且除去有害气体,可用不同化学试剂按一定顺序吸收,在同温同压下量出吸收前后的气体体积变化(气体带出的水蒸气忽略不计)。工业上吸收O2可用1,2,3-苯三酚的碱溶液4C6H3(OK)3+O2![]() 2(KO)3C6H2-C6H2(OK)3+2H2O, 吸收CO用Cu2Cl2的氨水溶液:Cu2Cl2+2CO+2H2O
= Cu2Cl2·2CO·2 H2O,
2(KO)3C6H2-C6H2(OK)3+2H2O, 吸收CO用Cu2Cl2的氨水溶液:Cu2Cl2+2CO+2H2O
= Cu2Cl2·2CO·2 H2O,
Cu2Cl2·2CO·2
H2O+4NH3 = 2NH4Cl+(NH4)2C2O4+2Cu
为了防止亚铜离子氧化,在Cu2Cl2的氨水溶液中放入一些铜丝,吸收CO2用KOH溶液,则吸收并测定四种气体体积的顺序是
A.①④②③ B.①③②④ C.④①②③ D.①②④③
15、化学上鉴定S2O32-的方法之一是使用AgNO3溶液作试剂,将溶液逐渐滴入含有S2O32-的溶液中时,会有以下反应Ag++2S2O32-=[Ag(S2O3)2]3-
3Ag++[Ag(S2O3)2]3-
=2Ag2S2O3 Ag2S2O3+H2O
= Ag2S¯+H2SO4 对于S2O32-的鉴定,下列叙述不正确的是
A.该鉴定可在酸性或碱性溶液中进行 B.该鉴定只能在中性溶液中进行
C.AgNO3必须过量
D. S2- 对鉴定没有干扰
16.有人将浓度均为0.1mol/L的氨水和氯化铵溶液等体积混合对比混合液进行实验测定,来验证NH3·H2O的电离倾向大于NH4+的水解倾向,并设想出以下几个实验方案。这些方案中不科学、不合理的是①测定Cl-浓度 ②测定混合液的PH
③用滴定法测定NH4+的浓度 ④用滴定法测出氢氧根离子的浓度
A.①③④ B.只有① C.只有② D.全部
17.、以下仪器:①中和滴定实验用的锥形瓶 ②中和滴定实验用的滴定管 ③容量瓶 ④配制一定物质的量浓度的NaOH溶液用于称量的烧杯 ⑤测定硫酸铜晶体中结晶水含量用的坩埚,用蒸馏水洗净后便可立即使用而不会对实验结果造成误差的是
A.①和② B.①和③ C.①③⑤ D. ②④⑤
18、验证某有机物属于烃的含氧衍生物,应完成的实验内容是
A.只要验证它完全燃烧后产物只有H2O和CO2
B.只要测定其燃烧产物中H2O和CO2物质的量的比值
C.测定完全燃烧时消耗有机物与生成的CO2、H2O的物质的量之比
D.测定该试样的质量及其试样完全燃烧后生成CO2和H2O的质量
三.填空和简答题
19.磷酸镁铵NH4MgPO4是一种重要的盐,难溶于水。化学上制备NH4MgPO4从反应原理看,是用氯化镁溶液、磷酸氢二钠的氨水混合反应的方法。写出制备磷酸镁铵反应的离子方程式__________________;而实际上在制备反应中,要向混合溶液中加入适量的铵盐(NH4+),请分析说明加入铵盐的目的是________________。
20、从下列仪器、试剂中选用适当的用品进行简便的实验,证明浓硝酸比稀硝酸具有更强的氧化性,要求简要地叙述实验的方法和现象。
试剂:NaOH溶液、石蕊试液、酚酞试液、浓硝酸、稀硝酸、蒸馏水
用品:酒精灯、火柴、玻璃棒、试管、胶头滴管
______________________________________。
21、下图中的几种仪器装置都可以制得氢气,其中:
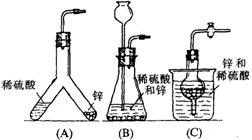
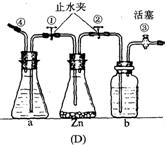
(1)能使发生或停止发生氢气操作均比较方便的装置是(写编号)_________,能够灌充升空的小氢气球的装置是____________。
(2)在(D)装置中a中的液体应是__________;b中的液体应是______________,其作用是___________________。
(3)使(D)装置发生氢气的操作顺序应该是_______________________。
22、某学生为了测定由两种元素形成的气态化合物X的组成,做了如图所示的实验。他把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应,得到如下结果:
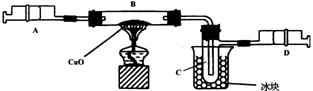
①实验前B管及药品的质量为21.32克,实验后为21.16克。
②C管中收集到的物质电解后得到H2和O2,在D中收集到的是N2。
③X中两元素的质量比是14︰3。
(1)C中收集到的液体,质量是______________克。
(2)在实验中看到的现象是 _________________。
(3)B中反应的化学方程式是 ____________________________。
23、 如下图的装置中:
如下图的装置中:
a是盛有标况下的空气(氧气占五分之一)和10毫升1.2mol/L硝酸的250毫升烧瓶。b是未充气(实验开始前内部没有气体)放有0.384克铜粉的气球。c是夹紧了的弹簧夹。d中盛有足量的过氧化钠。e是充有二氧化碳的针筒。整套装置已经过气密性检查合格。
(1)将气球中的铜粉小心倒入烧瓶中,充分反应后发现铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是_______________________________。
(2)欲提高铜与硝酸反应的速度可采用多种不同的措施
①若用加入化学试剂法,下列试剂中可以使用的是(填代号)_____________ ;
A.蒸馏水 B .无水醋酸钠 C.石墨 D.硝酸银溶液(少量)
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是 __________________,此时气球全在烧瓶外还是有一部分进入烧瓶?________________。
③打开弹簧夹将二氧化碳推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳_______________毫升。
④将上述全过程用一个总的化学方程式表示__________________________。
24、一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159克/厘米3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280毫升/毫升水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制造一氯甲烷:
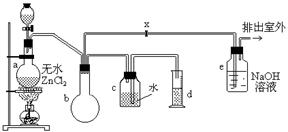 制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。试填写下列空白:
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。试填写下列空白:
(1)制备一氯甲烷的化学方程式____________,其反应类型属于___________反应;
(2)装置b的作用是_______________________;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为____________;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是____________________;
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应的理由是_______________;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是_______________________________________________;
(7)实验结束后,d中收集到的液体中含有 ____________________________________。
25、铝粉是铝热焊剂的主要成分之一。在用99.9%纯度的铝锭制得的铝粉中,常含少量的三氧化二铝和二氧化硅。用气体容量法可以测定铝粉中金属铝(又称活性铝)的含量,其方法是:用盐酸或氢氧化钠溶液与样品作用,通过产生的氢气的体积计算样品中金属铝的含量。
(1)在盐酸和氢氧化钠溶液这两种试剂中,选用______较好,原因是_____________。
(2)根据你选用的试剂,写出测定过程的化学方程式 _________________。
(3)计算金属含量的基本公式是_____________________________。
(4)在常温常压下,按实测气体体积计算时,铝的百分含量往往比实际含量偏大,其原因_________________________________,为得到正确结果,应该 ________________。
26.制溴化亚铁可用以下装置:装置中a是一支瓷管,b是一只套住瓷管的电炉,c是两只耐高温的瓷舟(瓷舟内共盛有56 g的铁粉),d和e中的液体均为液溴。
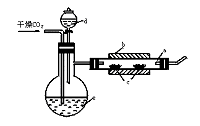 实验开始时,先将瓷管加热至600℃ ~700℃ ,再用干燥的CO2气流将装置里的空气排净后继续缓慢地输进瓷管,最后溴从d中慢慢滴入已加热至100℃ ~120℃ 的e中,经过几个小时的反应,在瓷管的一端沉积着黄绿色鳞片状的FeBr2 80 g。试回答下列问题:(1)如何检查用塞子(插有导管和仪器d)塞紧的e(未与瓷管连接)的气密性____________。
实验开始时,先将瓷管加热至600℃ ~700℃ ,再用干燥的CO2气流将装置里的空气排净后继续缓慢地输进瓷管,最后溴从d中慢慢滴入已加热至100℃ ~120℃ 的e中,经过几个小时的反应,在瓷管的一端沉积着黄绿色鳞片状的FeBr2 80 g。试回答下列问题:(1)如何检查用塞子(插有导管和仪器d)塞紧的e(未与瓷管连接)的气密性____________。
(2)如果导入装置里的CO2没有干燥,就会发生副反应,该反应的化学方程式是____________。
(3)瓷管两端的塞子,适宜于选用 _______作材料最佳,其理由是________。
A.橡皮 B.石棉 C.玻璃 D.软木
(4)反应过程中,不断通入CO2主要起了两个作用:①是___________________;②是_________________。
(5)根据反应方程式:2Fe+3Br2====2FeBr3 2FeBr3====2FeBr2+Br2↑求得这次实验中FeBr2的产率是_______________。
(6)为了防止污染空气,在装置最后应___________________。
27.在化工实验中,要除去某些杂质离子,往往采用在一定条件下使之析出MxAy(DE4)z(OH)12浅黄色复盐晶体。M、A、D、E代表四种元素。已知:
①x+y+z=12(x、y、z均为正整数)
②取9.7g该化合物溶于水中,滴加用稀硝酸酸化的硝酸钡溶液,D、E两元素完全转化成白色沉淀。将沉淀过滤、洗涤、干燥称量其质量为9.32g
③滤液中A、M以阳离子形式存在(未被硝酸氧化),用胶头滴管取滤液2~3滴于白色点滴板(一种瓷质化学仪器,由于背景为白色,故称白色点滴板,便于观察生成的有色物质)上,再加1~2滴硫氰化钾溶液,滤液变成血红色
④往滤液中通入足量的H2S气体,使A离子完全被还原后,得到0.96g浅黄色沉淀
(1)D是___________,E是_____________理由是________________
(2)A是___________,理由是_________________
(3)通过计算和推理确定x、y、z的值
参考答案
一、二、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| A | C | C | A | D | B | B | C | BD | D | C | C | BD | A | AD | A | B | D |
三、19、NaH2PO4 + MgCl2 + 2NH3·H2O == NH4MgPO4 ↓+ NaCl + NH4Cl + 2H2O
NH4+ + H2O ≒ NH3·H2O + H+,减少OH-浓度,防止Mg(OH)2的生成。
20、取两支试管,分别注入浓、稀硝酸各1~2毫升,再分别滴入几滴石蕊试液,微热,看到在浓硝酸中,溶液的红色迅速褪去,而在稀硝酸中,溶液的红色不易褪去(甚至不褪色),这足以说明浓硝酸的氧化性比稀硝酸强这一事实。
21、(1)(C),(D);(A),(D) (2)稀盐酸或稀硫酸;水或氢氧化钠溶液;除去H2中可能混入的酸滴或酸雾 (3)打开①②③,由④通入少量气体使稀酸流入盛锌容器内,再立即关闭①
22、(1)0.18克
(2)B中黑色CuO逐渐变成红色,C中有无色液体水生成 (3)3CuO+2NH3![]() 3H2O+3Cu+N2
3H2O+3Cu+N2
23、(1)溶液变蓝色,烧瓶内气体由无色继而变成红色,气球胀大 (2)①CD ② 4NO2+O2+2H2O=4HNO3或4NO+3O2+2H2O=4HNO3 有一部分被吸入烧瓶 ③ 38.4 ④2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
24、(1)CH3OH+HCl![]() CH3Cl+H2O 取代 (2)防止倒吸,保证安全
(3)NaOH+HCl=NaCl+H2O (4)2CH3Cl+3O2
CH3Cl+H2O 取代 (2)防止倒吸,保证安全
(3)NaOH+HCl=NaCl+H2O (4)2CH3Cl+3O2![]() 2CO2+2H2O+2HCl
(5)可使甲醇充分反应,转化成一氯甲烷 (6)甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出
(7)甲醇、盐酸、一氯甲烷
2CO2+2H2O+2HCl
(5)可使甲醇充分反应,转化成一氯甲烷 (6)甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出
(7)甲醇、盐酸、一氯甲烷
25、(1)NaOH;NaOH溶液可溶解SiO2而使被其包藏的金属铝释放出来,而盐酸不与SiO2作用。
(2)(略)
(3)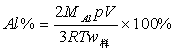 (4)饱和水蒸气占据一定体积,使实测气体体积变大;通过换算扣除水蒸气体积(或先干燥再测体积)。
(4)饱和水蒸气占据一定体积,使实测气体体积变大;通过换算扣除水蒸气体积(或先干燥再测体积)。
26. (1)通过分液漏斗向烧瓶内加水,使导管内和烧瓶内水面相平后,给导管套上乳胶管后夹紧,再加水,看管内水面是否有变化 (2)3Fe+4H2O(g)=====Fe3O4+4H2
(3)B 石棉耐高温,且溴不腐蚀石棉
(4)①使溴挥发逸出进入a管 ②将装置里的空气排尽,防止铁在高温下被氧化
(5)37% (6)将尾气通入盛有NaOH溶液的烧杯中
27.(1)硫元素,氧元素,因为在稀硝酸中生成了白色沉淀,此白色沉淀必为硫酸钡
(2) 铁元素,滤液滴入KSCN溶液呈血红色,说明A、M中必要一种是Fe3+;A离子能被H2S还原而M不能,所以A是铁元素
(3)复盐的化学式为Na2Fe6(SO4)4(OH)12