第十二讲:高三化学常见物质的实验室制法
编稿人:樊晓芳 审核人:王旭红
一、 考纲要求
1、掌握常见气体的实验室制法(包括所用试剂、仪器装置、反应原理和收集方法);
 2、会根据反应物状态、反应条件、气体性质选择合适的发生、净化、收集和尾气处理装置;
2、会根据反应物状态、反应条件、气体性质选择合适的发生、净化、收集和尾气处理装置;
1、
3、掌握几种重要的无机物的制取。
二、 双基回顾
(一)、气体发生装置的类型(根据原理、反应物状态和反应条件等来选择)
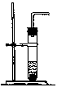 1.固体或固体混合物加热制备气体,可用实验室制备 的装置。 如右图所示,可制备的气体有
等。
1.固体或固体混合物加热制备气体,可用实验室制备 的装置。 如右图所示,可制备的气体有
等。
注意:(l)试管口应稍 倾斜,以防止产生的 在管口冷凝后倒流而引起试管破裂。(2)铁夹应夹在距试管口 处。
2.块状固体与液体的混合物在常温下反应制备气体,可用 制备,当制取气体的量不多时,也可采用简易装置 可制备气体有 等。
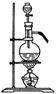 注意:在用简易装置时,如用长颈漏斗,漏斗颈的下口应
,否则起不到液封的作用;
注意:在用简易装置时,如用长颈漏斗,漏斗颈的下口应
,否则起不到液封的作用;
3.固体与液体或液体与液体的混合物加热制备气体,可用实验室制备
的装置,如右图所示。可制备的气体有: 等。
注意:先把 药品加入 ,然后加入 药品。
(二)、几种气体制备的反应原理
| H2 | O2 | ||
| Cl2 | HCl | ||
| SO2 | NO2 | ||
| NH3 | CO2 | ||
| NO | C2H2 | ||
| CO | C2H4 |
(三)、气体的收集
1. 难溶或微溶于水,与水不发生化学反应的气体,都可用 收集。例如H2、O2、NO、CO、CH4、CH2=CH2、CH≡CH等。
2. 不与空气发生反应,且其密度与空气密度相差较大的气体,都可用 收集。 式量大于29的气体如Cl2、HCl、CO2、SO2、H2S气体可用瓶口向 的排空气法收集。如式量小于29的气体,如H2、NH3、CH4可用瓶口向 的排空气取气法收集。
![]()
![]() (四)、气体的净化与干燥
(四)、气体的净化与干燥
1. ![]() 气体的净化与干燥装置
气体的净化与干燥装置
气体的净化常用洗气瓶、干燥管。如图所示。
2.气体的净化
选择气体吸收剂应根据气体的性质和杂质的性质而确定,
所选用的吸收剂只能吸收气体中的杂质,而不能与被提纯的气体反应。一般情况下:
①易溶于水的气体杂质可用 来吸收;②酸性杂质可用 物质吸收;
③碱性杂质可用 物质吸收; ④水分可用 来吸收;
⑤能与杂质反应生成沉淀(或可溶物)的物质也可作为吸收剂。
3.气体干燥剂
常用的气体干燥剂按酸碱性可分为三类:
①酸性干燥剂,如浓硫酸、 。
能够干燥显 或 的气体,如CO2、SO2、NO2、HCl、H2、Cl2 、O2、CH4等气体。
②碱性干燥剂,如 。
可以用来干燥显 性或 性的气体,如NH3、H2、O2、CH4等气体。
③中性干燥剂,如 等,
可以干燥中性、酸性、碱性气体,如O2、H2、CH4等。
注意:在选用干燥剂时,有还原性的气体不能选用有 的干燥剂。能与气体反应的物质不能选作干燥剂,如不能用CaCl2来干燥NH3(因生成 CaCl2·8NH3),不能用浓 H2SO4干燥 NH3、H2S、HBr、HI等。
三、例题评析
[例1]下列反应适用于实验室制氢气的是( )。
①锌与稀硫酸反应②甲烷热分解③电解稀硫酸④赤热的炭与水蒸气反应
A.只有① B.①② C.①③ D.①②④
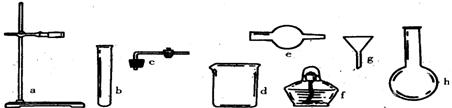 [例2](92年上海)(1)在没有现成的CO2气体发生器的情况下,请你选用下图中的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。应选用的仪器是(填入仪器的编号)
。
[例2](92年上海)(1)在没有现成的CO2气体发生器的情况下,请你选用下图中的部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。应选用的仪器是(填入仪器的编号)
。
(2)若用上述装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,比较合理的方案应选用的药品是 。
[例3]在加热的条件下用NH3还原CuO可以制得纯净的N2和活性铜粉(途径I);用该活性铜粉与空气反应又制得较纯净的N2(途径II)。由于N2在实验室制备常需要用到有毒和易使人致癌的NaNO2,上述方法因CuO与Cu的循环使用,且制出的N2可基本满足要求,故倍受人们关注。下面给出了按途径I和途径II制N2必需的几种实验仪器,其它必要的仪器如铁架台、铁夹、铁圈、石棉网、酒精灯等仪器均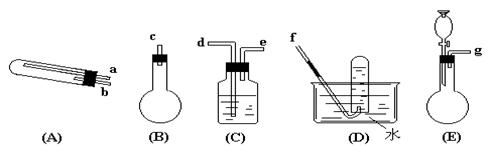 未列出。请按下列要求填写空白:
未列出。请按下列要求填写空白:
(1)按途径I制N2时用浓氨水作原料至少需要用到上述仪器中的哪些仪器?(请按气流从左到右顺序列出仪器序号)
(2)按途径II制N2时,至少需要用到上述仪器中的哪些仪器?(请按气流从左到右顺序列出仪器序号的接口顺序)
(3)按途径I制N2时你所选定的仪器组装的装置中,实验时需要加热的仪器序号是
(4)按途径II制N2时,原料气(空气)是通过向 中加入 而送入反应器的
(5)为了保证途径I制得的N2比途径II制得的N2纯净,是在仪器 中加入
以除去杂质气体
(6)写出在仪器(A)中所发生的化学方程式:
[例4]用下面两种方法可以制得白色的Fe(OH)2沉淀。
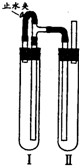 方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入
。
(2)除去蒸馏水中溶解的O2常采用的方法 。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
三、 课堂练习
1、下列实验能成功的是-------------------------------------------( )
A.用食盐、浓硫酸、MnO2混和加热制Cl2 B.将铜丝伸入硫蒸气中得到CuS
C.将白磷放在试管里加强热,冷却后得到红磷
D.足量Cl2通入FeCl2溶液后,将溶液蒸干并灼烧,可得到Fe2O3
2、下列物质的制备合理的是---------------------------------------( )
①硫化铝:将氯化铝溶液与硫化钾溶液混和后过滤;②氯化亚铁:过量的铁与氯气加热反应;③硫酸亚铁:铁先在氧气中燃烧,其产物再与硫酸反应;④硫酸铜:铜先氧化成氧化铜,再与硫酸反应;⑤硫化铜:将铜丝与硫蒸气直接反应
A.④ B.②③⑤ C.③④ D.全部
3、向下列元素的氯化物的水溶液中加入适量的氢氧化钠溶液后,不能得到白色沉淀是 A.Fe B.Al C.Zn D.Cu ( )
4、下面是实验室制取氨气的装置和选用的试剂,其中错误的是
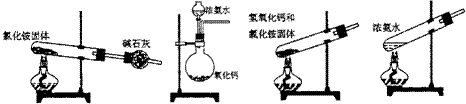
A B C D
5、下列5个有SO2气体产生的反应中:
① S + O2 == SO2
② Na2SO3+ H2SO4(浓) == Na2SO4 + SO2↑+ H2O
③ Cu + 2H2SO4(浓) == CuSO4 + SO2↑+ 2H2O
④ C + 2H2SO4(浓) == CO2 ↑+ SO2↑+ 2H2O
⑤ 4 FeS2 + 11 O2 == 2 Fe2 O3 + 8 SO2
(1)适宜于作实验室制取SO2气体的反应有 (填序号,下同)
(2)现有一套实验室用MnO2和HCl(浓)反应制取Cl2的装置,若采用该装置制取SO2气体,则应选择的反应原理是
6、有一乡村中学由于条件所限,仅有一大一小两种试管和稀硫酸。甲、乙两个学生找来铝制废牙膏皮,各自设计了一种装置,制取并收集一试管氢气。
(1)哪个学生设计的装置比较合理? ,用较合理的装置制取氢气,要使氢气充满收集氢气的试管,应该采取的措施是
(2)实验室还可用 代替稀硫酸与铝反应制取氢气,其反应的离子方程式为 。(必须与上述反应原理不相同)
7、简述用铁粉制取少量氧化铁;用铜粉制取少量硫化铜的实验步聚
第十二讲:常见物质的实验室制法答案
例题评析
[例1]A [例2](1)acde (2)浓硝酸、水、块状大理石
[例3] (1) BACD或EACD
(2) gabf
(3) BA或(E)A (4) E或分液漏斗 、
蒸馏水或水
(5) C 、 浓硫酸
(6) 2NH3+3CuO == N2+3Cu+3H2O 2Cu+O2== 2CuO
[例4] 方法一 (1)稀H2SO4 铁屑
(2)煮沸
(3)避免生成的 Fe(OH)2沉淀接触O2
方法二 (1)稀 H2SO4 铁屑
(2)NaOH溶液
(3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的H2纯净时,再夹紧止水夹。
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。
课堂练习
1、AD 2、A 3、D 4、AC
5、(1)②③ (2)③
6、(1)乙 将小试管伸入的试管底部,待小试管中充满气体后,再慢慢将大试管提起
(2)NaOH溶液 2Al + 2 OH- + 2 H2O == 2AlO2- + 3H2↑
7、【答】:(1)把铁粉放在燃烧匙中加热后,迅速将燃烧匙插入盛满氯气的集气瓶中,铁粉燃烧生成氯化铁。
(2)冷却后,往集气瓶中加入少量馏水并振荡,使生成的氯化铁充分溶解于水,然后加入氢氧化钠溶液,生成氢氧化铁沉淀。
(3)过滤,把滤渣转移到蒸发皿中灼烧,就可得到氧化铁粉未。
【答】:(1)将少量铜粉放入盛有稀硝酸的烧杯中,振荡,使铜粉全部溶解。
(2)过滤,在滤液中滴入硫化钠溶液,再过滤,用蒸馏水洗涤滤渣,最后将滤渣烘干就得硫化铜粉未。
〖提示〗:直接加热硫与铜的混和物得到的不是硫化铜,而是硫化亚铜!