高三化学单元检测 姓名
一、选择题:(每题只有一个选项符合题意)(共32分)
1、下列变化中不属于化学变化的是: ( )
A、 向鸡蛋白溶液中滴入饱和硫酸铵溶液,析出白色沉淀
B、 块状石碱在干燥空气中逐渐变成粉未状
C、 向沸水中滴入饱和氯化铁溶液 D、把红磷加热到来416℃升华冷却得到白磷
2、下列事实中,与胶体性质无关的是: ( )
A、明矾能使混浊的河水变清 B、食盐水能使鸡血凝固
C、将盐卤加入豆浆中能制豆腐
D、三氯化铁溶液中滴入氢氧化钠溶液有红褐色的氢氧化铁沉淀生成
3、用特殊方法把固体物质加工到纳米级(1∽100nm,1nm=10-9m)的超细粉未粒子,然后制得纳米材料。下列分散系中的分散质的粒子直径和这种粒子具有相同的数量级的是( )
A、溶液 B、悬浊液 C、胶体 D、溴水
4、支持固态氨是分子晶体的事实是 ( )
A、氮原子不能形成阳离子 B、铵离子不能单独存在
C、常温下氨是气态物质。 D、氨极易溶于水
5、下列物质的分子中,不存在单个小分子的是 ( )
①冰醋酸,②碳化硅,③过氧化钠,④三氧化硫,⑤二氧化碳,⑥二氧化硅
A、 ①③⑥ B、①②⑥ C、②③⑥ D、②③④⑥
6、能用电解原理说明的问题是: ( )
①电解是把电能转变成化学能;②电解是化学能转变成电能;③电解质溶液导电是化学变化,金属导电是物理变化;④不能自发进行的氧化还原反应,通过电解的原理可以实现,⑤任何溶液被电解时,必将导致氧化还原反应发生。
A、①②③④ B、②③⑤ C、③④ D、①③④⑤
7、电解硫酸铜溶液时,若要达到以下三点要求:阳极质量减少;阴极质量增大;溶液中[Cu2+]不变,可适用的电极是 ( )
A、 纯铜作阳极,含Zn、Ag的铜合金作阴极, B、用纯铁用阳极,纯铜用阴极
B、 用含Zn、Ag的铜合金作阳极,纯铜用阴极,D、用石墨作阳极,用惰性电极作阴极
8、能将含有Cu2+、Fe3+、Fe2+、Al3+、Mg2+、NH4+、Na+、Ag+等八种离子(阴离子忽略)一次性鉴别开来的是: ( )
A、NaOH溶液 B、NaHCO3溶液 C、KSCN溶液 D、氨水
二、选择题(每题有一到两个选项符合题意,多选、错选均不得分。若正确选项有两个,选一个且正确的得2分)(共40分)
9、下列叙述中,正确的是: ( )
①含金属元素的离子不一定都是阳离子;②某元素从化合态变为游离态时,该元素一定被还原;③金属阳离子被还原不一定得到金属单质;④只有一种元素组成的物质肯定是纯净物;⑤只有一种原子组成的物质不一定是纯净物。
A、①②③ B、③④⑤ C、①③⑤ D、②③④
10、下列关于胶体的叙述不正确的是: ( )
A、 布朗运动是胶体粒子特有的运动方式,可以据此把胶体和溶液、悬浊液区分开来
B、 光线透过胶体时,胶体发生了丁达尔现象和产生布朗运动
C、 用渗透的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D、胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
11、X、Y、Z、M分别代表四种金属元素,它们都是主族元素。将X和Z用导线连接放入稀硫酸中,电子通过导线由X流向Z,若电解相同浓度的Y2+和Z2+的溶液,Y先析出。Xn+和M能发生以下反应:mXn++nM=nMm++mX,这四种金属的活动性由强到弱的顺序是?( )
A、M>X>Y>Z B、M>X>Z>Y C、X>Z>M>Y D、X>Y>M>Z
12、已知氢化锂固体不导电,隔绝空气熔融时能导电,它跟水反应能放出氢气。下列有关氢化锂的说法中,正确的是: ( )
A、氢化锂是离子晶体 B、氢化锂的水溶液呈酸性
C、氢化锂是一种常用的氧化剂 D、氢化锂中H-半径大于Li+半径
13、用惰性电极电解M(NO3)X的水溶液,当阴极增重a g时,在阳极上同时产生b升氧气(标况),从而可知M的相对原子质量为 ( )
A、22.4ax/b B、11.2ax/b C、5.6ax/b D、2.5ax/b
14、根据离子晶体的晶胞结构,判断化学式不正确的是 ( )
|
|
|
|



 B
B
|
|
|
|
A、AB2 B、C2D C、EF D、XY3Z
15、用惰性电极实现电解,下列说法正确的是 ( )
A、电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B、电解稀NaOH溶液,要消耗OH-,故溶液pH减小
C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为2∶1
|
|
A、电池放电时,电池负极周围溶液的pH不断增大
B、电池放电时,镍元素被氧化 C、电池充电时,氢元素被还原
D、电池放电时,H2是负极
17、只用胶头滴管和试管,不用其它试剂就可以区别的下列溶液是( )
A、CaCl2和Na2CO3 B、稀H2SO4 和 Na2CO3
C、Ba(OH)2和NaHCO3 D、NaAlO2和HCl
18、某溶液中含有较多的Na2SO4和少量的Fe2(SO4)3。若用该溶液制取芒硝,可供选择的操作有:①加适量H2SO4溶液;②加金属Na;③结晶;④加过量NaOH溶液;⑤加强热脱结晶水;⑥过滤。正确的操作步骤是
( )
A、②⑥③ B、④⑥①③ C、④⑥③② D、②⑥①③⑤
三、(本大题共4小题;共同社33分)
19(10分)、自来水厂用碌矾和氯水一起净化水,请用离子方程式和简要的文字叙述说明原理:
铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾还强,本身在反应中被还原成Fe3+。配平下列制取铁酸钠的化学方程式: Fe(NO3)2+ NaOH+ Cl2= Na2FeO4+ NaCl+ NaNO3+
铁酸钠之所以能净水,除了能杀菌消毒外,另一个原因是:
20(10分)、电解质溶液的pH变化:电解时,由于OH-或H+不断放电,或使得原电解质溶液的浓度的改变;或使得c(H+)或c(OH-)浓度发生改变,溶液的pH也会发生变化。若电解时,只生成H2,而不生成O2,溶液的pH ;若只生成O2,而不生成H2,溶液的
pH ;若既生成H2又生成O2,实际上就是电解 ;此时,若原溶液为弱酸性,其pH ,若为碱性,其
pH ,若为中性,其pH不变;若既不生成H2,也不生成O2,溶液的pH变化不大。
21(9分)、工业上为了处理含Cr2O72-的酸性工业废水,采用下列处理方法:往工业废水中加入适量的NaCl固体,以铁为电极通直流电进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请简要回答下列问题:
①写出两极发生反应的电极反应式。
②写出把Cr2O72-变为Cr3+的离子方程式。
③解释在处理工业废水过程中,溶液的pH不断增大,由酸性变为碱性的原因。
④能否用石墨电极代替铁电极达到电解除铬的目的?为什么?
22(4分)、熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的混合物作电解质。CO为阳极燃气,空气与CO2的混合气体为阴极助,制得在650℃下工作的,完成有关的电池反应式:阳极反应式:2CO+2CO32-→4CO2+4e-;阴极反应式:
总的电池反应式: 。
|
23(8分)、某学生课外活动小组利用右图所示装置分别做如下实验:
![]()
![]()
![]() ①在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是:
①在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是:
![]()
![]()
![]()
![]()
![]()
![]()
![]() ②在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是: 。
②在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是: 。
24(15分)、氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据下图,完成下列填空:①在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液的pH (选填“不变”“升高”或“下降”)。
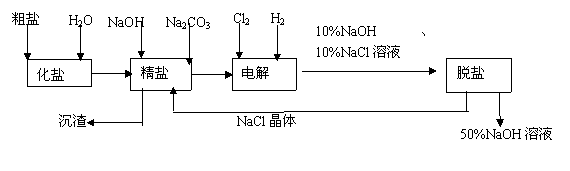
②工业食盐含Ca2+、Mg2+等杂质。精制过程发生反应的离子方程式为
、
③如果粗盐中SO42-含量很高,必须添加钡试剂除去SO42-,该钡试剂可以是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
④为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a,b,c多选扣分)。
A. 先加NaOH,后加Na2CO3,再加钡试剂。
B. 先加NaOH,后加钡试剂,再加Na2CO3
C. 先加钡试剂,后加NaOH,再加Na2CO3
⑤脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷
却、 (填写操作名称)除去NaCl 。
⑥在离子交换膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无交换膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为
四、(本大题共2小题,共22分)
25、1996年诺贝尔化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体,该结构的建立基于以下考虑:
①每个碳原子只跟相邻的3个碳原子形成化学键;
②只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
|
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。请回答下列问题:
⑴固体C60与金刚石相比较,熔点较高者应是 ,理由是 。
⑵试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”) ,并简述其理由:
。
⑶通过计算,确定C60分子所含单键数。C60分子所含单键数为 。
⑷C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中五边形和六边形的数目。C70分子中所含五边形数为 ,六边形数为 。
26、过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某样品的组成,进行如下实验:
⑴称取样品0.270g,灼烧使之完全分解,生成CaO、O2和H2O,得到的O2在标准状况下的体积为33.6mL。
⑵另取0.120g样品,溶于稀盐酸,加热煮沸,使生成的H2O2完全分解,然后将溶液中的Ca2+转化为CaC2O4沉淀,经过滤后,将沉淀溶于热的稀硫酸,用0.02mol/LKMnO4溶液滴定,共消耗31.00mLKMnO4溶液。
化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+
5CaSO4+10CO2+8H2O
①写出CaO2受热分解、溶于盐酸的化学方程式。
②计算样品中CaO2的质量分数。
③计算样品中CaO2•XH2O中的X值。