高三化学单元练习13 电离平衡
一、选择题(本题包括16小题,每小题3分,共48分。)
1. 在下列各化合物中属于强电解质的是 [ ]
A.H3PO4 B.HF C.BaSO4 D.HBr
2. 为除去MgCl2溶液中的Fe3+,可在加热条件下加入一种试剂,过滤后在滤液中加入适量盐酸.符合此要求的试剂是 [ ]
A.NaOH B.MgO C.MgCO3 D.Na2CO3
3. 下列说法正确的是 [ ]
①弱酸弱碱盐是弱电解质
②两种不同的酸溶液混合,溶液也可能显中性
③pH=3和pH=11的溶液等体积混合后,溶液显中性
④两种不同的强酸溶液混合后,溶液的pH可能增大
⑤强酸与盐反应一定得到弱酸
⑥同浓度的钾盐溶液,酸式盐的pH必定小于其正盐的pH
![]()
A.①③⑤⑦ B.②④⑥ C.②③⑥⑦ D.①④⑤
4.在一酸性溶液中,可能存在NO3-,I-,Cl-,Fe3+,SO32-中的一种或几种离子,向该溶液中加入溴水,溴的单质被还原,可以推断溶液中 [ ]
A.含有I-,不能确定是否含有Cl- B.含有 NO3-
C.不含有Fe3+和NO3- D.含有I-,NO3-,Cl-
5.已知A2On2-可与B2-反应, B2-被氧化,产物为B单质;酸根离子被还原,产物为A3+,且知100mL[A2On2-]=0.3mol/L的溶液与150mL[B2-]=0.6mol/L的溶液恰好完全反应, 则n值为 [ ]
A. 4 B. 5 C. 6 D. 7
6. 将pH=2的某酸溶液和pH=12的某碱溶液等体积混合后,所得溶液呈碱性,对此事实分析正确的是 [ ]
A.溶液中仅有生成的盐为强碱弱酸盐
B.稀的强酸溶液与浓的强碱溶液反应
C.浓度小的强酸与浓度大的弱碱液反应
D.不可能是强酸、强碱溶液反应
7. 能正确表示下列反应的离子方程式的是 [ ]

![]()
8. 将等质量的两份锌粉a、b, 分别加入过量的稀硫酸, 同时向a中加少量CuSO4溶液, 右下各图产生H2的体积V(L)与时间t(min)的关系, 其中正确的是 [ ]
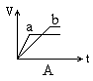
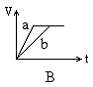
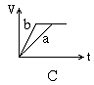
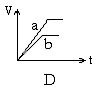
9. 中和10mLpH=2的硫酸溶液,需pH=12的氨水的体积为V1,中和10mLpH=2的醋酸溶液,需pH=12的氢氧化钠溶液的体积为V2,中和10mLpH=2醋酸溶液,需pH=12氨水的体积为V3,则V1、V2、V3三者关系正确的是 [ ]
A.V1 > V3 > V2 B.V2 > V3 > V1
C.V2 > V1 > V3 D.V3 > V2 > V1
10. 工业上为了除去含Cr2O72-离子的酸性废水, 采用以下处理方法:①往工业废水中加入适量的食盐(1—2g/L); ②以铁作为电极进行电解; ③鼓入空气, 经过一段时间后, 使废水中的含铬(有毒)量降到可排放的标准. 其原理是: ①将Cr2O72-离子还原为可溶性三价铬离子; ②要在电解除铬过程中, 使溶液的pH不断升高,使工业废水由酸性变为碱性, 再把三价铬离子变成不溶性氢氧化物除去.在处理废水中使溶液的pH不断升高, 其酸性减弱的本质原因是 [ ]
A. 电解时在阴极氢离子放电 B. 电解食盐水生成了氢氧化钠
C. 电解引起废水的体积变化 D.Cr2O72-转化为Cr3+的反应中消耗了H+
11. 在水电离出的[H+]=1×10-13mol/L的溶液中,可能大量共存的离子组是[ ]
A.K+、Fe2+、Cl-、NO3- B.Ba2+、Na+、Cl-、NO3-
C.Na+、K+、HCO3-、SO42- D.Al3+、NH4+、SO42-、Cl-
12. 下列微粒中,不能促进水电离的是 [ ]
A.含有10个电子,带3个单位正电荷的粒子
B.含有的电子数与质子数均与Na+相同,共含有5个原子核的粒子
C.还原性最弱的非金属阴离子
D.含2个原子核,10个电子的阴离子
13. 下列各组内的三种物质都是以等物质的量混合,将它们溶于水,存在于溶液中的离子都不发生水解的是 [ ]
A.Na3PO4、KCl、Al(NO3)3 B.K2CO3、NaHCO3、CaCl2
C.BaCl2、NaHSO4、NH3·H2O D.FeCl3、NaOH、KOH
14. 将甲基、羧基、羟基、苯基四种原子团两两组合,形成的化合物的水溶液pH小于7,但又不是羧酸的有 [ ]
A.1种 B.2种 C.3种 D.4种
15. 下列说法中, 正确的是 [ ]
A. 盐与盐之间的反应不可能产生气体
B. 盐只能由非金属元素和金属元素组成
C. 酸不能与酸性氧化物反应
D. 胶体溶液一定是电中性
16. 若在NaClO3浓溶液中加入固体KCl, 则可得到重要化工产品KClO3晶体. 下述有关生产原理正确的是 [ ]
A. 变化的化学方程式是: NaClO3+KCl![]() KClO3(结晶)+NaCl
KClO3(结晶)+NaCl
B. KClO3是难溶物
C. KClO3是比NaClO3更弱的电解质
D. 相同温度下, KClO3的溶解度比NaClO3小.
二、(本题包括2小题,共18分。)
17.环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:
![]()

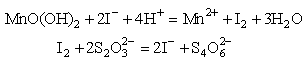
试回答:

(3)测定时,滴定管经蒸馏水洗之后即加滴定剂Na2S2O3溶液,导致测定结果(偏高、偏低、无影响)___________________.
(4)记录滴定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果(偏高、偏低、不影响)__________________.
18.用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙: ① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现 象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处
、
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
三、(本题包括2小题,共17分。)
19.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):
KCN+2KOH+Cl2 → KOCN+2KCl+H2O
被氧化的元素是 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
KOCN+ KOH+ Cl2 → CO2 + N2 + KCl + H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
20.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A![]() H++HA- HA-
H++HA- HA-![]() H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)> α(HA-),设有下列四种溶液:
(A)0.01mol.L-1的H2A溶液
(B)0.01mol.L-1的NaHA溶液
(C)0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(D)0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1) [H+]最大的是
,最小的是 。
(2)[H2A]最大的是
,最小的是 。
(3)[A2-]最大的是
, 最小的是
。
四、(本题包括2小题,共17分。)
21.标准状况下,用一定量的水吸收氨气后制得浓度为12. 0 mol·L-1、密度为0.915 g·cm-3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。
(本题中氨的式量以 17.0计,水的密度以1.00g·cm-3计)
22.

(1)该混合物中氮的质量分数.
(2)硫酸铵的质量分数.
单元练习13 电离平衡
1解析: 答案:CD
2解析: 答案:BC
3解析: 答案:B
4解析: 答案:C
5解析: 答案:D
6解析: 答案:CD
7解析: 答案:AD
8解析: 答案:A
9解析: 答案:B
10解析: 答案:AD
11解析: 答案:BD
12解析: 答案:D
13解析: 答案:A
14解析: 答案:B
15解析: 答案:D
16解析: 答案:AD
17解析:
![]()
18解析:
答:
(1)100mL容量瓶(注:未标明规格的扣1分)(2分)
(2)>b(多选扣分)(各2分,共4分)
(3)配制pH=l的HA溶液难以实现
不妥之处在于加入的锌粒难以做到表面积相同(各2分,共4分)
(4)配制NaA溶液,测其pH值>7即证明HA是弱电解质(2分)
19解析:
答:
(1)碳(或C)
(2)![]()
(3)35.5
20解析:答:
(1) A, D
(2)C, D
(3)D, A
21解析:
答:
1.00L该氨水中含氨的质量为:12.0mol×17.0g·mol-1(1分)
其体积在标准状况下为:12.0mol×22.4L·mol-1(1分)
1.00L该氨水中含水的质量为:1.00L×915g·L-1-12.0mol×17.0g·mol-1
(1分)
其体积为:[1.00L×915g·L-1-12.0mol×17.0g·mol-1]/1000g·L-1(2分)
![]() =378
=378
1体积水吸收378体积NH3气(标准状况)。(2分)
22解析:
