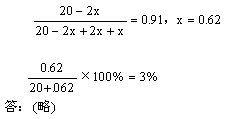高三化学单元练习11 化学平衡(一)
一、选择题(本题包括16小题,每小题3分,共48分。)
1. 酸碱指示剂HIn存在下列平衡HIn(溶液)![]() H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
在下列哪种物质的水溶液中,指示剂显红色 [ ]
A.NaCl B.CaO C.SO2 D.NaOH
2. 在一个不传热的固定容积的密闭反应器里, 可逆反应 mA(气)+nB(气)![]() pC(气)+qD(气)当m、n、p、q为任意正整数时,达到平衡的标志是
[ ]
pC(气)+qD(气)当m、n、p、q为任意正整数时,达到平衡的标志是
[ ]
①体系的压强不再发生改变 ②体系的温度不再发生改变
③各组分的物质的量浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率VA∶VB∶VC∶VD=m∶n∶p∶q
⑥单位时间内, 若消耗了mmolA物质, 同时也消耗了qmolD物质
A. ①③⑤ B. ①④⑥
C. ②③④⑥ D. ①②③④⑤⑥
3. 反应A+2B![]() 2C+Q(Q>0), 已知C是气体, 达平衡后同时升高温度并降低压强, 又达到新的平衡. 若后次平衡时混合物中C的含量与前次平衡时相同, 则下列推断正确的是
[ ]
2C+Q(Q>0), 已知C是气体, 达平衡后同时升高温度并降低压强, 又达到新的平衡. 若后次平衡时混合物中C的含量与前次平衡时相同, 则下列推断正确的是
[ ]
A. A不一定是气态物质 B. A一定是气态物质
C. B一定不是气态物质 D. B一定是气态物质
4. 在一定温度和压强时,同时可用图中同一条曲线表达的两个反应是 [ ]
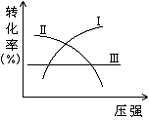 A.N2(气)+3H2((气)
A.N2(气)+3H2((气)![]() 2NH3+Q
2NH3+Q
B.2SO3(气)![]() 2SO2(气)+O2(气)-Q
2SO2(气)+O2(气)-Q
C.H2(气)+I2(气)![]() 2HI(气)-Q
2HI(气)-Q
D.CO(气)+2H2(气)![]() CH3OH(液)+Q
CH3OH(液)+Q
5. 一定条件下, 在容积为2L的密闭容器中, 将2molL气体和3molM气体相混合,发生如下反应: 2L(气)+3M(气)![]() Q(气)+3R(气)
Q(气)+3R(气)
该反应达平衡时, 生成2.4molR, 并测得Q的浓度为0.4mol/L. 下列有关叙述正确的是 [ ]
A. x值为2 B. 混合气体的密度变大
C. 平衡时M的浓度为0.6mol/L D. L的转化率为80%
6. 在密闭容器中进行H2(气)+Br2(气)![]() 2HBr(气)+Q,反应达到平衡后,欲使颜色加深应
[ ]
2HBr(气)+Q,反应达到平衡后,欲使颜色加深应
[ ]
A.升温 B.降温 C.增压 D.减压
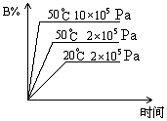 7. 密闭容器中进行下述可逆反应: 2A+B(气)
7. 密闭容器中进行下述可逆反应: 2A+B(气)![]() C(气)+D(气)此反应符合下图的图象,则下列各情况正确的是
[ ]
C(气)+D(气)此反应符合下图的图象,则下列各情况正确的是
[ ]
A.正反应是吸热反应,A是气体
B.正反应是放热反应,A是固体
C.正反应是吸热反应,A是固体
D.正反应是放热反应,A是气体
8. 反应2X![]() Y+Z,已知X是气态,当反应达到平衡时,再减小压强,则导致V正<V逆.下列判断正确的是
[ ]
Y+Z,已知X是气态,当反应达到平衡时,再减小压强,则导致V正<V逆.下列判断正确的是
[ ]
A.Z是固态 B.减压时平衡向右移动
C.Y和Z中必有一种是固态或液态 D.Y和Z不能都为气态,也不能都为固态
9. 在一定条件下,可逆反应mA(气)+nB(气)![]() pC(气)+qD(气)+Q 已达平衡,若升高体系的温度,则达到新平衡后,一定不变的是
[ ]
pC(气)+qD(气)+Q 已达平衡,若升高体系的温度,则达到新平衡后,一定不变的是
[ ]
A.平均相对分子质量 B.质量
C.总物质的量 D.Q值
10. 在一定条件下,向2L密闭容器中充入3molX气和1molY气 ,进行反应:2X(气)+Y(气)![]() 3Z(气)+2W(气) 某时刻测定产物的浓度肯定错误的是
[ ]
3Z(气)+2W(气) 某时刻测定产物的浓度肯定错误的是
[ ]
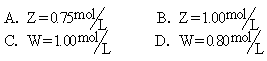
11. 将2.5molA和1.25molB通入容积为1L的真空密闭容器内, 经5s达到下列反应平衡状态: 3A(气)+B(气)![]() C(气)+2D(气)
生成0.5molD, 又知C的平均反应速率是0.1mol/L·s, 则下面说法中正确的是
[ ]
C(气)+2D(气)
生成0.5molD, 又知C的平均反应速率是0.1mol/L·s, 则下面说法中正确的是
[ ]
①A的转化率为20%, ②B的转化率为25%, ③A的平均反应速率为0.15mol/L·s, ④方程式中p=2, ⑤B的平均反应速率为0.5mol/L·s.
A. ①② B. ②③ C. ③④ D. ④⑤
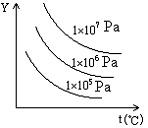 12. 下图表示外界条件(温度、压力)的变化对下列反应的影响,在图中Y轴是指
[ ]
12. 下图表示外界条件(温度、压力)的变化对下列反应的影响,在图中Y轴是指
[ ]
L(固)+C(气)![]() 2R(气)-Q
2R(气)-Q
A.平衡混合气中R的物质的量分数
B.平衡混合气中C的物质的量分数
C.C的转化率
D.L的转化率
13. 在一定条件下,在密闭容器内2CO2![]() 2CO+O2反应达到平衡该体系的平均相对分子质量为M,在此条件下,用来表示CO2分解率的公式:
[ ]
2CO+O2反应达到平衡该体系的平均相对分子质量为M,在此条件下,用来表示CO2分解率的公式:
[ ]

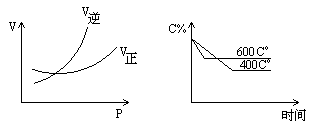 14. 下列两图中,C%表示某反应物在体系中的质量分数,V表示反应速率,p表示压强,t表示反应时间,左图为温度一定时压强与反应速率的关系曲线;右图为压强一定时,在不同时间C%与温度的关系曲线
14. 下列两图中,C%表示某反应物在体系中的质量分数,V表示反应速率,p表示压强,t表示反应时间,左图为温度一定时压强与反应速率的关系曲线;右图为压强一定时,在不同时间C%与温度的关系曲线
同时符合以上两个图象的反应是 [ ]
A.4NH3(气)+5O2(气)=4NO(气)+6H2O(气)+808.7kJ
B.N2O3(气)=NO2(气)+NO(气)-41.8kJ
C.3NO2(气)+H2O(液)=2HNO3(液)+NO(气)+261.3kJ
D.CO2(气)+C(固)=2CO(气)-171.4kJ
15. 在Na2PO4溶液中存在下列平衡:HPO42-![]() H++PO43-欲使溶液中的HPO42-、H+、 PO43-同时减少,可采取的方法有
[ ]
H++PO43-欲使溶液中的HPO42-、H+、 PO43-同时减少,可采取的方法有
[ ]
A. 加少量盐酸 B. 加入生石灰
C. 加入NaOH固体 D. 加入AgNO3溶液
16. 可变的密闭容器中盛有适量N2、H2混合气体,在一定条件下反应 N2+3H2 ![]() 2NH3,达到平衡时容积为VL,混合气体中氨占体积20%,若压强、温度保持不变,下列推论不正确的是
[ ]
2NH3,达到平衡时容积为VL,混合气体中氨占体积20%,若压强、温度保持不变,下列推论不正确的是
[ ]
A. 原N2、H2混合气体为100VL B. 原N2、H2混合气体为1.2VL
C. 参加反应的N2为0.1VL D. 原混合气体中N2、H2体积比为1:3
二、(本题包括2小题,共18分。)
17.氯化铁稀溶液加热时,颜色逐渐变深,最后析出红棕色沉淀.氯化铁稀溶液存在着水解平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl-Q
Fe(OH)3+3HCl-Q
①由于加热使平衡向_____反应方向移动,所以增大了____程度,使Fe(OH)3的量不断增多,最后Fe(OH)3沉淀而析出.
②若用水不断稀释,浑浊度增大,使水解平衡向_______反应方向移动.
③在配制FeCl3溶液时,为了抑制水解,常常加_______.
18.某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
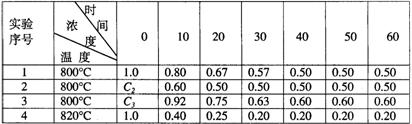
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<且C3 1.0mol/L(填>、=、<=
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
三、(本题包括2小题,共17分。)
19、(A)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH(固) ![]() 5Ca2++3PO43-+OH-
5Ca2++3PO43-+OH-
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是
已知Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。主动脉用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因:
根据以上原理,请你提出一种其它促进矿化的方法:
20.在一个密闭容器里 ,充入amolN2, bmolH2, cmolNH3, 当达到化学平衡时,平衡混合物中含有dmolNH3.
(1)当d>c时,该反应应表示为①______________,以H2浓度变化表示的反应速率是②___________,平衡时NH3的体积分数是③__________;起始压强与平衡压强的比值是④____________.
(2)当d<c时,该反应应表示为①____________,以H2的浓度变化表示的平均反应速率是②__________,平衡时NH3的体积分数是③______,起始压强与平衡压强的比值是④_____________.
四、(本题包括2小题,共17分。)
21.加热时N2O5依下式分解:
N2O5![]() N2O3+O2;N2O3又依下式分解:
N2O3+O2;N2O3又依下式分解:
N2O3![]() N2O+O2
N2O+O2

(1) t℃时N2O5和N2O的平衡浓度______mol/L.
(2)N2O5的分解率______%.
22.在常压和500℃时把O2和SO2按1:2体积比混合,如果混合前O2为10mol,平衡混合气中SO3占总体积的91%,
求:(1)平衡时有多少摩O2转化?
(2)混合气中SO2占总体积的分数?
(3)SO2的转化率是多少?
(4)若在相同条件下,充入20molSO3,则达平衡时O2占混合气中的总体积的分数?
单元练习11 化学平衡(一)
1解析: 答案:C
2解析: 答案:C
3解析: 答案:AC
4解析: 答案:AD
5解析: 答案:D
6解析: 答案:AC
7解析: 答案:B
8解析: 答案:C
9解析: 答案:BD
10解析: 答案:C
11解析: 答案:C
12解析: 答案:B
13解析: 答案:B
14解析: 答案:A
15解析: 答案:B
16解析: 答案:AD
17解析: 答案:正 水解 正 盐酸
18解析:
答:
(1)0.013(2分)
(2)1.0 催化剂(各1分,共2分)
(3)> >(各1分,共2分)
(4)由吸热温度升高时,平衡向右移动(各1分,共2分)
19解析:
答: H++OH-=H2O,使平衡向脱矿方向移动 5Ca2++3PO![]() +F-=Ca5(PO4)3F↓加Ca2+(或加PO
+F-=Ca5(PO4)3F↓加Ca2+(或加PO![]() ,或其它合理的方法均给分
,或其它合理的方法均给分
20解析:
答:

21解析:答:第1空:0.94 第2空:76.5
22解析:
同温,同压下,气体体积之比等于物质的量之比
O2
+
2SO2 ![]() 2SO3
2SO3
起始 10 20 0
转化 x 2x 2x
平衡 10-x 20-2x 2x
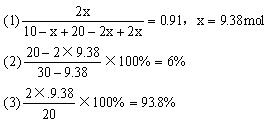
(4)
2SO3 ![]() 2SO2
+
O2
2SO2
+
O2
起始(mol) 20 0 0
转化(mol) 2x 2x x
平衡(mol) 20-2x 2x x