高三化学第二次质量检测卷
化 学
第Ⅰ卷(选择题,共72分)
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27
S—32 Cl—35.5 Ca—40 Fe—56 Zn—65 Ag—108
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.下列变化不符合科学原理的是 ( )
A.稻草变酒精 B.废塑料变汽油
C.空气变肥料 D.水变油
2.白云母是重要的无机硅酸盐材料,它的主要成分为K2Al6Si6(OH)nO18,则n为 ( )
A.4 B.6 C.8 D.10
3.下列物质使用合理的是 ( )
A.用红磷制安全火柴 B.用加酶洗衣粉洗涤毛料服装
C.用甲醛溶液浸泡海产食品 D.用酚醛树脂制作高弹力运动鞋
4.下列各离子化合物中,阴、阳离子的半径之比最小的是 ( )
A.KCl B.NaBr C.LiI D.KF
5.下列物质能使品红溶液褪色的是 ( )
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
A.①③④ B.②④⑤ C.①②③④ D.①②③④⑤
6.六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分
子中含有的共价键的数目是 ( )
A.10 B.12 C.24 D.28
7.某种药物主要成分X的分子结构如下,
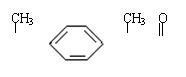 |
H3C—CH— —CH—C—O—CH3 关于有机物X的说法中,错误的是 ( )
A.X难溶于水,易溶于有机溶剂 B.X能跟溴水反应
C.X能使酸性高锰酸钾溶液褪色 D.X的水解产物不能发生消去反应
8.t℃时,某NaCl溶液中蒸发掉a g水或加入b gNaCl均恰好成为饱和溶液,则t℃时NaCl
的溶解度是 ( )
A.![]() B.
B.![]() C.
C.![]() D.无法计算
D.无法计算
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两两个选项,只选
一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.某溶液中加入铝片有氢气产生,则在该溶液中一定能大量共存的离子组是 ( )
A.Cl-、NO3-、Ba2+、Ca2+ B.SO42-、CH3COO-、Al3+、Mg2+
C.Na+、K+、SO42-、Cl- D.NH4+、Ba2+、Cl-、HCO3-
10.下列反应的离子方程式正确的是 ( )
A.苯酚钠溶液中通入二氧化碳:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
B.硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:Ba2++SO42-=BaSO4↓
C.氯化铝溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓
D.氯化亚铁溶液中滴入溴水:2Fe2++Br2=2Fe3++2Br-
11.某氢氧化钠溶液跟醋酸溶液混合后溶液呈酸性,则混合溶液中离子的物质的量浓度之间
关系正确的是 ( )
A.c(Na+)+c(H+)=c(CH3COO-)
B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.c(H+)=c(CH3COO-)-c(Na+)+c(OH-)
12.某金属硝酸盐受热分解生成金属氧化物、二氧化氮和氧气。若生成的二氧化氮和氧气的
物质的量之比为8∶1,则金属元素的化合价在反应过程中的变化是 ( )
A.升高 B.降低 C.不变 D.无法确定
13.下列说法中,正确的是(用NA表示阿伏加德罗常数值) ( )
A.常温常压下,1mol氖气含有的核外电子数是20NA
B.32g氧气和32g臭氧所含氧原子数都为2NA
C.18g水中所含的电子数是8NA
D.标准状况下,1L戊烷完全燃烧后生成的二氧化碳的分子数是5NA/22.4
14.下列实验能取得成功的是 ( )
A.用氢氧化钠溶液和硝酸银溶液检验氯代烃中的氯元素
B.用硝酸银溶液区分二氧化氮和溴蒸气
C.用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫
D.用氢气除去乙烷中混有的少量乙烯
15.容积固定为3L的某密闭容器中加入1molA、2molB,一定温度下发生如下反应:
![]() A(s)+2B(g) C(g)+D(g)经反应5min后,测得C的浓度为0.3mol/L。下列说法中,
A(s)+2B(g) C(g)+D(g)经反应5min后,测得C的浓度为0.3mol/L。下列说法中,
正确的是 ( )
A.5min内D的平均反应速率为0.02mol/(L·min)
B.5min内B的平均反应速率为0.12mol/(L·min)
C.经5min后,向容器中再加入C,正反应速率变小
D.平衡状态时,生成1molD的同时生成1molA
16.能说明醋酸是弱电解质的是 ( )
A.醋酸钠溶液呈碱性
B.用食醋可以除热水瓶内的水垢
C.用浓硫酸和醋酸钠固体共热可制得醋酸
D.pH=2的醋酸溶液稀释1000倍后pH小于5
17.能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是 ( )
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿空气发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解硫酸铜溶液
18.下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的
量是定值的是 ( )
A.CH2=CH2、C2H5OH、HOCH2CH2COOH
B.CH2O、C2H4O2、C6H12O6
C.C6H6、C5H10、C7H6O2
D.H2、CO、CH3OH
第Ⅱ卷(非选择题,共78分)
三、(本题包括2小题,共19分)
19.(12分)已知硫代硫酸钠(Na2S2O3)具有①还原性:2 Na2S2O3+I2= Na2S4O6+2 NaI;
②在酸性条件下能迅速分解:Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O;③BaS2O3难溶
于水。市售硫代硫酸钠固体中常含有硫酸钠。
(1)请写出检验市售硫代硫酸钠中含硫酸钠的操作步骤、所用试剂、实验现象和结论。
A.
B.
C.
(2)利用硫代硫酸钠跟I2反应的性质可定量测定市售硫代硫酸钠的纯度。现取Wg硫代
硫酸钠固体样品配制成VmL的溶液,加入指示剂,用含I2为amol/L的碘水进行滴
定,耗用碘水bmL。回答下列问题:
D.该滴定实验最好是在 (填“强酸性、中性、强碱性”)溶液中进行,
理由是 。
E.滴定过程中指示剂应选用 溶液。
F.样品中硫代硫酸钠纯度的表达式是 。
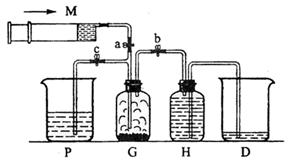
20.(7分)某课外活动小组利用如图所示装置制取氯气。提供的试剂有:浓盐酸、饱和食盐
水、氢氧化钠溶液、高锰酸钾固体。反应的化学方程式为:
|
(1)装置H中盛放的试剂是 。
(2)尾气处理时关闭弹簧夹a和弹簧夹 ,打开弹簧夹 。
(3)处理尾气时,发生反应的化学方程式是 。
(4)用含0.032molHCl的浓盐酸跟足量高锰酸钾固体反应,产生氯气的物质的量应
(填“大于、等于或小于”)0.01mol。
四、(本题包括2小题,共20分)
21.(11分)537℃、1.01×105Pa 时,往容积可变的密闭容器中充入2mol SO2、 1mol O2,
|
2SO2(气)+O2(气) 2SO3(气)
达到平衡时,平衡气体中SO3的体积分数为0.91。
试回答下列问题:
(1)工业上二氧化硫的催化氧化采用常压而不采用高压的原因是:
(2)保持上述温度和压强不变,若向容器中只充入2mol SO3并加入固体催化剂。则
平衡时,SO2的体积分数是 ,容器的体积为 L。
(3)温度仍保持537℃,容器体积保持200L不变(恒容)。充入a molSO2、b molO2,
并加入固体催化剂,反应达平衡时,SO3的体积分数仍为0.91,体系压强为
1.01×105Pa。若a:b=2:1,则a= 。
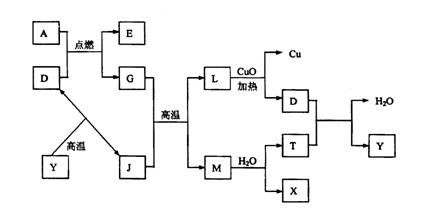
22.(9分)如图所示:
|
其中A、G是固体单质,其余是化合物。X是常用于切割和焊接金属的可燃性气体;Y
是一种难溶于水的白色固体,它的式量是100。
请填空:
(1)D的电子式是 。
(2)A跟D反应的化学方程式是 ;
该反应的反应热△H
(填“<、=、>” ![]() 。
。
(3)在高温条件下,G跟J反应的化学方程式是 。
五、(本题包括2小题,共20分)
23.(8分)有机物A仅含有C、H、N三种元素,其相对分子质量不超过200,其中氮元素
的质量分数为10.85%。
(1)有机物A的相对分子质量为 (取整数值)。
(2)写出A的所有可能的分子式 。
(3)关于A的说法正确的是
A.可能是芳香烃 B.可能是芳香族化合物
C.晶体的熔点可能很高 D.分子结构中可能只含有单键
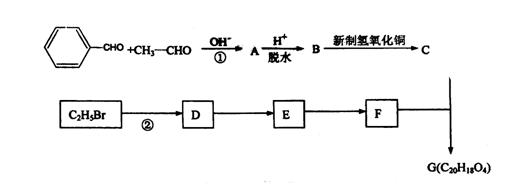
![]() 24.(12分)已知:R—CHO+R′—CH2—CHO
R—CH—CH—CHO 。
24.(12分)已知:R—CHO+R′—CH2—CHO
R—CH—CH—CHO 。
有机物G(C20H18O4)是一种酯,合成路线如下:
|
试回答下列问题:
(1)指出反应类型:反应① ;反应② 。
(2)A的结构简式是 ;F的结构简式是 。
(3)B转化为C的化学方程式是(有机物用结构简式表式):
(4)写出有机物C的所有同时含碳碳双键、苯环和羧基的同分异构体(不包括有机物
|
、 、 、 。
六、(本题包括2小题,共19分)
25.(7分)20℃、1.01×105Pa 时,将ALHCl气体溶于BL水中,形成了密度为Cg/cm3的盐
酸。设该条件下气体摩尔体积为VmL/mol。用含字母的代数式表示:
(1)盐酸中HCl的物质的量浓度。
(2)取上述所得盐酸体积的十分之一跟足量的锌粒反应,在20℃、1.01×105Pa 时可产生
多少升氢气?
26.(12分)现有Na2O2和NaHCO3固体混合物0.06mol,在密闭容器中加热到250℃,让其
充分反应后排出气体(包括水蒸气),冷却,称得残留固体质量为Ag。设混合物中Na2O2
为xmol(0<x<0.06),当x取不同数值时,气体的成分、残留固体成分会发生变化。请完
成下表(A值可以用包含x的式子表示):
| x值 | 气体成分 | 残留固体成分 | A值 |
| 0<x<0.02 | Na2CO3 | ||
| H2O 、O2 | A=4.24 | ||
| H2O 、O2 | Na2CO3、NaOH | A=3.96+14x | |
| x=0.03 | O2 | A=4.38 | |
| 0.03<x<0.06 | Na2CO3、NaOH 、Na2O2 |
2003年南京市高三化学质量检测卷参考答案及评分标准
第Ⅰ卷(共72分)
一、1.D 2.C 3.A 4.D 5.D 6.B 7.B 8.C
二、9.C 10.D 11.CD 12.A 13.B 14.BC 15.BD 16.AD 17.C 18.AC
第Ⅱ卷(共78分)
三、(19分)
19.(共12分)(1)A.取少量试样溶于水制成溶液(2分)。B.加入足量的盐酸,有沉淀产生,过滤(或
静置)(2分)。C.取滤液(或静置后的上层清液)加入氯化钡溶液,有白色沉淀产生,说明样品中有
硫酸钠(2分)。(2)D.中性(1分);酸性条件古,硫代硫酸钠会分解(1分),碱性条件下,碘能跟
碱发生反应(1分)。E.淀粉溶液(1分)。F.(31.6ab/w)% (2分) 20.(共7分)(1)饱和食盐
水(1分)。(2)b、c各0.5分,共1分。(3)2NaOH+Cl2=NaCl+NaClO+H2O(3分)。(4)小于(2分)。
四、(20分)21.(共11分)(1)常压下,三氧化硫的含量已达到91%,从降低成本考虑,没有必要再加
|
22.(共9分)(1) (2分)
|
|
(2)2Mg+CO2=====2MgO+C(3分),小于(1分)(3) CaO+3C=====CaC2+CO↑(3分)
五、(20分)23.(8分)(1)129(2分) (2)C9NH7、C8NH19(各2分,共4分)
(3)B、D(共2分,选一个且正确的得1分,有错选该小题得0分)
|
(2) (各2分,共4分)
|
|
(3)
 | |||
| |||
(4) 、 、 (各1分,共3分)
六、(19分)25.(共7分)(1)![]() (4分) (2)A/20L(3分)
(4分) (2)A/20L(3分)
26.(12分)
| x值 | 气体成分 | 残留固体成分 | A值 |
| CO2、H2O 、O2(1分) | A=3.18+53x(3分) | ||
| x=0.02(1分) |
| Na2CO3(1分) | |
| 0.02<x<0.03(1分) | |||
|
| Na2CO3、NaOH(1分) | ||
| O2(1分) |
| A=4.08+10x(3分) |