高考化学模拟试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试时间120分钟。可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Ca:40 Fe:56 Br: 80 Cu: 64
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题3分,共24分;每小题只有一个选项符合题意)
1.近几年,国际上提出了:“预防污染”这一概念,绿色化学是“预防污染”的根本手段。针对“吸烟”而言,下列活动属于实施绿色化学活动的是: ( )
A.处理废弃物——烟灰、烟蒂 B.治理 污染点——通风、排除烟雾
C.减少有毒物——使用过滤嘴、低焦油烟 D.杜绝污染物——禁烟、戒烟
2.下列物质:①苯酚 ②淀粉 ③油脂 ④蛋白质 ⑤硝基苯 ⑥明矾 ⑦氯乙烷
⑧皓矾 ⑨水玻璃 ⑩碘化钠。不能发生水解的是 ( )
A.①⑤⑩ B.③⑥⑨ C.②④⑦⑧ D.①②④⑩
3.下列一种试剂可以将乙醇、乙醛、乙酸、甲酸四种无色液体鉴别的是 ( )
A.银氨溶液 B.浓溴水
C.FeCl3溶液 D.新制Cu(OH)2悬浊液
4.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是2Ni(OH)2 ![]() H2+2NiO(OH)。根据此反应式判断,下列叙述中正确的是
( )
H2+2NiO(OH)。根据此反应式判断,下列叙述中正确的是
( )
A.电池放电时,电池负极周围溶液的OH_不断增大 B.电池放电时,镍元素被氧化
C.电池充电时。氢元素被氧化 D.电池放电时,H2是负极
5.下列实验操作中正确的是 ( )
A.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B.称量时,托盘天平的右盘放称量物,左盘放砝码
C.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面
D.制乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中
6.下列说法正确的是 ( )
A 在0.2L0.5mol/LAlCl3溶液中Al3+数目为0.1N是Cl - 数目的1/3
B 标况下28gN2、CO混合气体中含有的原子数为2N
C 31g白磷中含有N个P-P键
D 电解饱和NaCl溶液时若共收集到22.4L气体(标况)则共转移电子2N个
7、下列各物质中所含的少量杂质,用括号内的物质能除去的,并且不引进其它杂质的是 ( )
A、苯中含有的苯酚(溴水) B、乙酸乙酯中少量乙酸(水)
C、溴苯中含有少量的溴(四氯化碳) D、CO2中所含的HCl(饱和的NaHCO3)
8.常温下,某溶液中,由水电离出的氢离子的物质的量浓度为10-14mol/L,该离子中可能大量共存的离子组是 ( )
A.Ba2+、Na+、SO42-、Cl- B.S2-、Na+、HCO3-、K+
C.Mg2+、Fe2+、SO42-、Cl- D.NH4+、Na+、SO32-、Cl-
二、选择题(本题包括10小题,每小题5分,共50分;每小题有一个或两个选项符合题意)
9.下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是 ( )
A.稀盐酸,Na2CO3溶液 B.稀H2SO4溶液,NaAlO2溶液
C.Cu,FeCl3溶液 D.浓氨水,AgNO3溶液
10.常温下,把盐酸和氨水等体积混合后,其溶液的pH值恰好等于7,则下列说法中正确的是: ( )
A.溶液中C (NH4+)=C (Cl-)
B.盐酸的物质的量浓度一定小于氨水中的物质的量浓度
C.反应后生成的盐溶液一定没有发生水解
D.盐酸中氯化氢物质的量一定等于NH3·H2O的物质的量
11.下列反应的离子方程式正确的是 ( )
A.硫酸亚铁酸性溶液中加入过氧化氢 4Fe2+ + 2H2O2 + 4H+ = 4Fe3+ + 4H2O
B.氯化铝溶液通入过量氨水 Al3+ + 4OH- = AlO2- + 2H2O
C.碳酸钙溶于醋酸 CaCO3 + 2CH3COOH = Ca2+ + 2CH3COO- + H2O + CO2
D.次氯酸钙溶液中通入过量CO2 Ca2+ + 2ClO- + H2O + CO2 = CaCO3¯ + 2HClO
12.将0.2moL/L的CH3COONa溶液与0.1mol/L的硝酸溶液等体积混合后,溶液中下列粒子的物质的量浓度的关系正确的是 ( )
A C(CH3COO-)+ C (NO3-) +C (OH-)= C (H+) + C (Na+)
B C(CH3COO-)= C (Na+)= C (NO3-)> C(CH3COOH)> C (H+)> C (Na+)
C C(CH3COO-)> C (NO3-)> C(CH3COOH) = C (Na+) >C (H+) > (OH-)
D C (Na+)>C(CH3COO-)> C (NO3-)>C(CH3COOH) > C (H+)> C (OH-)
13.有机物甲的分子式为C9H18O12,在酸性条件下甲水解为乙和丙两种有机物,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲可能结构有( )
A 8种 B 14种 C 16种 D 18种
14.在1升密闭容器中,把1molA和1molB混合发生如下反应:3A(气)+B(气) ![]() xC(气)+2D(气),当反应达到平衡时,生成0.4molD,并测得C的平衡浓度为0.4mol/L,下列叙述中
不正确的是:
( )
xC(气)+2D(气),当反应达到平衡时,生成0.4molD,并测得C的平衡浓度为0.4mol/L,下列叙述中
不正确的是:
( )
A.X的值为2; B.A的转化率为40%;
C.A的平衡浓度为0.4mol/L; D.B的平衡浓度为0.8mol/L.
15. A、B、C三种短周期元素,原子序数按A、B、C依次增大,A元素原子最外层电子数是次外层电子数的2倍,B元素原子的次外层电子数是最外电子数的2倍,C元素原子的最外层电子数是内层电子总数的一半。则下列说法中正确的是 ( )
A. A元素的气态氢化物都是含极性键的非极性分子
B. B元素在自然界的含量最多
C. C元素可以组成不同的单质,它们互为同素异形体。
D. A、B、C的氧化物都能溶于水形成酸
16.乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示成CH2=C=O+HA→CH3COA。乙烯酮在一定 条件下与下列各试剂发生加成反应时所得产物不正确的是 ( )
(A)与HCl加成时得CH3COCl (B)与H2O加成时得CH3COOH
(C)与CH3OH加成时得CH3COCH2OH (D)与CH3COOH加成时得CH3COOCOCH3
17.有一铁的氧化物样品,用140mL5mol·L-1盐酸可恰好使其完全溶解。所得溶液可吸收标准状况下0.56L氯气,使其中的Fe2+全部转化为Fe3+。该样品可能的化学式为 ( )
(A)Fe4O5 (B)Fe5O7 (C)Fe2O3 (D)Fe3O4
18.1.92g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为 ( )
A.504 mL B.336 mL C.224 mL D.168 mL
第Ⅱ卷(非选择题 共76分)
三、实验题(本题包括2小题,共20分)
19.(10分)某学生为将含有少量杂质铜的氯化铁提纯.拟定以下实验步骤:
①把样品加蒸馏水溶解;②过滤除去杂质;③把滤液加热蒸干得到FeCl3晶体.
(1)你认为此方案是否科学,试用化学方程式和简要文字表达其理由.
答: .
(2)请你设计提纯氯化铁方案(只要求写出提纯步骤,最多只允许6步完成).
答:
20.(10分)实验室里用下图示出的装置制取溴化亚铁。其中,A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈管,e是两只耐高温的瓷夹,其中共盛有56g细铁粉。实验开始时先将铁粉加热至600~700℃,然后将干燥、纯净的CO2气流通入D中,E管中的物质开始反应,不断地将d中的液溴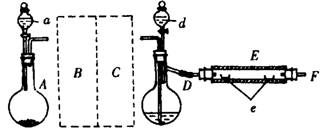 滴入100~120℃的D中,经过几小时的连续反应后在不锈钢管一端沉积有黄绿色鳞片状溴化亚铁80g。
滴入100~120℃的D中,经过几小时的连续反应后在不锈钢管一端沉积有黄绿色鳞片状溴化亚铁80g。
(1)如何检查D装置的气密性?
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为 。
(3)在A中盛有CaCO3,a中盛有6mol·L-1盐酸。为使A中产生的CO2在进入D之前既干燥又纯净,B、C处应设置和各仪器中应盛有何种试剂?
。
(4)实验时,D和E的橡胶塞为什么最好用铝箔包住?
(5)反应过程中要不断地通入CO2,其主要作用是:① ② 。
(6)E中进行的反应是:2Fe+3Br2=2FeBr3,2FeBr3=2FeBr2+Br2↑。此实验中溴化亚铁的产率为 。
(7)为防止污染空气,实验时应在F处连接盛有 的尾气吸收装置。
四、(本题共23分)
21、(11分)用铁作阳极、石墨作阴极电解NaOH溶液,电极反应式别是:阳极 ,阴极 。溶液的PH变化是 。若电解质溶液与空气接触,观察到的现象是 ,原因是 (用化学方程式表示)。当放出22.4升气体(标况),欲使溶液恢复原有组成应加入 。其质量是 。
22.(12分)根据下面物质间转换的框图,回答有关问题:
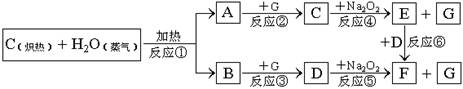
(1)由反应①产生的A、B混合物的工业名称是 。
(2)写出框图中D、E的电子式:D ;E
(3)如果2mol Na2O2与足量水蒸气反应,可得标准状况下气体的体积是多少 L,同时反应中转移电子总数是 。(NA表示阿佛加德罗常数)
(4)请设计一个课堂小实验,证实反应⑤是放热反应。
(5)如果A、B混合气体7.8g(平均摩尔质量10g·mol-1),在与G充分反应后,通过足量Na2O2层,可使Na2O2增重 g,并得到O2 mol。
五、(本题包括2小题,共19分)
23.(9分)CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘胶剂等,如下图所示:
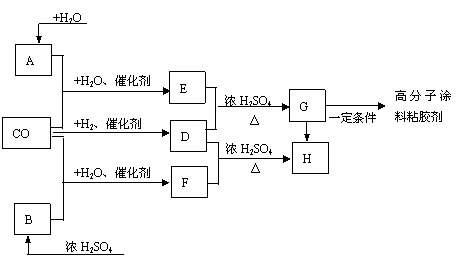
电石
酒精
图中G(RCOOR’)有一种同分异构体是E的相邻同系物;而H有一种同分异构体则是F的相邻同系物。已知D由CO和H2按物质的量之比为1:2完全反应而成,其氧化产物可发生银镜反应;H是含有4个碳原子的化合物。
试推断:
(1)写出B、E、G的结构简式
B: E: G:
写出与G同类别的两个G的同分异构体的结构简式
(2)完成下列反应的化学方程式
①A+CO+H2O![]()
②F+D![]()
③G![]() 高分子化合物
高分子化合物
24.(10分)手性分子是早就为化学工作者熟知的,但美国和日本的三位科学家却因为他们在手性分子可用来加速并控制化学反应方面的创造性工作,分享了2001年诺贝尔奖。在有机物分子中,若某碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡只有一个手性碳原子的物质一定具有光化学活性。
(1)写出只含有一个碳原子的手性分子的结构式 。
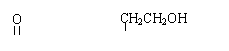 |
(2)某有机物A(CH3—C—O—CH2—CH—CH2CHO)是否具有光学活性 (“是”或“否”),若要使其具有或失去光学活性,其发生的反应类型可以是 。
①酯化;②消去;③加成;④水解;⑤氧化;⑥还原
(3)某有机物B(C3H7O2N)具有如下性质:a. 既能与强酸反应,又能跟强碱反应; b. 具有光学活性。试回答:
①写出B中官能团的名称 。
②写出B的结构简式 。
③若2分子B在一定条件下生成环状结构化合物C,则C的结构简式为 。
④若B在一定条件下生成高分子化合物D,写出B→D的化学方程式 。
⑤写出B的一个不属于同类别的同分异构体结构简式 。
六、(本题包括2小题,共14分)
25.将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加 入50mL1mol·L-1的盐酸,可恰好使反应过程中产生的沉淀刚好消失。求原混合物中铝、过氧化钠各多少克?
26.在常温常压下,把a mol的NH3和O2的混合气充入密闭容器中,在催化剂存在下加热,使其充分反应,然后恢复到原来的温度和压强.
(1)写出容器内NH3被氧化和形成HNO3的化学方程式.
(2)若原混合气中O2的体积分数为x,最后在容器中生成的HNO3为ymol.
请填写下表.
| x的取值范围 | 用x表示的y值表示式 |
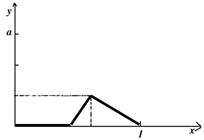
(3)在坐标图上画出y=f(x)的关系曲线.
高考化学模拟试卷答案
第Ⅰ卷(选择题 共74分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 选项 | D | A | D | D | A | B | D | C | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 选项 | C | AB | AC | AD | C | B | C | C | B | B |
第Ⅱ卷(非选择题 共76分)
19.(1)不科学.加水后2FeCl3+Cu==CuCl2+2FeCl2,过滤不能除去CuCl2;在 溶液蒸干过程中FeCl3+3H2O![]() Fe(OH)3+3HCl
Fe(OH)3+3HCl
(2)①加蒸馏水溶解;②加过量Fe粉;③过滤除去Cu和过量Fe;④通入适量氯气;⑤加入少量氯化氢气体; ⑥蒸发浓缩结晶得到FeCl3晶体.
20.(1)关闭d的活塞,夹紧C、D间的胶管,将F的出口导管插入水中,用手捂住D,或微热,若F 的导管处有气泡冒出,松开手后水又回升到F的导管中,则证明D的气密性良好(即不漏气)
(2)3Fe+4H2O![]() Fe3O4+4H2↑
Fe3O4+4H2↑
(3)B处应设置盛有NaHCO3饱和溶液的洗气瓶,C处应设置盛有浓H2SO4的洗气瓶
(4)因Br2会腐蚀橡胶塞
(5)①将容器中的空气赶净,②将Br2蒸气带入反应器D中
(6)37.04% (6)NaOH溶液
21.阳极 Fe-2e-=Fe2+ ,阴极 2H2O+2e-=H2+2OH- 。溶液的PH变化是 变大 。现象是 先生成白色沉淀,迅速转变为灰绿色,最后变成红褐色。 ,原因是 4Fe(OH)2 +O2+2H2O+2e-=4Fe(OH)3 (用化学方程式表示)。当放出22.4升气体(标况),欲使溶液恢复原有组成应加入 H2O 。其质量是 45g 。
22(1)水煤气
(2)略
(3)1.12L NA
(4)Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应(直接通CO2于被棉花包裹Na2O2也可,其它合理答案也给分,
(5)7.8g
0.39mol
23(1)B:CH2=CH2 E:CH2=CH—COOH G:CH2=CH—COOCH3;
 HCOOCH2CH=CH2 CH3COOCH=CH2
HCOOCH2CH=CH2 CH3COOCH=CH2
![]() (2)①CH==CH+CO+H2O
CH2=CH—COOH
(2)①CH==CH+CO+H2O
CH2=CH—COOH
②CH3CH2COOH+CH3OH CH3CH2COOCH3+H2O
|
![]() ③nCH2=CHCOOCH3
[ CH2—CH ]n
③nCH2=CHCOOCH3
[ CH2—CH ]n
COOCH3
24、(1) F—C—I等 (2) 是 ①③⑤⑥
![]() (3) 1 氨基,羧基
2 CH3—CHCOOH 3 略
(3) 1 氨基,羧基
2 CH3—CHCOOH 3 略
 4 nCH3CHCOOH [NHCHCO
]n+nH2O
4 nCH3CHCOOH [NHCHCO
]n+nH2O
5 CH3CH2CH2NO2
25.Al-Na2O2在水中发生的反应分别为2Na2O2+2H2O=4NaOH+O2↑和2Al+2NaOH+2 H2O=2NaAlO2+3H2↑,加入盐酸后又发生了反应NaOH+HCl==NaCl+H2O、NaAlO2+HCl+H2O=Al(OH)3↓+NaCl、Al(OH)3+3HCl=AlCl3+3H2O,可见,最后 所得溶液中的溶质是NaCl和AlCl3。综合上述五个化学方程式可得如下关系式:Al~NaAlO2~Al(OH)3~AlCl3~3HCl,Na2O2~2NaOH~2NaCl~2HCl,设原混合物中xmolAl, 有ymolNa2O2,则依关系式
Al ~ 3HCl Na2O2 ~2HCl
x 3x y 2y
和题给数据可建立等式27x+78y=1.05(①式)和3x+2y=1×50×10-3(②式),联立①②两式并解之,x=y=0.01(mol),进而可知Al的质量为0.01×27=0.27(g),Na2O2的质量为0 .01×78=0.78(g)
26.解:(1)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
2NO+O2![]() 2NO2
2NO2
3NO2+H2O![]() 2HNO3+NO
2HNO3+NO
 (2)
(3)
(2)
(3)
| x的取值范围 | 用x表示的y值表达式 |
| 0<x≤ | y=0 |
|
| y=(3x- |
|
| y=(1-x)a |