高考化学模拟试卷三
第I卷(选择题,共72分)
可能用到的相对原子质量:H 1 C 12 N14 O 16 Na 23 S 32 Cl 35.5
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.我国已确定2005年在冰箱生产中停止使用氟里昂(如CCl2F2、CHClF2等)作致冷剂。该致冷剂确有许多优点,但又具有破坏大气臭氧层的严重缺点。据研究,产生这一缺点的原因在于它们的组成中含有 [ ]
A.氟元素 B.氯元素 C.碳元素 D.氢元素
2.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是 [ ]
A. 13C与15N有相同的中子数 B. 13C与C60互为同素异形体
C. 15N与14N互为同位素 D. 15N的核外电子数与中子数相同
3.最近,科学家冶炼出了纯度高达99.9999%的铁,根据所学化学知识判断该铁可能具有的性质有 [ ]
A.与相同浓度的盐酸反应生成氢气的速率比生铁快
B.硬度比生铁高
C.相同条件下比生铁易被腐蚀
D.在冷的浓硫酸中可钝化
4.下列除去杂质的方法正确的是 [ ]
A.乙烷气体中混有少量乙烯:通入氢气,使乙烯发生加成反应
B.二氧化碳气体中混有少量二氧化硫:通入酸性高锰酸钾溶液后,收集气体
C.乙醇中混有少量乙酸:加入氢氧化钠溶液后,分液
D.氯化钠溶液中混有少量硫酸钠:加适量硝酸钡溶液,过滤
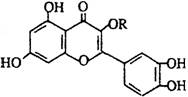 5.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
5.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是
A.可以和溴水反应 [ ]
B.可用有机溶剂萃取
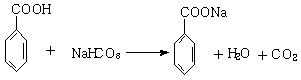
C.分子中有三个苯环
D.1mol维生素P可以和4molNaOH反应
6.2003年10月15日,我国成功地发射了第一个载人航天飞船——“神舟”五号,从此向全世界宣告我国进入航天大国和航天强国。此次发射用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成氮气和水蒸气。已知:N2 (g) + 2O2 (g) = 2NO2 (g); △H =+ 67.7 kJ · mol-1,N2H4 (g) + O2 (g) = N2 (g) + 2H2O (g);△H = -534 kJ · mol-1。下列关于肼和二氧化氮反应的热化学方程式中,正确的是 [ ]
A.2N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (l);△H = -1135.7 kJ · mol-1
B.2N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (l);△H = +1135.7 kJ · mol-1
C.N2H4 (g) + NO2 (g) = 3/2N2 (g) + 2H2O (l);△H = -1135.7 kJ · mol-1
D.2N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g);△H = -1135.7kJ · mol-1
7.在医院中,为酸中毒病人输液不应采用 [ ]
A.0.9%氯化钠溶液 B.0.9%氯化铵溶液
C.1.25%碳酸氢钠溶液 D.5%葡萄糖溶液
8.某厂以辉铜矿(主要成分为CuFeS2)为原料经煅烧、还原(用焦炭为还原剂)等步骤炼得粗铜,再经电解法冶炼得紫铜。从工业经济综合效益、环保等角度考虑,该厂的附近应建一个 [ ]
A.钢铁厂 B.发电厂 C.硫酸厂 D.合成氨厂
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.在pH=1的溶液中,一定可以大量共存的离子组是 [ ]
A.Cl-、AlO2-、Na+、K+ B.SO42-、NO3-、Fe2+、Mg2+
C.Na+、Fe3+、SO42-、Cl- D.NH4+、Ba2+、Cl-、HCO3-
10.下列反应的离子方程式正确的是 [ ]
A.三氯化铁浓溶液滴入沸水中,制取氢氧化铁胶体Fe3++3H2O Fe(OH)3↓+H+
B.碳酸氢钠溶液中加入过量澄清石灰水:Ca2++HCO3-+OH- CaCO3↓+H2O
C.氯气跟水反应:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
D.溴化亚铁溶液中滴入过量氯水:2Fe2++Cl2 2Fe3+
+ 2Cl-
11.将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体仍无沉淀产生。则通入的气体可能是 [ ]
A.CO2 B.NH3 C.NO2 D.Cl2
12.NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O=NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是 [ ]
A跟水反应时,水作氧化剂 B NaH中H-半径比Li+半径小
C 跟液氨反应时,有NaNH2生成 D 跟乙醇反应时,NaH被氧化
13.氯酸(HClO3)是一种强氧化性酸。若将铜粉投入氯酸溶液中,下列物质一定不可能生成的是 [ ]
A.氯酸铜 B.高氯酸铜 C.氯化铜 D.氢气
14.下列物质在一定条件下,既能和某些非金属单质、金属单质反应,又能和某些金属氧化物,非金属氧化物反应的是 [ ]
A.NaOH溶液 B.稀![]() C.NaCl溶液 D.
C.NaCl溶液 D.![]()
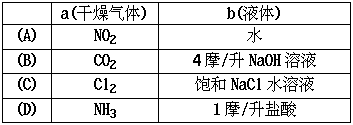
15.在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是 [ ]
16.向10mL 0.1mol/L的![]() 溶液中通入22.4mL(标况)
溶液中通入22.4mL(标况)![]() ,当气体全部溶解时,溶液中微粒浓度关系正确的是
[ ]
,当气体全部溶解时,溶液中微粒浓度关系正确的是
[ ]
A.![]()
B.![]()
C.![]()
D.![]()
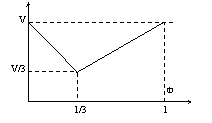 17.某链烃在一定条件下可和H2发生反应,取不同体积比的CnHm与H2(两者的体积和为定值V)在一定条件下反应,V与Φ(CnHm)[CnHm的体积分数]的关系如图。则m和n的关系是
17.某链烃在一定条件下可和H2发生反应,取不同体积比的CnHm与H2(两者的体积和为定值V)在一定条件下反应,V与Φ(CnHm)[CnHm的体积分数]的关系如图。则m和n的关系是
A.m=2n+2 B.m=2n [ ]
C.m=2n-2 D.m=2n-6
18.在一定条件下,萘可被浓硫酸、浓硝酸的混合酸硝化,生成二硝基化合物
1,5-二硝基萘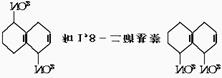 的混合物。后者可溶于质量分数大于98%的硫酸中,而前者却不能。利用这一性质可将这两种异构体分离开来。将这两种硝化产物加入适量的98%硫酸中,充分搅拌,用耐酸漏斗过滤 。要从滤液中得到固体1,8-二硝基萘,应采用的方法是
[ ]
的混合物。后者可溶于质量分数大于98%的硫酸中,而前者却不能。利用这一性质可将这两种异构体分离开来。将这两种硝化产物加入适量的98%硫酸中,充分搅拌,用耐酸漏斗过滤 。要从滤液中得到固体1,8-二硝基萘,应采用的方法是
[ ]
A.蒸发浓缩晶体
B.向滤液中加水后过滤
C.用Na2CO3溶液处理滤液
D.将滤液缓缓加入水中
第II卷(非选择题,共78分)
三、(本题包括2小题,共22分)
19.为测定硫酸铵和氯化铵固体混合物中氯化铵的质量分数,甲、乙两位同学按下列所示的实验步骤进行实验:称量样品、溶解、加过量试剂A、过滤出沉淀B、洗涤沉淀、烘干称量、处理实验数据,得出结果。
⑴实验时,甲同学选用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A。其中 填(“甲”或“乙”)同学选择的试剂A不合理,其理由是
⑵以下都是试剂A选择正确时进行的实验:
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码、过滤器、铁架台及附件、胶头滴管、量筒,其中还缺少的必备仪器是 。
②若过滤所得沉淀未经洗涤即烘干称量,测出的氯化铵的质量分数
(填“偏高”、“偏低”或“不变”)。
③检验加入的试剂A是否过量的方法是
。
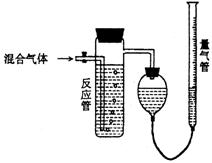 20.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
20.工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
⑴混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
⑵反应管内溶液蓝色消失卮,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
⑶反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
⑷若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
⑸将上述装置改为简易实验装置,除导管外,还需选用的仪器为. (选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
四、(本题包括2小题,共18分)
21.工业上早在十九世纪中叶便已生产的过氧化氢,随着生态环境的保护而日益被重视,成为社会需求迅速增长的化学品,过氧化氢是一种绿色氧化剂,延伸产品及其应用迅速。
⑴有人把氯气通人过氧化氢(H218O2)的水(H2O)溶液中,发生反应:
Cl2+ H218O2=H++Cl-+H18O18OCl H18O18OCl=H++Cl-+18O2
对上述反应的说明错误的是 。
A.氯气通人过氧化氢溶液产生的氧气全部来自过氧化氢
B.氯气通人过氧化氢溶液发生的反应可表示为Cl2+ H2O2=2HCl+O2
C.过氧化氢有氧化性
D.反应中,过氧化氢中氧原子之间的化学键没有变化
⑵在冶炼铜时,需要把粗铜溶解,可用:a.浓硫酸b.焙烧后用稀硫酸c.过氧化氢与稀硫酸三种方法,某厂家最终确定用c方法。
①写出用c方法溶解铜的化学反应方程式
②简述最终选用c方法的理由:
⑶过氧乙酸(CH3COOOH)是常用的一种杀菌消毒的有机物,它可以通过乙酸和过氧化氢反应制得,其化学反应方程式为
22.A、B、C是常见单质,X、Y、Z是氧化物,它们之间有如下转化关系:
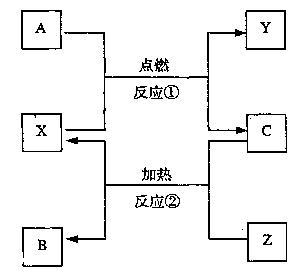
请写出符合下列要求的化学方程式:
(1)若X为CO2,则:
反应① ;
反应② 。
(2)若X为Fe3O4,则:
反应① ;
反应② 。
五、(本题包括2小题,共18分)
23.由C、H、O三种元素组成的有机物A,A的相对分子质量不超过150,其中含碳元素的质量分数为68.9%,含氧元素的质量分数为26.2%。A与NaHCO3溶液反应,生成的气体能使澄清石灰水变浑浊。
回答下列问题:
⑴A的分子式是 。
⑵A与NaHCO3溶液反应的化学方程式是: 。
⑶A的一种同分异构体B,既能与NaOH溶液反应,又能与新制Cu(OH)2反应,且其苯环上的一氯取代物有两种。B的结构简式为 。
24.有机物参加的反应往往比较复杂,常有副反应发生;如下图中乙烯跟溴水反应既可生成A.同时又可生成B和C2H5Br。
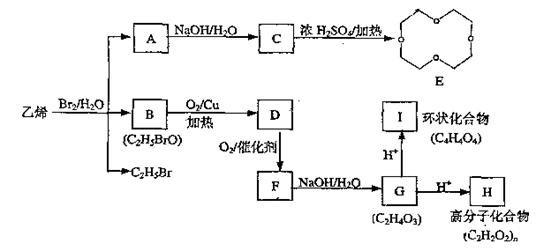
回答下列问题:
⑴环氧乙烷(![]() )的结构可简写为
)的结构可简写为![]() 则E的分子式是 。
则E的分子式是 。
⑵B的结构简式是 ;I的结构简式是 。
⑶写出G转化为H的化学方程式:
⑷化合物A~I中,易发生加成反应的物质是 (填字母)。
六、(本题包括2小题,共20分)
25.合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
⑴1m3(标准状况)CH4按上式完全反应,产生H2 mol。
⑵CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为 。
⑶CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)。
⑷若CH4和H2O(g)及富氧空气混合反应的产物中,V(H2)/V(N2)=3︰1 (合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为何值?
26.在标准状况下,将CO和CO2混合气体共0.1mol,充入盛有3.9gNa2O2的密闭容器中,然后用电火花不断引燃容器内的气体混合物充分反应。若CO2在混合气体中所占的物质的量分数为x。试通过分析和计算,得出x值与剩余气体关系的几种情况,将结果填写在下表中。
| X值 | 剩余气体 | |
| 化学式 | 物质的量 | |
常州市北郊中学高考化学模拟试卷三答题卷
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
二、选择题
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三、19、⑴
⑵①
②
③
20、⑴
⑵
⑶
⑷
⑸
四、21、⑴
⑵①
②
⑶
22、⑴反应① ;
反应② 。
⑵反应① ;
反应② 。
五、23、⑴ 。
⑵ 。
⑶
24、⑴
⑵ 、
⑶
⑷
六、25、⑴
⑵
⑶
⑷
26、
| X值 | 剩余气体 | |
| 化学式 | 物质的量 | |
参考答案
1、 B 2、C 3、D 4、B 5、C 6、D 7、B 8、C
9、C 10、BC 11、A 12、B 13、BD
14、AD 15、C 16、C 17、C 18、D
19、(1)甲 硝酸银既倒与硫酸铵反应生成沉淀,又会与氯化铵反应生成沉淀,从而无法通过测量的数据求出氯化铵的质量分数
(2)玻棒 烧杯 偏低 静置后取上层清夜,滴加Na2SO4溶液,若有沉淀生成,则滴加已经过量。
20.(1)N2、O2的体积
(2)偏低
(3)酸性高锰酸钾溶液或溴水
(4)VSO2%=22.4CVa/(22.4CVa+Vb)×100%(其它合理答案也给分)
(5)bceg或beg或ceg
21.(1)CD (2)Cu+H2O2+H2SO4 =CuSO4+2H2O
a中耗H2SO4量多且有污染气体;b中步骤多,耗能,且可能焙烧不完全造成产量低
(3)CH3COOH+ H2O2=CH3COOOH+ H2O
22.(1)、2Mg+CO2![]() 2MgO+C(条件不写扣1分,不配平扣1分,化学式写错0分,下同)
2MgO+C(条件不写扣1分,不配平扣1分,化学式写错0分,下同)
C+2CuO![]() 2Cu+CO2
2Cu+CO2
(2)、3Fe3O4 +8Al![]() 9Fe+4Al2O3
3Fe+4H2O(气)
9Fe+4Al2O3
3Fe+4H2O(气) ![]() Fe3O4 +4H2
Fe3O4 +4H2
 五、(本题包括2小题,共20分)
五、(本题包括2小题,共20分)
23、(9分,每空3分)(1)、C7H6O2
(2)、 ↑
(3)、![]()
24、(11分)(1)、C8H16O4(2分) (2)、HO-CH2-CH2-Br(2分) ;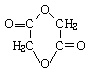 (2分)
(2分)
(3)、nHOOC-CH2OH→![]() + nH2O (3分)
+ nH2O (3分)
(4)、D(2分)
25.(1)133.9
(2)3m3<V<4m3
(3)设H2O为Xmol,O2为Ymol
则:![]() X=10 Y=7.5
X=10 Y=7.5
VO2/VH3=(7.5+2.5)/15=2/3
(4)设富氧空气中O2的体积分数为a,反应用去的H2O(g)与富氧空气的体积分别为X、Y。
(3X+4aY)/[(1-a)Y]=3/1 X/Y=1-7/3a
(用其它方法解得也给分)
26.
| X值 | 剩余气体 | |
| 化学式 | 物质的量 | |
| 0〈X〈0.5 X=0.5 0.5〈X〈1 | CO2 CO2 CO CO2 | 0.05 0.05 CO0.05-0.1X CO20.1X |