高考化学模拟题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,
共150分,考试用时90分钟。
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.北京在申办2008年奥运会时提出了“科技奥运、人文奥运、绿色奥运”的口号。为了使2008年北京奥运会办成绿色奥运会,下列做法不可取的是
( )
A.关闭所有的化工企业
B.用天然气等清洁燃料逐步取代民用燃煤
C.加强对污水处理的监督管理,达标后才允许排放
D.改进汽车尾气处理装置,降低汽车的尾气污染
2.运动员在比赛中腿部受伤时,医生常喷洒一种液态物质,使受伤部位皮肤表面温度很快下降,减轻受伤运动员的痛感。这种物质是 ( )
A.碘酒 B.氟利昂 C.氯乙烷 D.酒精
3.若在宇宙飞船的太空实验室(失重条件下)进行以下实验,其中最难完成的是 ( )
A.用磁铁吸出硫粉中混有的少量铁粉
B.蒸发食盐水制取食盐晶体
C.将含有少量水蒸气的二氧化碳气体通过浓硫酸进行干燥
D.用过滤的方法除去水中的少量泥沙
4.采用循环操作可提高原料的利用率,下列工业生产中,没有采用循环操作的是 ( )
A.硫酸工业 B.合成氨工业 C.硝酸工业 D.氯碱工业
5.一定量的NO2通入过量的NaHCO3溶液,逸出的气体通过装有足量Na2O2的干燥管,充分反应后放出的气体是 ( )
A.CO2 B.NO C.NO2、O2 D.CO2、O2
6.在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可以得到该物质固体的是 ( )
A.AlCl3 B.Na2SO3 C.KMnO4 D.MgSO4
7.强酸与强碱的稀溶液发生中和反应的反应热为:
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol。
分别向1L0.5mol/L的NaOH溶液中加入:①稀醋酸、②浓H2SO4、③稀硝酸,恰好完全反应时的反应热分别为△H1、△H2、△H3,它们的关系正确的是 ( )
A.△H1>△H2>△H3 B.△H2<△H3<△H1
C.△H1=△H2=△H3 D.△H1>△H3>△H2
8.14g Cu-Ag合金与足量的HNO3反应,将放出的气体与1.12 L O2(标准状况下)混合,通入水中,恰好全部吸收,则合金中Cu的质量为( )
A.3.2g B.4.8g C.6.4g D.10.8g
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列各项叙述中正确的是 ( )
A.标准状况下1mol SO3所占体积约为22.4L
B.能使甲基橙试液变黄的溶液不一定显碱性
C.FeCl2可通过化合反应制取
D.SiO2是酸性氧化物,不能与任何酸反应
10.下列电离方程式书写正确的是 ( )
![]()
![]()
![]() A.H2CO3 2H++CO32- B.CaCO3 Ca2++CO32-
A.H2CO3 2H++CO32- B.CaCO3 Ca2++CO32-
![]() C.HS-+H2O H3O++S2- D.HPO42-+H2O H2PO4-+OH-
C.HS-+H2O H3O++S2- D.HPO42-+H2O H2PO4-+OH-
11.已知反应XeF4+2CH3-CH=CH2→2CH3CH2CHF2+Xe,下列说法正确的是 ( )
A.该反应不属于氧化还原反应
B.XeF4既是氧化剂,又是还原剂
 C.反应中电子由Xe转移到C
C.反应中电子由Xe转移到C
D.氧化剂与还原剂的物质的量之比为1∶2
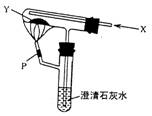
12.按右图装置持续通入气体X,并在管口点燃,结果使澄清石灰水变浑浊,则X、Y可以是
A.H2和NaHCO3 B.CO和Na2CO3
C.CO和CuO D.H2和Fe2O3
13.家用消毒液发生器是化学知识在日常生活中的“创新”应用。该发生器利用常见的精盐和自来水为反应物,通电时,发生器电解槽里的极板上产生大量气泡,切断电源后所得消毒液具有强烈的杀菌能力,且对人体无害,在发生器内发生的反应是 ( )
A.2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
B.H2+Cl2![]() 2HCl
2HCl
C.Cl2+2NaOH==NaCl+NaClO+H2O
D.NaClO+HCl==NaCl+HClO
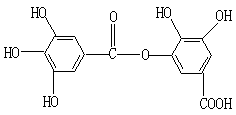 14.一种有机物的结构简式为
14.一种有机物的结构简式为
关于它的性质不正确的说法是 ( )
A.它有酸性,1mol该物质最多能与6 mol H2反应
B.它可以水解,水解产物有两种有机物
C.在一定条件下,1mol该物质最多能和8 mol NaOH反应
D.该有机物能发生取代反应
![]()
 |
15.可逆反应aA(g) bB(g)+cC(g)在反应过程中,当其它条件不变时,C的体积条件不变时,C的体积分数[
A.达到平衡后,加入催化剂,![]() (C)将增大
(C)将增大
B.达到平衡后,升温,平衡逆向移动
C.达到平衡后,减压,A的转化率变大
D.a>b+c
16.下列实验方案合理的是 ( )
A.混有少量乙酸、乙醇杂质的乙酸乙酯用饱和Na2CO3溶液除杂
B.用加入浓溴水的方法分离苯和苯酚的混合物
C.用燃烧的方法除去CO2中混有的少量CO
D.用热的氧化铜除去N2中混有的少量O2
17.某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等四种阴离子,若向其中加入足量Na2O2后(设溶液体积不变),溶液中上述离子浓度基本保持不变的是 ( )
A.CH3COO- B.SO32- C.CO32- D.HCO3-
18.在100mL 0.10mol/L的AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入100mL溶有0.010mol CuSO4·5H2O的溶液,充分反应。下列说法中正确的是 ( )
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.01mol/L
第Ⅱ卷(非选择题 共78分)
三、(本题包括1小题,共18分)
19.(18分)维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6,人体缺乏这种维生素可能得坏血症,所以维生素C又称抗坏血酸。在新鲜的水果、蔬菜、乳制品中都含有丰富的维生素C,如新鲜橙汁中维生素C的含量在500mg/L左右。
校课外活动小组测定了某牌子的软包装橙汁中维生素C的含量。下面是测定实验分析报告。(请填写有关空白)
(一)测定目的:测定××牌软包装橙汁维生素C含量
(二)测定原理:C6H8O6+I2→C6H6O6+2H++2I-
(三)实验用品及试剂:
(1)仪器和用品:(自选,略)
(2)试剂:指示剂______________(填名称)、浓度为7.50×10-3mol/L标准碘溶液、蒸馏水等。
(四)实验过程:
(1)洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
(2)打开橙汁包装,目测:颜色——橙黄色,澄清度——好。用________(填仪器名称)向锥形瓶中一如20.00mL待测橙汁,滴入2滴指示剂。
(3)用左手控制滴定管的_________(填部位),右手摇动锥形瓶,眼睛注视____________,直到滴定终点,滴定至终点的现象是__________________。
(五)数据记录与处理:(请在空白处设计数据记录和数据处理的表格,不必填数据)。
若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是________mg/L。
(六)问题讨论:
(1)滴定是能否剧烈摇动锥形瓶?为什么?_________________________,_______________________________________________________________。
(2)从分析数据看,此软包装橙汁是否纯天然橙汁?________(A.是;B.可能是;C.不是——填编号)。制造商可能采取的做法是_______(A.加水稀释天然橙汁;B.橙汁已被浓缩;C.将维生素C作为添加剂)。你是否同意这种做法?________(A.同意;B.不同意;C.调查后再作结论)。
四、(本题包括2小题,共23分)
20.(13分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
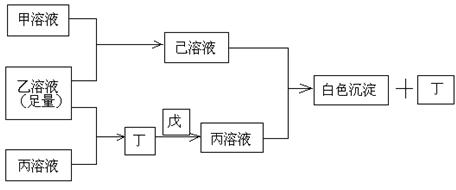
请回答:
(1)写出C元素的原子结构示意图_______________,写出丁和戊的电子式____________、_________________;
(2)用有关化学用语解释:
乙溶液呈酸性的原因____________________________;
丙溶液呈碱性的原因____________________________;
(3)写出有关反应的离子方程式:
①乙溶液+丙溶液→丁______________________________;
②己溶液+丙溶液→丁______________________________。
21.(10分)25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)_________,其理由是___________________
(2)a值可否等于5(填“可”或“否”)________,其理由是____________________
(3)a的取值范围是_______________________________________。
五、(本题包括2小题,共22分)
22.(10分)1mol某烃A充分燃烧后可以得到8mol CO2和4mol H2O。该烃在不同条件下能发生下图所示的一系列变化。
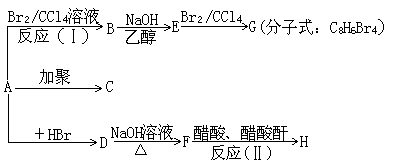
已知:
请填空:
(1)反应类型:反应(Ⅰ)为________反应,反应(Ⅱ)为________反应。
(2)有关物质的结构简式:
C为___________,D为_________,E为___________,H为___________。
(3)D→F反应的化学方程式为___________________________________。
23.(12分)今有化合物
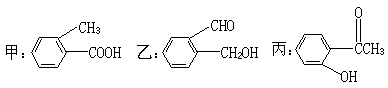
(1)请写出乙中含氧官能团的名称:___________________;
(2)请分别写出鉴别甲、丙化合物的方法(指明所选试剂及主要现象即可):
鉴别甲的方法:______________________________________________;
鉴别乙的方法:______________________________________________;
(3)请按酸性由强至弱排列甲、乙、丙的顺序:__________________;
(4)请判别上述哪些化合物互为同分异构体:_____________________;
(5)丙有很多同分异构体,请写出含有酯基和一取代苯结构的同分异构体结构简式两个________________________、___________________________。
六、(本题包括1小题,共15分)
24.(15分)在标准状况下进行甲、乙、丙三组实验,三组各取30mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 生成气体体积(mL) | 280 | 336 | 336 |
(1)甲组实验中,盐酸________(填“过量”、“适量”或“不足量”),理由是______________________;乙组实验中,盐酸_________(填“过量”、“适量”或“不足量”),理由是_________________________________。要算出盐酸的物质的量浓度,题中可作计算依据的数据是________________,求得的盐酸的物质的量浓度为____________。
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是______________,求得的Mg、Al物质的量之比为____________。
(3)在丙组实验之后,向容器中加入1mol/L的NaOH溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全。求所加的NaOH溶液的体积(写出计算过程)。
参考答案:
一、1.A、2.C、3.D、4.D、5.C、6.D、7.B、8.A;
二、9.BC、10.C、11.D、12.AC、13.AC、14. BC、15. BC、16. A、17.A、18.B;
三、19、(三)(2)1%淀粉溶液;
(四)(2)酸式滴定管;
(3)活塞;锥形瓶中溶液;溶液变为蓝黑色;
(五)
| 滴加次序 | 待测橙汁体积(mL) | 标准碘溶液体积(mL) | |||
| 滴定前刻度 | 滴定后刻度 | 实际体积 | 平均值 | ||
| 1 | |||||
| 2 | |||||
990
(六)(1)不能,维生素C易被氧化,影响测定结果;
(2)C;C;C。
四、![]() 20.答案:(1)
20.答案:(1)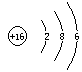 ;
; ;
; ;
;
(2)NaHSO4=Na++H++SO42-;CO32-+H2O HCO3-+OH-
(3)2H++CO32-=H2O+CO2↑;
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
21、(1)否,若a=3,则b=6,溶液显酸性,与题意不符,故a≠3
![]()
(2)否,若a=5,[H+]a=10-5mol·L-1,则b=10,[OH-]b
= 10-4mol·L‑1 ,![]() ,不符合题意,故a≠5
,不符合题意,故a≠5
(3)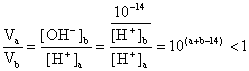
所以(a+b-14)<0,而a=0.5b
即3a<14,a<![]()
又pH=b=3a>7,a>![]()
所以![]() <a<
<a<![]()
五、22、(1)加成反应;酯化反应;
(2)
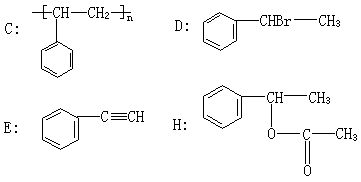
(3)
23、(1)醛基、羟基;
(2)与碳酸钠溶液作用有气泡生成的是甲;
与三氯化铁溶液作用显紫色的是丙;
(3)甲>丙>乙;
(4)甲、乙、丙互为同分异构体;
(5)
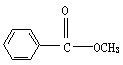 、
、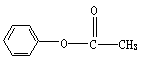 、
、
三种中写两种。
六、24、 (1)过量;因为乙组所用合金量比甲组多,产生的H2也多,说明甲组中HCl未反应完;不足量;因为甲组255g合金生成H2 280mL,每克合金生成H2![]() 。若乙组中合金耗尽,应生成H2
。若乙组中合金耗尽,应生成H2 ![]() ,实际只生成336mL,所以盐酸不足量。盐酸30mL,气体336mL;1mol/L。
,实际只生成336mL,所以盐酸不足量。盐酸30mL,气体336mL;1mol/L。
(2)合金255mg,气体280mL;1∶1。
(3)V[NaOH(aq)]=39mL。