高考化学实验题的命题特点及启示
化学学科是以实验为基础的学科,实验研究是研究化学的主要方法,化学实验在高考化学试题中占有重要的地位,近年来高考试题中实验试题的研究不断深入,出现了一大批真正测试考生实验能力的好题。研究高考化学实验试题的命题特点和解题方法,对指导化学实验的复习有着重要的现实意义。现对近四年(2000---2003年)高考化学实验试题的命题特点、潜在的导向作一些研究和总结,希望结大家有所启发。
一、近四年高考实验题的特点
从化学实验的命题形式看:化学实验题都采用了“常规加创新”模式,如00年化学实验题前半题考了实验室制氯气和氯化铁的常规实验,后半题是氯化铁收集的评价和创新,02年化学实验题前半题考了实验制氨的常规实验,后半题是喷泉的改进和创新,03年的前半题考了实验室制氢氧化亚铁的常规方法,后半题二了氢氧亚铁制取实验的改进和创新。
从化学实验试题的命题内容及角度年看,近几年高考试题有以下几个特点:
1.考核学生的基本实验操作能力,特别是操作细节
对学生动手操作能力的考查,是高考一个非常重要的考查对象。然而,鉴于高考采用笔试的形式,动手操作能力的考查只能通过间接的方式进行。在日常的学习中,如果学生不做实验,只是教师“说实验”或用各种实验题来对付高考,学生很难会注意到实验细节。能否处理好实验细节问题与平时实验训练有着一定的联系。因此,考查实验操作细节已成为间接考查学生动手操作能力的一种新的形式。如:01年理综检查简易启普发生器的气密性是否注意到弹簧夹;01年全国卷分液漏斗中水层判断的实验操作;02年理综引发水上喷形成喷泉的操作;03年理综硫酸亚铁溶液的配制。
2.考核学生的实验评价和语言表达能力
对学生进行实验方案的评价和语言表达能力的考查是新教材的一个特色,考查了学生观察、比较、分析、判断、表达和交流的能力。对实验方案的评价应遵循以下原则:①能达到实验目的;②所用的原料常见、廉价;③原料的利用率高;④过程简捷优化;⑤没有对环境造成污染;⑥实验的误差小⑦实验安全。能达到上述七点要求的实验方案应该说不失为最优方案。如:00年全国卷中FeCl3蒸气有两种收集和尾气处理装置评价;01年理综卷中能否用简易启普发生器制氯化氢评价;02年全国卷中甲乙两同学方案优劣和现象的评价;03年全国卷中结合实验装置的气体制备方案的判断与评价;03年理综卷中氢氧化亚铁保持白色的分析评价。
3.考核学生的实验设计能力
化学实验设计是指实验者在实施化学实验之前,根据一定的化学实验目的和要求,运用有关的化学知识的技能,对实验的仪器、装置、步骤和方法在头脑中所进行的一种规划。设计化学实验需要学生灵活的和创造性的运用所学的化学基本知识和基本。因此,设计实验方案可以考查学生解决化学实验问题的能力和创造能力。同时,学生只有掌握各种科学方法才能设计出合理的实验,从面进一步考查了学生的科学方法的训练程度。如02年理综考了氨气的制取和喷泉实验,它的原理与课本完全相同,但装置与课本相比缺了一个胶头滴管,在这样的情况下,请学生思考如何进行喷泉操作。这需要学生真正懂得这个实验的原理,否则肯定设计不出新的操作过程。又如03年理综氢氧化亚铁制取方法二中,若学生不能理解气压原理(相当于排液法收集气体)就无法制取氢氧化亚铁。
4. 考核学生的定量分析和数据处理能力
实验是手段,要达到目的还需要对实验现象、实验数据进行科学的分析、处理,去伪存真,由表及里,剥去假像方能识得庐山真面目。因此,考核学生的定量分析和数据处理能力可以考查学生去伪存真、探究真理的能力。03年的上海高考27题二氧化硫的含量及误差分析及前几年的上海高考都涉及数据处理考查。
这种实验考核模式,既要求学生能独立完成常规实验,理解实验原理、实验目的及要求,掌握实验方法步骤,控制实验条件和使用实验仪器,处理实验安全问题,观察、分析和解释实验中产生的现象,得出合理的实验结论。又要求学生能灵活运用已学过的自然科学理论、实验方法和仪器,设计简单的实验方案并处理相关的实验问题。
二、几点启示
1、对课本中出现的每个基本实验均为详尽复习
搞清楚每一个实验的原因,操作过程、反应现象、原因、结论、注意事项等,这一步很重要。因为至今为止的新高考下的实验题都是“常规加创新”,是以课本实验为基点的。同时应对课本实验进行深层次的挖掘。为了适应中学生的知识能力水平,中学课本中的某些实验可能不是最优方案,所以在实验复习中要启发学生根据实验原理来设计实验步骤和装置,掌握一些装置和仪器方法,力求使设计的实验仪器简单、操作便捷、节省试剂、现象明显、安全防污等,以培养和增强学生的实验设计能力和创造性思维能力。设计时可从以下三个方面进行拓展:
(1)实验原理方面拓展。实验原理即反应原理,指的是每个具体的化学实验说明了或推断了什么物质变化或什么化学理论,可以围绕如下角度引发学生思考:
①变化实质:属何类型的变化?得到什么结果?为何会得到此结果?为什么要选用这些物质?有无其它原理来解决?如制取氧气、氯气各有几种办法,哪种方法最优。
②定量关系:反应物之间采用怎样的物质的量(或质量、或何种、或微粒数目)、浓度的关系?为什么采取此种量或过量关系?为什么要采用这种浓度?
③反应条件:实验时应选择的物质状态、变化温度、压强或催化剂条件?为何要选择这样的条件?
(2)装置原理方面拓展。为了达到某个具体的实验目的,应当选用何种仪器、设备,采用何种组合、联接方式的道理,可以围绕如下角度引发学生思考:
①仪器选用:根据实验原理,对特定的反应物或生成物,应选用哪种量取、混合、反应、加热、除杂、干燥、检查、收集、吸收、分离、缓冲(安全)的仪器?为何选用这些仪器?
②配套组合:根据实验需要,选用的仪器之间,大小、规格应怎样协调、搭配?若不这样组合会出现什么弊端?能否作某种调换或代用?
③连接顺序:为达到良好效果,选用的仪器应采用看样连接的位置顺序和安装与拆除的先后顺序?为什么要安排这种顺序?不遵循此顺序会带来什么不良后果?
(3)操作原理方面拓展。指是根据具体的实验目的和仪器,进行实验操作活动的理由。可以围绕如下角度引发学生思考:
①操作步骤:为达到某一实验目的,应当经过哪些操作步骤?这些步骤先后顺序如何确定?为什么要经过这些步骤?为什么要安排这种顺序?省略或调动某些步骤会有什么影响?
②注意事项:实施某个实验步骤时应注意做什么或不能做什么?原因何在?
③安全措施:实验过程可能会出现什么不安全的事故?如何防范?万一出现事故应如何处理?依据何在?
2、对实验中经常出现的装置或操作应进行适度的归纳和延伸
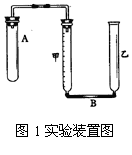 (1)装置气密性检查形式多样,但归纳起来也就两种:
(1)装置气密性检查形式多样,但归纳起来也就两种:
①利用热源:用手捂或用酒精灯微热,看是否有气泡,移开热源,是否有一段水柱。
②利用液面高度差有否变化。如图1量气管B是由甲、乙两根玻璃管组成,它们用橡胶管连通,并装适量水,甲管有刻度(0mL~100mL),供量气用,乙管可以用上下移动,以调节液面高低(甲、乙两管可固定在铁架台上)
(2)防止倒吸常有以下几种措施。
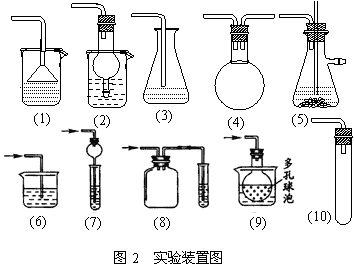 ①切断装置:将赖以产生的密闭装置系统切断是防止倒吸现象产生的措施之一。如制氧气、甲烷等气体时(排水法收集),实验完毕,先将导气管拿出水槽后移去酒精灯,就是采用了将密闭系统装置切断的方法。
①切断装置:将赖以产生的密闭装置系统切断是防止倒吸现象产生的措施之一。如制氧气、甲烷等气体时(排水法收集),实验完毕,先将导气管拿出水槽后移去酒精灯,就是采用了将密闭系统装置切断的方法。
②设计源头的化解装置:如图2中(1)(2)(3)(7)(9) (10)。在液体倒吸的源头用特殊装置化解倒吸:一是导气管端接近液面而不让其浸;二是在接近液面的导气管端边接一个具有蓄液能力的仪器,如漏斗且让其接触液面。
③设置蓄液装置:如图2中(4) (5) (8)。当倒吸发生时,倒吸而来的液体被预先设置的蓄液装置储存,从而使受热仪器得到保护,温差大的装置系统一般都设置此装置。
④设置平衡压力装置:如图2中 (5)。在大型密闭装置系统中(可能产生液体倒吸)连接能自动调节仪器内气体压强的装置(一般利用空气大气压来实现)。
(3)一瓶多用。
连接装置中经常出现这样一只瓶,如图3所示,有许多用途。
①可用作洗气装置(气体从a进b出,瓶内盛放液体)。
②与量筒合起来可测量气体的体积(气体从b进a出,瓶中一般充满水或某种饱和溶液)。
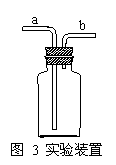 ③气体发生装置(a改为漏斗,瓶内放固体药品)
③气体发生装置(a改为漏斗,瓶内放固体药品)
④排空气集气装置(气体从a进b出,可收集密度比空气大的气体;气体从b进a出,可收集密度比空气小的气体,当然收集的气体都不能与空气中成份反应。)
⑤可作安全瓶,防止倒吸(b连接气体发生装置)
(4)气体制取装置的选择
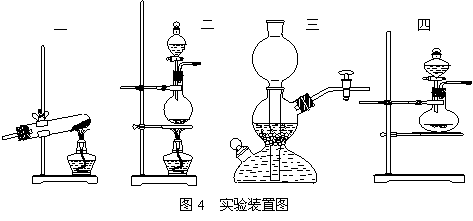 |
气体制取装置种类较多,在化学中出现四大类装置:一是固体加热气体产生装置;二是固液加热气体产生装置;三是启普发生器;四是固液不加热气体产生装置,但归纳起来装置的选择主要是由以下三点来决定。
①反应发生的条件:若反应是在加热条件下进行的,则反应装置需加热;若反应能在常温下自发进行,则反应装置就不需要加热。
②反应物的状态:常温下反应物是固体,装置的开口可以向上也可以向下,反应物是液体,则装置的开口必须向上。
(5)反应进程的控制。
①若发生条件是需加热的,可以利用移动酒精灯来实现。
②若发生条件是不需要加热的,则可以利用将反应物分开来中止反应,其一是采用分液漏斗滴加液体反应物;其二是利用压强原理将液体反应物与固体反应物分开(固体反应物必须是块状且不溶于水的)。
3、“动”字上做文章
02年理综的喷泉实验,03年氢氧化亚铁的制取似乎体现了命题者的一种思维爱好:让液体动起来。怎样才能动?弹簧夹怎样联合使用?这实际体现了理综的一大特色,联系了工业生产的管道和闸门,即联系生产生活实际。同时告诉我们在进行实验复习时应注意对气体流动、液体流动的重力学、压强平衡原理、动力学分析,真正做到理化的有机结合。
 |