高三化学测试题5
第I卷
相对原子质量: H — 1 C — 12 N — 14 O — 16 S — 32 Cl — 35.5 Na — 23 Mg — 24 Al — 27 K — 39 Fe — 56 Cu — 64 Zn — 65
一、选择题(本题共10分)每小题2分,只有一个正确选项
1. 下列物质属于混合物,而且各组分在固态时是分子晶体的是
A. 碱石灰 B. 玻璃 C. 黄铜 D. 空气
2. 工业上制造光电管(当接受光照时能导通电路)需要一种材料,这种原料应该从下列哪个范围内选择
A. IA族单质 B. IA族化合物 C. IIIA族化合物 D. 卤化银
3. 下列叙述错误的是
A. 原子晶体中,共价键键能越大,熔、沸点越高
B. 分子晶体中,分子间作用力越大,分子就越稳定
C. 离子晶体中,除存在离子键外,还可能存在共价键
D. 金属晶体中,存在金属阳离子,但不存在阴离子
4. 13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物分子的空间结构,Kurt Wuthrich等人为此获得2002年诺贝尔奖。下面有关13C、15N叙述正确的是
A. 13C与15N有相同的中子数 B. 13C与C60互为同素异形体
C. 14N与15N互为同位素 D. 15N的核外电子数与中子数相同
5. 已建立化学平衡的某可逆反应,当改变条件使化学平衡向正方向移动时,下列有关叙述正确的是
A. 生成物的质量分数一定增加 B. 反应物的转化率一定增大
C. 正反应速度一定增大 D. 正反应速度一定大于逆反应速度
二、选择题(本题共36分)每小题3分,只有一个正确选项
6. 下列排序顺序错误的是
A. 微粒半径 Al3+ < Na+ < Cl- < S2-
B. 热稳定性 H2S < NH3 < H2O < HF
C. 酸性 H2S < HI < HBr < HCl < HF
D. 碱性 Be(OH)2 < Mg(OH)2 < Ca(OH)2 <Ba(OH)2
7. 不久前,科学家将6630Zn和20882Pb的原子经核聚合放出一定数目的中子,得到112号新元素,该元素原子的质量数为267。下列说法正确的是
A. 该元素位于第7周期第VIII族
B. 该元素的原子核外共有8个电子层
C. 该元素是“两性”金属元素
D. 66Zn和208Pb两原子聚合成该元素的原子时,同时释放出7个中子
8. 水的状态除了气、液和固态外,还有玻璃态。他是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通水的密度相同,有关玻璃态水的叙述正确的是
A. 水由液态变为玻璃态,体积缩小 B. 水由液态变为玻璃态,体积膨胀
C. 玻璃态是水的一种特殊状态 D. 玻璃态水是分子晶体
9. 长期以来,一直认为氟的含氧酸不可能存在,但1971年美国科学家成功合成了次氟酸。以下表述正确的是
A. 次氟酸的电子式是 H F O B. 次氟酸的结构式是 H – O – F
C. 次氟酸中氧元素显负二价 D. 次氟酸是一种强酸
10. 在一个容积固定的密闭容器中充入1 mol HI,建立平衡 2HI(g) ⇋ H2(g) + I2(g),测得HI的转化率为a%。其它条件不变,在上述平衡体系中再充入1molHI,待新平衡建立时HI的转化率为b%。则下列关系正确的是
A. a > b B. a < b C. a = b D. 无法判断
11. 在t°C时,CuSO4的溶解度为s g,在该温度下,把s g无水CuSO4粉末加入到(100 + s) g饱和溶液中,得到一定量的蓝色晶体。若把此蓝色晶体溶解成饱和溶液,应加水的质量是
A. 100 g B. (100 + s) g C. (100 - ![]() ) g D. (100 -
) g D. (100 - ![]() ) g
) g
12. 下列各组离子在水溶液(水电离的[OH-] = 10-14)中可能大量共存的是
A. AlO2-、CO32-、Na+、K+ B. Al3+、Cl-、AlO2-、Na+
C. Ca2+、OH-、H2PO4-、NO3- D. Fe2+、NH4+、NO3-、Cl-
13. 在800 mL含0.8 mol KNO3和4 mol H2SO4的混合溶液中,加入1.5 mol铜粉,加热充分反应后,生成气体在标准状况下的体积是
A. 4.48 L B. 5.6 L C. 17.92 L D. 22.4L
14. 已知苯环上由于取代基的影响,使与硝基邻位的卤原子的反应活性增强。1 mol有机物
![]()
![]()
![]()
![]()
![]() BrH2C
O
COOH
BrH2C
O
COOH
![]()
![]() O2N— —C—O— —NO2
O2N— —C—O— —NO2
Br Cl
它与足量的NaOH溶液混合在一定条件下反应。一共最多可消耗a mol NaOH(不考虑醇羟基与NaOH的反应),所得固体再与碱石灰共热,又耗b mol NaOH,则a 与b值分别是
A. 8、4 B. 8、2 C. 5、10 D. 6、4
15. 硫代硫酸钠可作为脱氧剂,已知25.0 mL 0.100 mol/LNa2S2O3溶液恰好把224 mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成
A. SO42- B. SO32- C. S D. S2-
16. 用0.01 mol/L H2SO4滴定0.01 mol/L NaOH溶液,中和后加水至100 mL。若滴定时终点判断有误差:① 多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05 mL)。则①和②[H+]之比值是
A. 10 B. 50 C. 5 ´ 103 D. 104
17. 向醋酸铅溶液中通入硫化氢气体时有黑色沉淀生成。已知硫酸铅难溶于水和稀HNO3溶液,却因复分解反应而溶于醋酸铵溶液中,形成无色澄清溶液。则醋酸铅溶液与硫化氢气体反应的离子方程式书写正确的是
A. S2- + Pb2+ à PbS ¯
B. H2S + Pb2+ à PbS ¯ + 2H+
C. H2S + Pb(CH3COO)2 à PbS¯ + 2CH3COOH
D. H2S + Pb2+ + 2CH3COO- à PbS ¯ + 2CH3COOH
三、 选择题(本题共20分),每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
18. 下列离子方程式正确的是
A. 硫化钠溶于水:S2-+ H2O ⇋ HS- + OH-
B. 硫酸铜溶液中通入过量的硫化氢:Cu2+ + S2- à CuS¯
C. 溴化亚铁溶液和过量的氯气反应:2Fe2+ +2Br- + 2Cl2 à Br2 + 2Fe3+ +4Cl-
D. 甲酸溶液中加入氨水:HCOOH + NH3×H2O à HCOO- + NH4+ + H2O
19. 下列指定微粒的数目之比不是1 : 1的是
A. Na2O2晶体中阴离子和阳离子
B. NaHCO3晶体中钠离子和碳酸氢根离子
C. 2412Mg2+离子中的质子和中子
D. 氯化铵溶液中的铵根离子和氯离子
20. 将一氧化碳和水蒸气各1mol同时充入一个密闭容器中,发生可逆反应CO(g) + H2O(g) ⇋ H2(g) + CO2(g) ,一定条件下达到平衡,此时氢气的物质的量为0.3mol。若条件不变,再充入4mol水蒸气,平衡后氢气的物质的量可能是
A. 0.2mol B. 0.5 mol C. 0.7 mol D. 1mol
21. 下列高分子化合物是通过两种单体缩聚而成的是
![]()
![]() A. [- CH2
– C = CH – CH2 -]n
B.
OH
A. [- CH2
– C = CH – CH2 -]n
B.
OH
![]() Cl
[ –CH2
] n
Cl
[ –CH2
] n
![]() C. [-CH2
– CH = CH – CH2 – CH – CH2-] n
C. [-CH2
– CH = CH – CH2 – CH – CH2-] n
CH3
![]()
![]() D. O
O
D. O
O
![]()
![]() [-C— —C —OCH2—
—CH2—O—] n
[-C— —C —OCH2—
—CH2—O—] n
22. 把6 mol气体A和5 mol气体B混合后充入4 L密闭容器中在一定条件下反应:3A (g) + B (g) ⇋ x C (g) + 2 D (g),在5 min时达到平衡,此时生成2 mol D,并测得C的平均速度为0.1 mol /(L•min),则下列结论错误的是
A. x的值为1 B. B的平衡浓度为1.0 mol /L
C. B的转化率为20% D. A的平均速度为0.15 mol / (L•min)
高三化学考试
第II卷
四、(本题共24分)
23.宇航员在研究某星球的大气时,测定主要成分是一种易溶于水的气体物质A,用盐酸酸化的KMnO4溶液与A的水溶液共热时,可获得一种红棕色气体产物B,B冷至室温即凝结为液体,B与碱反应生成两种盐,据此推断该大气主要成分A是______,上述生成产物B的化学方程式并标明电子转移的方向和数目 。
24.(1)反应2S(s)+O2 (g)![]() 2SO2(g)的平衡常数表达式为
,平衡体系中,加入18O构成的氧气,当平衡发生移动后,SO2中18O的含量_____(填增加、减少或不变),其原因是 。
2SO2(g)的平衡常数表达式为
,平衡体系中,加入18O构成的氧气,当平衡发生移动后,SO2中18O的含量_____(填增加、减少或不变),其原因是 。
(2)CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡[Cu(H2O)4]2++4Cl- ![]() [CuCl4]2-+4H2O。
[CuCl4]2-+4H2O。
蓝色 黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法:
① ; ② 。
25.(1)W、X、Y、Z为短周期内除稀有气体元素外的四种元素,它们的原子序数依次增大,其中只有Y为金属元素,Y的最外层电子数和W相等,Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
①W为 X为 Y为 Z为 ;
②它们之间可以组成的盐有 。
③Y与Z形成的化合物的电子式 。
(2)BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称。若知:在BGO中,锗处于其最高价态;铋的价态与铋跟氯形成某种共价氯化物时所呈的价态相同,在此氯化物中,铋具有最处层8电子稳定结构;BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含氧的总质量相同。请填空:
①锗和铋的元素符号分别是 和 。
②BGO晶体的化学式是
③BGO晶体中所含铋氧化物的化学式是 。
(3)β-羧乙基锗倍半氧化物(即锗—132)是与人体健康有关的最重要的有机锗化合物。其片层结构如图。每个结构相同的基团都是由六个锗原子和六个氧原子构成的十二元环,每个锗原子还同时与三个氧原子相连结,形成可以任意延伸的片层,每个锗原子连接一个羧乙
基(—CH2CH2COOH),各片层间存在相互作用,连接成三维网状结构。
①每个正六边形拥有 个锗原子, 个氧原子;
②试写出锗—132的化学式 。
五、(本题共25分)
26.喷泉是一种常见的自然现象,其产生原因是存在压强差。
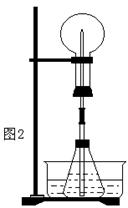
(1)图1为化学教学中所用的喷泉实验装置,在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体,下列组合不可能形成喷泉的是 。
A.HCl和H2O B.O2和H2O C.NH3和H2O D.CO2和NaOH溶液
(2)某学生积极思考产生喷泉的其他办法,并设计了如图2所示的装置。
①在图2的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是 。
 |
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液 C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
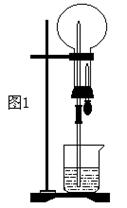 |
②在图2锥形瓶外放一水槽,瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是 。
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
这种方法产生喷泉的原理是 。
③比较图1和图2两套装置,从产生喷泉的原理来分析,图1是 上部烧瓶内气体压强;图2是 下部锥形瓶内气体压强(均填增大或减小)。
(3)城市常见的喷泉及火山爆发的原理与上述 (填图1或图2)装置的原理相似。
27.某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
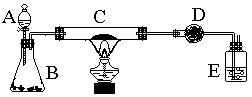
(一)实验目的:__________________________________。
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶等
药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(三)实验内容:
| 实验过程 | 实验现象 | 有关化学方程式 |
| 在C中加入样品标本W克,D中装入药品后并称量为m克。连接好仪器后,检查气密性 | ||
| 打开A的活塞,慢慢滴加溶液。 | ||
| 对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: | ||
| 冷却后,称量D的质量为m2克。 |
(四)计算:样品中铜的质量分数=___________________(用含W、m1、m2的代数式表示)
(五)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与C之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是_______________,在B与C之间加入的装置可以是____________________,其中盛放的药品是__________________。
六、(本题共19分)
28.乙酸在磷酸铝作用下,生成一种重要有机物A,经测定,可知分子中只含有C、H、O三种元素;红外光谱显示A分子中所有原子都在同一平面上,且含有C=O双键;核磁共振谱显示A分子中的氢原子无差别;A能与水反应生成乙酸。
(1)请写出A的结构式:
(2)写出A与H2O反应的方程式并注明反应类型:
(3)已知氨、乙醇、水可分别表示为:H―NH2;H―OC2H5;H―OH,其中―NH2和―OC2H5相当于―OH。请写出A分别与NH3和C2H5OH反应的化学方程式:
29.据报道,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中一种。它与雷米封同时服用,可以产生协同作用。
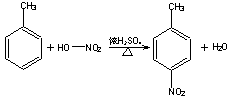
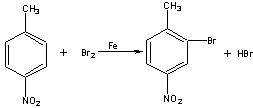
已知;
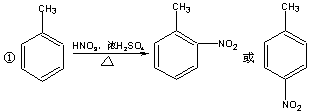
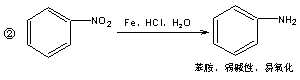
![]()
下面是PAS–Na的一种合成路线:
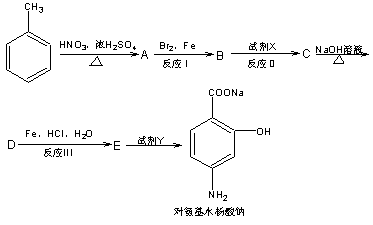
请按要求回答下列问题:
(1)写出下列反应的化学方程式并配平:
 →A:
→A:
A→B:
(2)写出下列物质的结构简式:C: D: ;
(3)指出反应类型:Ⅰ Ⅱ Ⅲ ;
(4)所加试剂名称:X Y 。
七、(本题共16分)
30.有一元素A与卤素形成最高价化合物,此卤化物对空气的相对密度为6.55。该元素A在卤化物中占25.2%。又知该卤化物的熔点为23℃,沸点为136℃,该元素的原子核里,质子数与中子数之比为11:13,试计算推导该卤化物的化学式,确定A元素的原子序数。
31.在373K时,把0.52molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行2s时,NO2的浓度为0.02mol/L,60s时体系达到平衡,此时容器内压强为开始时的1.6倍。
(1)前2s,以N2O4的浓度变化表示的平均反应速度为______。
(2)在2s时,体系内的压强为开始时的______倍。
(3)在平衡时,体系内含N2O4为______mol。
座位号 |
高三化学考试答题纸
第I卷答案栏:
| 题号 | 一、(5×2=10分) |
| ||||||||||
| 1 | 2 | 3 | 4 | 5 |
| |||||||
| 答案 |
| |||||||||||
| 题号 | 二、(12×3=36分) | |||||||||||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| 答案 | ||||||||||||
| 题号 | 三、(5×4=20分) |
| ||||||||||
| 18 | 19 | 20 | 21 | 22 |
| |||||||
| 答案 |
| |||||||||||
四、(本题共24分)
23. A是______,生成产物B的化学方程式并标明电子转移的方向和数目
。
24.(1)平衡常数表达式为 , SO2中18O的含量_____,其原因是 。
(2)两种可采用的方法:① ; ② 。
25.(1)①W为 X为 Y为 Z为 ;
②组成的盐有 。③电子式 。
(2)①锗和铋的元素符号分别是 和 。
②BGO晶体的化学式是
③BGO晶体中所含铋氧化物的化学式是 。
(3)①每个正六边形拥有 个锗原子, 个氧原子;
②试写出锗—132的化学式 。
五、(本题共25分)
26.(1)不可能形成喷泉的是 。
(2)①可能产生喷泉的是 。
②加入的物质可以是 。原理是 。
③图1是 上部烧瓶内气体压强;图2是 下部锥形瓶内气体压强。
(3)城市常见的喷泉及火山爆发的原理与上述 装置的原理相似。
27.(一)实验目的:__________________________________。
(二)实验用品
(三)实验内容:
| 打开A的活塞,慢慢滴加溶液。 | ||
| 对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: |
(四)计算:样品中铜的质量分数=___________________(用含W、m1、m2的代数式表示)
(五)原来实验所测得的铜的质量分数偏小的原因可能是_______________,在B与C之间加入的装置可以是____________________,其中盛放的药品是__________________。
六、(本题共19分)
28.(1)请写出A的结构式:
(2)写出A与H2O反应的方程式并注明反应类型:
(3)请写出A分别与NH3和C2H5OH反应的化学方程式:
29. (1)写出下列反应的化学方程式并配平:
 →A:
→A:
A→B:
(2)写出下列物质的结构简式:C: D: ;
(3)指出反应类型:Ⅰ Ⅱ Ⅲ ;
(4)所加试剂名称:X Y 。
四、(本题共16分)
30.
31. (1)前2s,以N2O4的浓度变化表示的平均反应速度为______。
(2)在2s时,体系内的压强为开始时的______倍。
(3)在平衡时,体系内含N2O4为______mol。
高中化学月考参考答案
| 题号 | 一、(5×2=10分) | 二、(12×3=36分) | 三、(5×4=20分) | |||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | |
| 答案 | D | A | B | C | D | C | D | C | B | C | A | A | C | B | A | D | C | AD | AD | BC | BD | A |
23.HBr;10HBr+2KMnO4+6HCl→2KCl+2MnCl2+5Br2+8H2O
24.(1)![]() ;增加;可逆反应达到平衡后,正逆反应仍在进行。
;增加;可逆反应达到平衡后,正逆反应仍在进行。
(2)①加入水,②加入AgNO3溶液;
25.(1)①H;O;Na;S
②NaHSO4,NaHSO3
③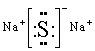
(2)①Ge、Bi
②Bi4Ge3O12[或2Bi2O3·3GeO2、Bi4(GeO4)3]
③Bi2O3
(3) ① 2、3
②H10C6Ge2O7或(GeCH2CH2COOH)2O3
26.(1)B
(2)①D ②A 浓硫酸溶于水放热,温度升高,酒精加快挥发,锥形瓶内气体压强增大 ③减小 增大
(3)图2
27.(一)测定铜粉样品中铜的质量分数
(三)
| B、E中有气泡产生 | 2H2O2 |
| C中的红褐色粉末变成黑色 | 2Cu+O2 C+O2 |
(四)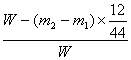
(五)偏小:水蒸汽通过C被D中碱石灰吸收
洗气瓶 浓硫酸 (或干燥管 碱石灰)
28.(1)![]()
(2)
![]()
加成反应
(3)
![]()
![]()
29.(1)
(2)C: 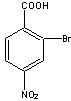 D:
D: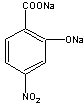
(3)取代反应、氧化反应、还原反应(3分)
(4)酸化的高锰酸钾、碳酸氢钠(2分)
30.设卤化物的化学式为AClx,A的相对原子质量为a。
则:a+35.5x=6.55×29
![]()
x=4
a=48
所以,原子序数![]()
化学式为TiCl4
31.(1)
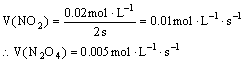
(2)
N2O4
![]() 2 NO2
2 NO2
开始 0.52mol 0
变化 0.05mol 0.02×5mol
2s时 0.47mol 0.02×5mol
所以![]() 倍
倍
(3)设平衡时体系内含N2O4 物质的量为xmol
N2O4 ![]() 2 NO2
2 NO2
开始 0.52mol 0
变化 (0.52-x)mol 2(0.52-x) mol
平衡 xmol 2(0.52-x) mol
所以![]()
解得:x=0.208mol