第九单元 《化学平衡》测试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试时间100分钟。
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分,每题只有一个选项符合题意)
![]() 1. 已知4NH3+5O2
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O) [mol/(L·s)]表示,下列关系式正确的是
( )
1. 已知4NH3+5O2
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O) [mol/(L·s)]表示,下列关系式正确的是
( )
A.4υ(NH3) =5υ(O2) B. 5υ(O2)=6υ(H2O)
C.2υ(NH3) =3υ(H2O) D. 4υ(O2)= 5υ(NO)
2. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,
![]()
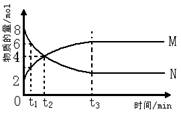 下列表述中正确的是
( )
下列表述中正确的是
( )
A.反应的化学方程式为:2M N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
![]() D.t1时,N的浓度是M的浓度的2倍
D.t1时,N的浓度是M的浓度的2倍
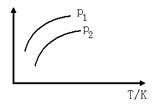 3. 如图表示不同温度(T)和压强(p)对可逆反应:2L(g) 2M(g)+N(g)-Q
3. 如图表示不同温度(T)和压强(p)对可逆反应:2L(g) 2M(g)+N(g)-Q
的影响,已知p2>p1,则图中纵轴表示的意义可能是 ( )
①一定条件下L的转化率 ②混合气体中M的百分含量
③混合气体中L的百分含量 ④混合气体的平均摩尔质量
![]() A.①② B.①③ C.②① D.②
A.①② B.①③ C.②① D.②
4.在真空密闭容器中盛有1molPCl5(g),加热到200℃时发生如下发应:PCl5(g) PCl3(g)
+Cl2(g),反应达平衡后,PCl5所占体积分数为M%。若在同一温度和同一容器中,最初投入的是2molPCl5(g),反应达平衡时, PCl5所占体积分数为N%。则M和N 的正确关系是( )
A.M>N B.M<N C.M=N D.无法比较
5.在一定条件下,合成氨反应达到平衡后,测得氨占混合气体的25%(体积),若其它条件反应前后保持不变,则反应后缩小的气体体积与原反应物体体积的比值是 ( )
![]()
![]()
![]()
![]() A.
B.
C.
D.
A.
B.
C.
D.
![]() 6.在一个容器为VL的密闭容器中,放入2LA(g)和1LB(g),在一定条件下发生下列反应:3A(g)+B(g) nC(g)+2D(g),达到平衡后,A和物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
( )
6.在一个容器为VL的密闭容器中,放入2LA(g)和1LB(g),在一定条件下发生下列反应:3A(g)+B(g) nC(g)+2D(g),达到平衡后,A和物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
( )
A.1 B.2 C.3 D.4
![]()
![]() 7.从植物花中提取一种有机物,可用简式HIn表示,在水溶液中存在下列平衡
7.从植物花中提取一种有机物,可用简式HIn表示,在水溶液中存在下列平衡
HIn(溶液) H+(溶液)+I - n (溶液)
红色 黄色
在水溶液中加入下列物质,能使指示剂显黄色的是 ( )
A.盐酸 B.NaHCO3溶液 C.NaHSO4溶液 D.Na2O2固体
![]()
![]() 8.将一定量的Ag2SO4固体置于容积不变的密闭容器中,在一定温度下加入催化剂
后发生反应:Ag2SO4(s) Ag2O(s)+SO3(g)
、 2SO3(g) 2SO2(g)+O2(g)
经10min后反应达到平衡,此时c(SO3)=0.4mol·L-1、c(SO2)=0.1mol·L-1,下列判断正确的是 (
)
8.将一定量的Ag2SO4固体置于容积不变的密闭容器中,在一定温度下加入催化剂
后发生反应:Ag2SO4(s) Ag2O(s)+SO3(g)
、 2SO3(g) 2SO2(g)+O2(g)
经10min后反应达到平衡,此时c(SO3)=0.4mol·L-1、c(SO2)=0.1mol·L-1,下列判断正确的是 (
)
①用SO2表示的反应速率υ(SO2)=0.01mol·L-1·min-1 ③SO3的分解率为10%
②用O2表示的反率速率 υ(O2)=0.01mol·L-1·min-1 ④SO3的分解率为20%
A.①④ B.①③ C.②③ D.④
二.选择题(本题共10小题,每小题4分,共40分,每小题可能有1—2个选项符合题意)
![]()
![]()
![]()
![]() 9. A. B. C.D四种物质皆易溶于水,且在水溶液中存在如下化学平衡,加水稀释后,平衡向正方向移动是
( )
9. A. B. C.D四种物质皆易溶于水,且在水溶液中存在如下化学平衡,加水稀释后,平衡向正方向移动是
( )
A.A+B C+D B. A+H2O C+D C.A+B C+H2O D. A+2B+H2O C
![]() 10.在一密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),已知某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L, 0.2mol/L,当反应达到平衡时,可能存在的数据是 ( )
10.在一密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),已知某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L, 0.2mol/L,当反应达到平衡时,可能存在的数据是 ( )
A.SO2为0.4mol/L,O2为0.2mol/L B. SO2为 0.25mol/L
![]() C. SO2,SO3均为0.15mol/L
D.SO3为0.4mol/L
C. SO2,SO3均为0.15mol/L
D.SO3为0.4mol/L
11.某体积可变的密闭容器,盛有A和B的混合气体,在一定条件下发生反应:A+3B 2C,若保持温度和压强不变,达到平衡时,容器的体积为VL,其中C的气体体积占10%,下列推断正确的是 ( )
①原混合气体的体积为1.2VL ②原混合气体的体积为1.1VL
③反应达到平衡时气体A消耗掉0.05VL ④反应达到平衡时气体B消耗掉0.05VL
![]()
![]() A.②③ B.②④ C.①③ D.①④
A.②③ B.②④ C.①③ D.①④
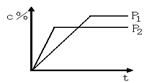 12. 对于达到平衡的反应:2A(g)+B(g) nC(g),符合下图1所示的结论是
(
)
12. 对于达到平衡的反应:2A(g)+B(g) nC(g),符合下图1所示的结论是
(
)
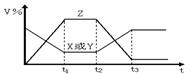 A. P1>P2,n>3 B. P1>P2,n<3 图1
图2
A. P1>P2,n>3 B. P1>P2,n<3 图1
图2
C. P1<P2, n>3 D. P1<P2, n<3
13.对于反应:X(g)+Y(g) 2Z(g)(正反应为放热反应),从反应开始经过时间t1后达到平衡状态。t2时由于条件改变,平衡受到破坏,在t3时,又达到平衡。根据上图2回答:从t2到t3间的曲线变化是由哪种条件引起的 ( )
A.增大X或Y的浓度 B.增在压力 C.增大Z的浓度 D.升高温度
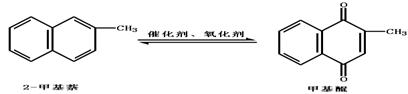 14.甲基醌(维生素K)有止血作用,它可通过2—甲基萘经氧化而制得。反应中常用醋酸作催化剂,且该反应为放热反应,可表示为:
14.甲基醌(维生素K)有止血作用,它可通过2—甲基萘经氧化而制得。反应中常用醋酸作催化剂,且该反应为放热反应,可表示为:
在某次合成中用1.4克(0.01mol)2—甲基萘仅制得0.17克(0.001mol)甲基醌,已知该反应的速度是很快的,判断导致其产率降低的原因可能是 ( )
![]() A.使用了少量的氧化剂 B.催化剂用量不足 C.温度过高 D.生成的甲基醌是沉淀物
A.使用了少量的氧化剂 B.催化剂用量不足 C.温度过高 D.生成的甲基醌是沉淀物
15.1molX气体跟amolY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g) bZ(g)
反应达到平衡后,测得X的转化率为50%。而且,在 同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可有是 ( )
![]() A.a=1,b=1
B.a=2,b=1
C.a=2,b=2
D.a=3,b=2
A.a=1,b=1
B.a=2,b=1
C.a=2,b=2
D.a=3,b=2
16.在可逆反应2A+3B xC+D中, A、B、C、D均为气态。已知:起始浓度A为5mol·L-1,B为3mol·L-1,C的反应速率为0.5mol·L-1·min-1;反应开始至达到平衡需2min,平衡时D的浓度为0.5mol·L-1, 下列关于此反应的说法中,正确的是 ( )
![]() A.平衡浓度A/B=5:3 B. x=1 C. B的平衡浓度为1.5mol·L-1 D.A的转化率为20%
A.平衡浓度A/B=5:3 B. x=1 C. B的平衡浓度为1.5mol·L-1 D.A的转化率为20%
17.一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g) pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时, C的浓度为原来的1.9倍,下列说法错误的是 ( )
A. m+n>p B.平衡向逆反应方向移动 C. A的转化率降低 D. C的体积分数增加
![]() 18. 在密闭容器中进行下列反应,达到平衡状态后,若其它条件不变,缩小容器体积,混合气体的平均相对分子质量增大的是
( )
18. 在密闭容器中进行下列反应,达到平衡状态后,若其它条件不变,缩小容器体积,混合气体的平均相对分子质量增大的是
( )
![]() A.N2(g)+3H2(g) 2NH3(g)
A.N2(g)+3H2(g) 2NH3(g)
![]() B.2NO(g) N2(g)+O2(g)
B.2NO(g) N2(g)+O2(g)
![]() C.C(s)+H2O(g) CO(g)+H2(g)
C.C(s)+H2O(g) CO(g)+H2(g)
D.2NH3(g)+CO2(g) H2O(g)+CO(NH2)2(s)
《化学平衡》单元测试卷
班级____________学号__________姓名___________得分__________
选择题答题卡(共72分)
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 |
|
|
|
|
|
|
|
|
|
| 序号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题 共78分)
![]() 三、(本题包括2小题,共24分)
三、(本题包括2小题,共24分)
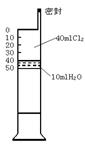 19.已知氯水中有如下平衡:Cl2+H2O HCl+HClO.常温下在一个容积为50mL的针筒(如图,活塞可自由滑动,针筒上刻有刻度)里吸入40mLCl2和10mLH2O。
19.已知氯水中有如下平衡:Cl2+H2O HCl+HClO.常温下在一个容积为50mL的针筒(如图,活塞可自由滑动,针筒上刻有刻度)里吸入40mLCl2和10mLH2O。
(1)针筒中可能观察到的现象是___________________________
(2) 若将此针筒长时间放置在有日光的地方,最终可能
观察到的现象是_________________________________.
(3)用化学平衡的观点解释现象(2)__________________.
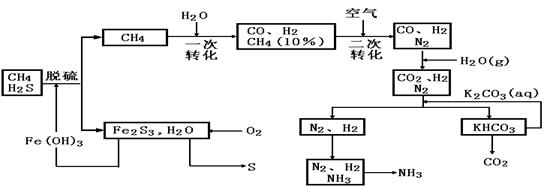 20.利用天然气合成氨的工艺流程示意图如下:
20.利用天然气合成氨的工艺流程示意图如下:
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是_______________.
(2)n molCH4经一次转化产生CO0.9n mol产生H2___________mol(用含n的代数式表示)
(3)K2CO3(ap)和CO2反应在加压下进行,加压的理论依据是_______________.
A.相似相溶原理 B.勒夏待列原理 C.酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于___________(写出CO2的一种重要用途).
(5)整个流程有三循环,一是Fe(OH)3循环,二是K2CO3(ap)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
四.(本题包括2个小题,共16分)
21.亚硫酸钠和碘酸钾在酸性溶液里反应化学方程式是:
![]() 5Na2SO3+2KIO3+H2SO4
5Na2SO4+K2SO4+I2+H2O
5Na2SO3+2KIO3+H2SO4
5Na2SO4+K2SO4+I2+H2O
其反应过程和机理较复杂,一般认为以下几步:
![]() a.IO-3+SO2-3
IO2-+SO42- (慢)
a.IO-3+SO2-3
IO2-+SO42- (慢)
![]() b. IO2- +2SO32- I-+2SO42-(快)
b. IO2- +2SO32- I-+2SO42-(快)
![]() c.5I-+6H+ +IO3- 3I2+3H2O(快)
c.5I-+6H+ +IO3- 3I2+3H2O(快)
![]() d.I2+SO32-
+H2O
2I- +SO42- +2H+(快)
d.I2+SO32-
+H2O
2I- +SO42- +2H+(快)
![]() 根据上述条件推测,此反应总的反应速率由__________步反应决定.若预先加入淀粉溶液,由题述看必在_____________
离子消耗完时,才会有使淀粉变蓝的现象产生.
根据上述条件推测,此反应总的反应速率由__________步反应决定.若预先加入淀粉溶液,由题述看必在_____________
离子消耗完时,才会有使淀粉变蓝的现象产生.
22.高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g)-Q其平衡常数可表示为K= c(CO2)/c(CO) 。已知1100℃时,K=0.263。
(1)温度升高,化学 平衡移动后达到新的平衡,高炉内CO2和CO的体积比值_____,平衡常数K值___________(填"增大"或"减小")
(2)1100℃时测得高炉中c(CO2)=0.025mol·L-1,在这种情况下,该反应是否处于化学平衡状态______________,此时化学反应速度是v正_______v逆。
五. (本题包括2小题,共21分)
23.把氮气和氢气按1:1(物质的量之比)混合均匀后分成四等份,分别充入A、B、C、D四个装有铁触媒的真空密闭容器中(容积不变),在保持相同温度的条件下,四个容器相继达到平衡状态,分析下表中的数据,回答下列问题:
| 容器代号 | A | B | C | D |
| 平衡时混合物平均式量 | 16 | 17 | ||
| 平衡时氮气的转化率 | 20% | |||
| 平衡时氢气的转化率 | 30% |
(1)平衡时,_______容器中氨气所占的比例最大.
(2) 达到平衡时反应速率最小的容器是__________.
(3)四个容器的压强由小到大的排列次序是___________.
![]()
![]() 24.在一个容积固定的反应器中,有一个可左右滑动的隔板,两侧分别进行如图所示可逆反应.各物质的起始加入量如下:A、B、C均为4.0mol ,D为6.5mol,F为2.0mol.设E 为xmol.当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.
24.在一个容积固定的反应器中,有一个可左右滑动的隔板,两侧分别进行如图所示可逆反应.各物质的起始加入量如下:A、B、C均为4.0mol ,D为6.5mol,F为2.0mol.设E 为xmol.当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置.
![]()
![]() A(g)+B(g)
2C(g)
D(g)+2E(g)
2F(g)
A(g)+B(g)
2C(g)
D(g)+2E(g)
2F(g)
(1)若x=4.5时,则右侧反应在起始时间向_______(填"正反应"或"逆反应")方向进行. 欲使起始反应维持向该方向进行,则x的最大取值应小于______.
(2)若x分别为4.5和5.0时,则在这两种情况下,反应达平衡时,A的物质的量__________(填"相等"、"不相等"或"不能确定")理由是_________________________________。
![]() 六.(本题包括2小题,共17分)
六.(本题包括2小题,共17分)
25. Fe3+和I - 在水溶液中的反应如下:2I - +2Fe3+ 2Fe2+ +I2(水溶液).
(1)该反应的平衡常数K的表达式为:K=__________.当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡_________移动(填"向右" 、 "向左"或"不")。
(2)上述反应的正向反应速率和I - 、Fe3+ 的浓度关系为“υ=K[I - ]m·[Fe3+]n(K为常数)
|
| c(I - )mol/L | c(Fe3+)mol/L | υmol/(L·s) |
| 1 | 0.20 | 0.80 | 0.032K |
| 2 | 0.60 | 0.40 | 0144K |
| 3 | 0.80 | 0.20 | 0.128K |
通过所给的数据计算得知:在υ=K[I - ]m·[Fe3+]n中m和n的值为________.
A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2
I- 浓度对反应速率的影响_________Fe3+ 浓度对反应速率的影响.(填">""<"或"=")
![]() 26.I.恒温恒压下,在一个可变容积的容器中发生如下反应:
26.I.恒温恒压下,在一个可变容积的容器中发生如下反应:
A(气)+B(气) C(气)
(1)若开始时放入1molA 和1molB,到达平衡后,生成amolC,这时A的物质的时为___mol.
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为___mol.
(3)若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=____mol, y=_______mol.平衡时,B的物质的量__________(选填一个编号).
(甲)大于2mol (乙)等于2mol (丙)小于2mol (丁)可能大于、等于或小于2mol
作出此判断的理由是_________________________________
(4)若在(3)的平衡混合物中再加入3molC,待再次达到平衡后,C的物质的量分数是_____.
Ⅱ.若维持温度不变,在一个与(I)反应前起始体积相同、容积固定的容器中发生上述反应。(5)开始时放入1molA和1molB,达到平衡后生成bmolC,将b与第(1)小题中的a进行比较_________(选填一个编号) 作出此判断的理由是____________________________.
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b大小.
第九单元 《化学平衡》答案
一、二选择题
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | D | A | B | D | A | B | A | B |
| 序号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | A | C | D | C | AD | BD | AD | D |
![]()
![]() 三、19.(1)气体体积缩小,溶液呈黄绿色 (2) 气体体积进一步缩小,气体溶液均变为无色 (3)氯水中存在:Cl2+H2O HCl+HClO.由于HClO逐渐分解导致平衡右移,最终Cl2全部耗尽,转化为O2导致气体体积减小,黄绿色消失。
三、19.(1)气体体积缩小,溶液呈黄绿色 (2) 气体体积进一步缩小,气体溶液均变为无色 (3)氯水中存在:Cl2+H2O HCl+HClO.由于HClO逐渐分解导致平衡右移,最终Cl2全部耗尽,转化为O2导致气体体积减小,黄绿色消失。
20.(1)3H2S + 2Fe(OH)3 Fe2S3 + 6H2O
(2)2.7n (3)B (4)制纯碱 (5)NH3
四. 21. a. SO32- 22. (1)增大 增大 (2)否 v正>v逆
五.23.(1)A (2) C
(3)C<B<D<A 24.(1)正反应 7 (2)不相等 两者是在不同温度下达到平衡的,因而平衡状态不同所以A的物质的量也不同
六.(本题包括2小题,共17分)
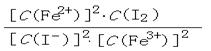
25. (1)K= 向右 (2)C >
26.I. (1)1-a (2)3a (3)2 3(1-a) 丁 当1>3a时,平衡左移,n(B)>2mol; 当1=3a时,平衡不移动,n(B)=2mol; 当1<3a时,平衡右移,n(B)<2mol; (4)a/(2-a)
Ⅱ.乙 Ⅱ中恒温、恒容,随着反应进行,压强减小,所以平衡向左移动,而Ⅰ中,压强保持不变