电化学单元练习(一)
1. 钢铁发生吸氧腐蚀时,正极上发生的电极反应是
A.2H++2e-=
H2 B.Fe2++2e-
= Fe
C.2H2O+O2+4e-=
4OH- D.Fe3++e-
= Fe2+
2. 下列关于铜电极的叙述, 不正确的是
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
3.在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e-→Cu或
Ag++e-→Ag在电极上放电,其析出铜的质量为1.92g,则析出银的质量为
A.1.62g B.6.48g C.3.24g D.12.96g
4.用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是
A.稀NaOH溶液 B.HCl溶液
C.酸性MgSO4溶液 D.酸性AgNO3溶液
4.对于原电池的电极名称,下列叙述中正确的是
A、电子流入的为负极 B、比较不活泼的为正极
C、电子流入的为正极 D、发生氧化-还原反应的为正极
5.埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是 ( )
A.在含铁元素较多的酸性土壤中 B.在潮湿疏松的碱性土壤中
C.在干燥致密不透气的土壤中 D.在含碳粒较多,潮湿透气的中性土壤中
6.下列变化一定不可逆的是 ( )
A.溶解 B.水解 C.电解 D.电离
7.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是 ( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
8.用石墨电极电解某酸、碱或盐的溶液时,在相同的条件下,阴阳两极收集到的气体的体积比是2∶1,则下列结论正确的是 ( )
A.阴极一定是H2,阳极一定是O2 B.电解后溶液的pH一定变大
C.电解后溶液的pH一定不变 D.电解后溶液的浓度一定变大
9. 银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
![]()
在此电池放电时,负极上发生反应的物质是 ( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
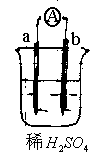 10.a的金属活动性比氢强,b为碳棒,关于下列装置的说法中不正确的是
10.a的金属活动性比氢强,b为碳棒,关于下列装置的说法中不正确的是
A.a发生氧化反应 b.发生还原反应
B.碳棒上有气体逸出,溶液的PH值减小。
C.导线上有电流,电流方向从a→b
D.反应后a极质量减小
11.铁和足量的稀![]() 反应时,加入少量
反应时,加入少量![]() 固体,下列叙述正确的是
固体,下列叙述正确的是
A.反应速率减慢,产生![]() 的量不变
的量不变
B.反应速率加快,产生![]() 的量不变
的量不变
C.反应速率不变,产生![]() 的量增加
的量增加
D.反应速率加快,产生![]() 的量减少
的量减少
12、将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池,已知通入甲烷的一极,其电极反应式为:![]() 通入氧气和另一极,其电极反应式是:
通入氧气和另一极,其电极反应式是:![]() 下列叙述正确的是( )
下列叙述正确的是( )
(A)通入甲烷的电极为负极
(B)正发生氧化反应
(C)该电池使用一段时间后应补充氢氧化钾
(D)燃料电池工作是时,溶液中的阴离子向正极移动
二、填空题
1、原电池是把 能(氧化还原反应)转化为 能(电子在导线中定向移动)的装置
2、Zn-Cu原电池的正负极与氧化还原反应
负极( )——
电子——发生
反应——现象
正极( )—— 电子(电子流入)——发生 反应——现象 3、钢铁 电化学腐蚀中①析氢腐蚀(在酸性较强的电解质环境下)
负极 ,正极
②吸氧腐蚀(中性或弱酸性电解质溶液如![]() 环境下)
环境下)
负极 正极
 总反应式
总反应式
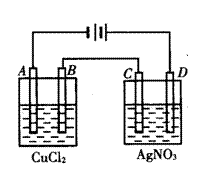
4、右图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极方程式:
A________________________________
B________________________________
C________________________________
D________________________________
(2)在A、B、C、D各电极上析出生成物的物质的量比________________________________________________。