电化学高考题汇编
![]() 1、22.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
1、22.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是 [ D ].
(A)Ag (B)Zn(OH)2 (C)Ag2O (D)Zn
2、17.将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为(D)
A.1:2:3 B.3:2:1 C.6:3:1 D.6:3:2
3、.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
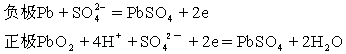
今若制得Cl20.050摩,这时电池内消耗的H2SO4的物质的量至少是( C ).
(A)0.025摩 (B)0.050摩 (C)0.10摩 (D)0.20摩
4、钢铁发生吸氧腐蚀时,正极上发生的电极反应是(C)
(A)2H++2e- =H2 (B)Fe2++2e- =Fe
(C)2H2O+O2+4e-=4OH- (D)Fe3++e-=Fe2+
5、、下列关于铜电极的叙述 正确的是(A、C)
A、铜锌原电池中铜是正极 B、用电解法精炼粗铜时铜作阳极
C、在镀件上电镀铜时可用金属铜作阳极 D、电解稀硫酸制H2、O2时铜作阳极
6、将质量分数为0.052(5.2%)的NaOH溶液1升(密度为1.06克/毫升)用铂电极电解,当溶液中的NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是(B)
| NaOH的质量分数 | 阳极析出物的质量(克) | 阴极析出物的质量(克) | |
| A | 0.062(6.2%) | 19 | 152 |
| B | 0.062(6.2%) | 152 | 19 |
| C | 0.042(4.2%) | 1.2 | 9.4 |
| D | 0.042(4.2%) | 9.4 | 1.2 |
7、氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是
![]()
(1/2)H2+NiO(OH) Ni(OH)2。根据此反应式判断,下列叙述中正确的是(C、D)
A.电池放电时,电池负极周围溶液的OH不断增大 B.电池放电时,镍元素被氧化 C.电池充电时。氢元素被还原 D.电池放电时,H2是负极
8、用惰性电极电解M(NO3)x的水溶液,当阴汲上增重ag时,在阳极上同时产生bL氧气(标准状况〕:从而可知M的原子量为
A.22.4ax/b B11.2ax/b C.5.6ax/b D.2.5ax/b
9、下列关于实验现象的描述不正确的是(C)
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
10、.(B) 用两支惰性电极插入500mLAgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上析出银的质量大约是
A.27mg B.54mg C.108mg D.216mg
11、(2000年理综浙)7.钢铁发生电化学腐蚀时,负极发生的反应是(C)
A、2H++2e →H2 B、2H2O+O2+4e →4OH—
C、Fe-2e →Fe2+ D、4OH—-4e →2H2O+O2
12、用两支惰性电极插入500毫升AgNO3溶液中,通电电解.当电解液的pH值从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上应析出银的质量是(B)
(A)27毫克 (B)54毫克 (C)108毫克 (D)216毫克
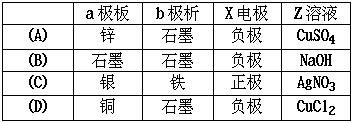 |  | ||
13、右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的
14、在铁的吸氧腐蚀中,发生还原反应的那个电极上进行的电极反应是(A)
(A)2H2O+O2+4e=4OH- (B)2H++2e=H2
(C)4OH--4e=2H2O+O2 (D)Fe-2e=Fe2+
15、(1992年)14.用石墨作电极,电解1摩/升下列物质的溶液,溶液的pH值保持不变的是(C)
(A)HCl (B)NaOH (C)Na2SO4 (D)NaCl
14、A、B、C是三种金属,根据下列①、②两个实验,确定它们的还原性强弱顺序为(D)
①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解
②电解摩尔浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)
(A)A>B>C (B)B>C>A (C)C>A>B (D)B>A>C
17、(1992年三南)18.钢铁在潮湿空气中发生电化腐蚀时,正极发生的主要反应是(B)
(A)Fe-2e=Fe2+ (B)2H2O+O2+4e=4OH -
(C)4OH --4e=2H2O+O2 (D)2H++2e=H2
15、下列关于实验现象的描述不正确的是(C)
A. 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B. 用铜板做电极电解硫酸铜溶液,阴极铜板质量增加
C. 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D. 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率回快。
16、(2000江西)25.(9分)下图每一方框中的字母代表一种反应物或生成物:
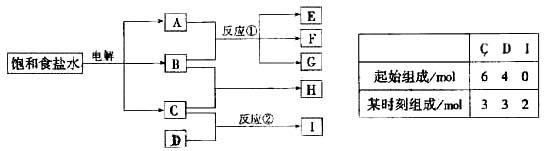
物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示。请填写下列空白:
(1) 物质H的分子式是___________。
(2) 反应①的化学方程式是________________________。
反应②的化学方程式(须注明反应条件)是_______________。
(1)HCl (2分)
(2)Cl2+2NaOHNaCl+NaClO+H2O (2分)
(3) N2+3H2 ![]() 2NH3(化学方程式3分,反应条件2分)
2NH3(化学方程式3分,反应条件2分)
17、用铂电极(情性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是(AC)
A.稀NaOH溶液 B.HCl溶液
C.酸性MgSO4溶液 D.酸性AgNO3
18、镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:(C)
由此可知,该电池放电时的负极材料是
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
19、铜片和锌片用导线连接后插入稀硫酸中,锌片是(D)
A 阴极 B 正极 C 阳极 D 负极
20、在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是 (BC)
(A) 原电池的正极和电解池的阳极所发生的反应
(B) 原电池的正极和电解池的阴极所发生的反应
(C) 原电池的负极和电解池的阳极所发生的反应
(D) 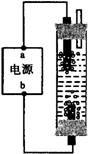 原电池的负极和电解池的阴极所发生的反应
原电池的负极和电解池的阴极所发生的反应
21、某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是
A a为正极,b为负极;NaClO和NaCl
B a为负极,b为正极;NaClO和NaCl
C a为阳极,b为阴极;HClO和NaCl
D a为阴极,b为阳极;HClO和NaCl
22、通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1,则下列表述正确的是(D)
A 在两个阴极上得到的银和汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1
B 在两个阳极上得到的产物的物质的量不相等
C 硝酸亚汞的分子式为HgNO3
D 硝酸亚汞的分子式为Hg2(NO3)2
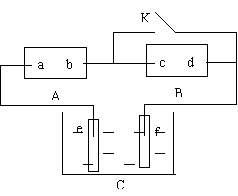 23、右图A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C
点显红色,请填空:
23、右图A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C
点显红色,请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为: 。
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为: ,电极f上发生的反应为: ,槽中盛放的镀液可以是 或 (只要求填两种电解质溶液)。
(1)正 (2分) (2)2NaCl+2H2O H2↑+Cl2↑+2NaOH (2分)
(4) Zn-2e = Zn2+, Zn2++2e = Zn,ZnSO4溶液或ZnCl2溶液 (3分