![]()
| 学 科 | 化学 | 版 本 | 人教版 | 期 数 | 2331 |
| 年 级 | 高三 | 编稿老师 | 邹映波 | 审稿教师 |
|
【同步教育信息】
一. 本周教学内容:
专题复习--有关pH计算、电解质溶液中离子浓度的关系
有关pH计算:
(一)三种类型pH计算:
1. 电解质溶液加水稀释
(1)强电解质溶液的稀释;
(2)弱电解质溶液的稀释。
2. 不同浓度的强酸(或强碱)自相混合pH计算:
(1)酸I+酸II
![]()
(2)碱I+碱II
![]()
3. 酸碱混合溶液pH的计算:
(1)混合溶液呈中性:
![]()
![]()
(2)混合溶液呈酸性:
![]()
(3)混合溶液呈碱性:
![]()
(二)酸碱稀溶液pH值计算途径
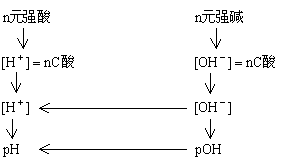
![]()
电解质溶液中离子浓度的关系:
(一)运用好两个守恒关系:
1. 电荷守恒关系:阴阳离子电荷数相等,即溶液为电中性;
2. 物料守恒关系:即各种元素的原子个数在溶解前后保持不变。
此两种守恒关系,决定了溶液中离子间等式关系成立的基础。
(二)一种电解质溶液中离子浓度大小的比较:
1. 强酸弱碱盐溶液:主抓弱碱离子水解平衡;
2. 强碱弱酸盐溶液:主抓弱酸根离子水解平衡;
3. 弱酸溶液:主抓弱酸的电离平衡;
4. 弱碱溶液:主抓弱碱的电离平衡;
5. 强碱弱酸溶液的酸式盐溶液:主抓酸式酸根离子的电离和水解两种平衡。
(三)两种电解质溶液混合后离子浓度大小的比较:
1. 强酸与弱碱混合(或强碱与弱酸混合):
a. 恰好反应时,主抓两溶液混合生成强酸弱碱盐的水解情况;
b. 当弱碱(或弱酸)剩余时,溶液的酸碱性由强酸弱碱盐(或强碱弱酸盐)水解和弱碱(或弱酸)的电离相对大小决定。
2. 强碱弱酸盐与强酸混合(或强酸弱碱盐与强碱混合);主抓两溶液混合后生成的弱酸(或弱碱)的电离。
当弱酸(或弱碱)与盐的浓度相同时,通常情况,弱酸(弱碱)的电离程度大于强碱弱酸盐(强酸弱碱盐)的水解程度。
3. 强碱弱酸盐与弱酸混合(或强酸弱碱盐与弱碱混合)主抓题设中的条件。
【模拟试题】
有关pH计算:
1. 常温下,从pH=3的弱酸溶液中取出1mL的溶液,加水稀释到100mL,溶液的pH为_________。
2. 常温下,等体积混合0.1mol/L盐酸和0.06mol/L氢氧化钡溶液后,溶液的pH为_________。
3. 在25℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸pH与强碱的pH之间的关系应满足____________。
4. 某温度时,水的KW=10-13,将该温度下pH=11的NaOH溶液aL与pH=1的硫酸溶液bL混合。
(1)若所得混合液为中性,则a:b=________
(2)若所得混合液的pH=2,则a:b=________
(3)若所得混合液的pH=10,则a:b=________
5. 常温下,某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合后pH=7,则酸溶液体积V(酸)和碱溶液体积V(碱)的关系是______________。
6. 分析下列室温下等体积的酸和碱溶液,混合后pH的情况:
(1)pH=3的硝酸跟pH=11的氢氧化钾溶液:
(2)pH=3的盐酸跟pH=11的氨水:
(3)pH=3的硫酸跟pH=11的氢氧化钠溶液:
(4)pH=3的醋酸跟pH=11的氢氧化钡溶液:
7. 常温下,把80mLNaOH溶液加入到120mL盐酸中,所得溶液的pH=2,如果混合前NaOH溶液和盐酸的物质的量浓度相同,则它们的浓度是___________。
8. 常温下,一元碱A与0.01mol/L的一元强酸等体积混合后所得溶液的pH为7。以下说法正确的是( )
A. 若A为强碱,其溶液的物质的量浓度等于0.01mol/L
B. 若A为弱碱,其溶液的物质的量浓度大于0.01mol/L
C. 反应前,A溶液中[OH-]一定是0.01mol/L
D. 反应后,混合溶液中阴离子的浓度大于阳离子浓度
9. 室温时,0.06mol/L硫酸溶液与0.01mol/L氢氧化钠溶液等体积混合后,所得溶液的pH为____________。
10. 在室温下将pH=3的强酸溶液和pH=12的强碱溶液混合,当混合溶液的pH=11时,强酸与强碱溶液的体积比是________。
11. 25℃,往V mLpH=a的H2SO4溶液中滴入pH=b的NaOH溶液10VmL时,溶液中![]() 与Na+的物质的量之比恰好为1:2,则a与b之和为( )
与Na+的物质的量之比恰好为1:2,则a与b之和为( )
A. 13 B. 14 C. 15 D. 不能确定
12. 现有25℃pH=13的Ba(OH)2溶液:
(1)该Ba(OH)2溶液的物质的量浓度为_________;
(2)加水稀释100倍,所得溶液中由水电离出[OH-]=_____________;
(3)与pH=13的NaOH溶液按体积比1:4混合,所得溶液的pH=_________;
(4)与pH=10的NaOH溶液等体积混合,所得溶液中[H+]=___________;
(5)与某盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11,该盐酸溶液的pH=_________;
(6)加入一定体积浓度为Cmol·L-1的Na2SO4溶液恰好完全反应,所得溶液pH=12,则C值为___________。
电解质溶液中离子浓度的关系:
1. 在硫化钠溶液中,下列关系正确的是:( )
![]()
![]()
![]()
![]()
2. 在氯化铵溶液中,下列关系正确的是( )
![]()
![]()
![]()
![]()
3. 在0.1mol/L氢硫酸溶液中,下列关系错误的是( )
![]()
![]()
![]()
![]()
4. 在0.1mol/LNaHCO3溶液中,下列关系正确的是( )
![]()
![]()
![]()
![]()
5. pH=3的盐酸与pH=11的氨水等体积混合,溶液中离子浓度关系正确的是( )
![]()
![]()
![]()
![]()
6. 浓度均为0.1mol/L的甲酸和NaOH溶液等体积混合后,下列关系正确的是( )
![]()
![]()
![]()
![]()
7. 0.2mol/L醋酸钾溶液与0.1mol/L盐酸等体积混合,溶液中下列微粒的物质的量浓度关系正确的是( )
![]()
![]()
![]()
![]()
8. 0.1mol/LNaOH溶液与0.1mol/L氯化铵溶液等体积混合,溶液中离子浓度大小关系正确的是( )
![]()
![]()
![]()
![]()
9. 在物质的量浓度均为0.01mol/L的醋酸和醋酸钠混合溶液中,测得[CH3COO-]>[Na+],则下列关系正确的是( )
![]()
![]()
![]()
![]()
![]()
【试题答案】
有关pH计算:
1. 3~5 2. 12 3. pH(酸)+pH(碱)=15
4. (1)10:1 (2)9:2 (3)101:9
5. ![]()
6. (1)pH=7;(2)pH>7;(3)pH=7;(4)pH<7
7. 0.05mol/L 8. AB 9. 2 10. 9:2 11. A
12. (1)0.05mol/L;(2)10-11mol/L;(3)13;(4)2×10-13mol/L;
(5)2;(6)5.6×10-2mol/L
![]()
电解质溶液中离子浓度的关系:
1. D 2. A 3. A 4. BD 5. B 6. A 7. D 8. B 9. AD
| 年级 | 高三 | 学科 | 化学 | 版本 | 人教版 | 期数 | 2331 | |||||
| 内容标题 | 专题复习--有关pH计算、电解质溶液中离子浓度的关系 | |||||||||||
| 分类索引号 | G.623.3 | 分类索引描述 | 学习资料 | |||||||||
| 主题词 | 专题复习--有关pH计算、电解质溶液中离子浓度的关系 | 栏目名称 | 同步课堂 | |||||||||
| 编稿老师 | 邹映波 | 审稿老师 | ||||||||||
| 录入 | 张丽君 | 一校 | 康纪云 | 二校 | 王佳娣 | 审核 | ||||||