高三化学月考试卷3
可能用到的数据:H-1 C-12 O-16 Ne-20 S-32 Cu-64
Zn-65 Ba-137
一、选择题:(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意)
1、 我国三峡工程所提供的清洁、价廉、可再生的水电,相当于每年燃烧500万吨原煤的火力发电厂生产的电能,因此,三峡工程有助于控制
A.温室效应 B.氮的氧化物排放
C.白色污染 D.对臭氧层的破坏
2、 同主族第二周期与第三周期两种单质熔点相比较
A.大于 B.小于 C.等于 D.无法确定
3、 自从下列哪项发现或学说开始,化学才开始成为一门科学?
A.阿佛加德罗提出原子——分子学说
B.拉瓦锡确定空气的组成
C.道尔顿提出近代原子学说
D.汤姆生发现电子
4、 下列对锂及其化合物的叙述中正确的是
A.氢化锂(LiH)中锂和氢两种离子所含电子数不相同
B.锂和铍最外层电子数均较少,都能与冷水剧烈反应产生氢气
C.锂可用于制合金,热核反应材料氚
D.氢氧化锂碱性与氢氧化铍相当
5、 关于碳酸氢钙的以下说法中,正确的是
A.用加热浓缩结晶的方法,可以从溶液中得到固态碳酸氢钙
B.在270°C开始分解,有气态二氧化碳释出
C.其溶液可以使PH试纸显红色
D.可以由碳酸钙在碳酸中溶解而形成碳酸氢钙溶液
二、选择题:(本题包括12小题,每小题3分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
用乙烯在硫酸存在下的水化法合成乙醇,事实上经过下列步骤:首先在较低温度下用浓H2SO4吸收乙烯CH2=CH2+H2SO4(浓)→ CH3CH2OSO3H(I),然后生成物(I)再进一步吸收乙烯CH2=CH2+CH3CH2OSO3H→(CH3CH2O)2SO2(II),再加入水,(I)和(II)均与水反应生成乙醇CH3CH2OSO3H+H2O→CH3CH2OH+H2SO4(III),(CH3CH2O)2SO2+2H2O→2CH3CH2OH+H2SO4(IV)。认真阅读以上内容,回答6~7小题:
6、 上述反应过程中,H2SO4是
A.反应物 B.生成物 C.中间产物 D.催化剂
7、 下列叙述正确的是
A.化合物(I)、(II)均属于酯类 B.反应(I)、(II)均属于加成反应
C.反应(III)、(IV)属于氧化反应 D.以上说法均不正确
8、 两短周期元素X和Y能形成XY4型化合物,若X元素的原子序数为a,Y的原子序数为b,则a和b的下列关系中不可能的是
A.a=b+13 B.b=a+11 C.b=a+8 D.a=b+5
9、 一定质量的铜与足量的浓硝酸或稀硝酸反应,在相同条件下用排水法收集反应产生的气
体,下叙述正确的是
A.硝酸浓度越大,反应速率越快 B.硝酸浓度越大,收集到的气体越多
C.硝酸浓度越小,收集到的气体越多 D.两者收集到的气体体积相等
10、下列有关苯酚的叙述中正确的是
A.苯酚是种弱酸,它能与NaOH溶液反应
B.在苯酚钠溶液加入稀盐酸可得到苯酚
C.苯酚有毒,但药皂中掺有少量苯酚
D.除去苯中少量苯酚可用溴水作试剂
11、下列溶液中加入铝粉放出氢气,则该溶液中离子一定能大量共存的是
A.Na+、Br-、SO42-、Cl- B.Fe2+、K+、Cl-、SO42-
C.K+、Na+、CO32-、Cl- D. K+、Na+、NO3-、AlO2-
12、在某未知溶液中,再溶解CH3COONa晶体,测得[CH3COO];[Na+]接近等于1:1,对原来未知溶液的判断可能正确的是
A.[Na+]:[CH3COO-]<1:1 B.可能是强酸溶液
C.可能是强碱溶液 C.不可能是中性溶液
13、若某氖原子的质量是ag,12C原子质量为bg,用N0表示阿伏加德罗常数,下列说法正确的是
A.氖元素的原子量为![]() B.wg该氖原子的物质的量为
B.wg该氖原子的物质的量为![]() mol
mol
C.该氖原子的摩尔质量为aN0g D.wg该氖原子所含质子数为![]()
14、下列离子方程式正确的是
A.硫酸氢钠溶液滴加氢氧化钡溶液至中性:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.明矾溶液滴加氢氧化钡溶液至沉淀质量最大:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.碘化亚铁溶液加氯水恰好将Fe2+全部氧化:
2Fe2++4I-+3Cl2=2Fe3+6Cl-+2I2
D.磷酸二氢钠溶液加过量Ca(OH)2溶液:
3H2PO4-+3Ca2++6OH-=Ca3(PO4)2↓+PO43-+6H2O
放电
![]()
![]()
![]()
![]() 15、爱迪生电池总反应式为Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,以下关于该电池的说法正确的是
充电
15、爱迪生电池总反应式为Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2,以下关于该电池的说法正确的是
充电
A.工作时阳离子向负极移动,阴离子向正极移动
B.充电时铁电极发生氧化反应
C.该电池与铅蓄电池不同,两电极必须浸入碱溶液
D.工作时负极区PH值减小
16、一种酸溶液甲和一种碱溶液乙,若将它们等体积混合后,溶液PH>7,则下列说法中不正确的是
A.甲为弱酸,乙为强酸,反应前甲的[H+]和乙的[OH-]相等
B.甲为强酸,乙为二元强碱,反应前甲、乙两溶液物质的量浓度相等
C.甲为强酸,乙为弱碱,反应前甲、乙的PH值之和等于14
D.甲为一元弱酸,乙为一元强碱,反应前两溶液物质的量浓度相等
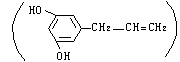 |
17、有关有机物A 的下列化学性质说法不正确的是
A.1molA分别与足量H2、溴水反应,消耗H2、Br2物质的量相等
B.A不能与羧酸发生酯化反应,但遇FeCl3能发生显色反应
C.A只能发生缩聚反应,不能发生加聚反应
D.既能燃烧,又能溶于KOH溶液
二、选择题:(本题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意)
18、将amol FeS与bmol FeO的混合物放入vml cmol/L的浓HNO3中,充分反应后混合物全部溶解,得到产物为Fe(NO3)3、H2SO4、NO2、NO、H2O。参加反应的硝酸中未被还原的HNO3物质的量为
A.(cv-3a-3b)mol B.3(a+b)mol C.(a+b)mol D.无法计算
19、惰性电极电解20ml CuSO4、ZnSO4混合溶液,其中[CuSO4]=0.5mol/L,[ZnSO4]=1mol/L,当电路中有0.04mol电子通过时,阴极增重(不考虑H+放电)
A.1.28g B.0.65g C.1.29g D.0.64g
![]()
![]()
![]()
![]() 20、可逆反应2A(气)+B(气) 3C(气)+D(气)+Q(Q>0)达到平衡后,改变下列条件中的一个,逆反应速率始终增大直至重新达到平衡的是
20、可逆反应2A(气)+B(气) 3C(气)+D(气)+Q(Q>0)达到平衡后,改变下列条件中的一个,逆反应速率始终增大直至重新达到平衡的是
A.增大C浓度 B.升高温度 C.增大压强 D.增大A的浓度
21、常温下某强酸溶液和某强碱溶液的PH值之和为13,将这二种酸和碱按一定比例混合后的溶液PH=7,混合时酸和碱的体积比是
A.1:1 B.1:2 C.1:10 D.10:1
![]() 22、关于CHF2-CH=CH- o -C≡C-CH3的分子结构说法正确的是
22、关于CHF2-CH=CH- o -C≡C-CH3的分子结构说法正确的是
A.分子中12个碳原子一定在同一平面
B.分子中有7个碳原子可能在同一直线
C.分子中最多有6个碳原子能在同一直线上
D.分子中最多有8个碳原子能在同一直线上
23、在120°C,101kPa时,1LC3H8和一定量的O2混合后点燃,充分作用后生成水和碳的氧化物气体,恢复到原温度和压强后,测得气体体积为mL,混合气体通过碱石灰后,气体体积变为nL,若m-n=6,则原来通入的O2的体积为
A.5.5L B.5L C.4L D.4.5L
![]() R′[O] Zn
R′[O] Zn
![]() 24、已知烯烃有如下反应规律RCH=C —→——→RCHO+R′COR″现将1mol分子
24、已知烯烃有如下反应规律RCH=C —→——→RCHO+R′COR″现将1mol分子
R″ H2O
式为CnH2n-4的烃(不含C=C=C结构)经上述方法处理后得到的有机物和羰基的物质的量不可能是
A B C D
有机物(mol) 1 3 4 5
分子中羰基数(mol) 2 4 6 8
25、为了除去氯化铁溶液中少量氯化亚铁,可使用(1)氧气;(2)氯水;(3)漂液(主要成份NaClO);(4)过氧化钠;(5)浓HNO3;(6)过氧化氢。
A.(1)(2)(6) B.(1)(2)(3)(6) C.(!)(2)(4) D.全部
四、(本题包括2小题,共17分)
26、(9分)某澄清透明待测液中可能含有NH4+、Mg2+、Al3+、Fe2+、Cu2+、Br-、NO3-、
SO42-、SO32-等离子中的一种或数种,进行下列实验:
![]() →白色沉淀A
→白色沉淀A
过量Cl2、BaCl2溶液
待测液————————— 淀粉KI溶液
![]() 过滤
汽油 →上层—————→变蓝
过滤
汽油 →上层—————→变蓝
![]() →滤液—— 淀粉KI溶液
→滤液—— 淀粉KI溶液
过量 过滤 →下层—————→变蓝
NaOH溶液
![]() ↓ ↓ 盐酸
盐酸
↓ ↓ 盐酸
盐酸
![]()
![]()
![]()
![]() 沉淀B 滤液——→白色沉淀C——→C溶液
沉淀B 滤液——→白色沉淀C——→C溶液
![]() 盐酸 H2S
盐酸 H2S
![]() →溶液D—→淡黄色沉淀
→溶液D—→淡黄色沉淀
根据实验结果回答:
(1)待测液中有无SO32-_______(“有”或“无”),理由___________
(2)沉淀B中肯定含有的物质化学式为_______________,可能含有的物质的化学式_____________。
(3)不能确定是否存在的阴离子是___________。
27、(8分)用下图装置,可以制备两种常见的气体及试验其性质(必要的铁架台铁圈已略去),其操作步骤如下:
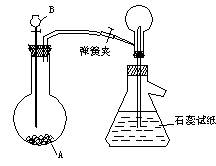 (1)按图连接好装置,检查气密性;
(1)按图连接好装置,检查气密性;
(2)取下双孔塞,向烧瓶中加入药品A,塞上塞子,再向分液漏斗中加入B;
(3)开启活塞,滴加B,使气泡均匀产生,待吸滤瓶内石蕊试液变色时,停止滴加B,无气体产生,弹簧夹夹住支管烧瓶处胶皮管,分离制取装置,让胶皮管留在右烧瓶支管口处,封住气体出口;
(4)用洗耳球尖嘴塞住吸滤瓶支管口,挤压洗耳球,使石蕊试液升至烧瓶内,松开洗耳球,则产生美丽的喷泉,请回答下列问题:
①操作步骤(1):如何检查整套装置的气密性______________________.
②若石蕊试液变蓝,则药品A(固体)为_________,能制取该气体的原因是________。若石试蕊试液变红,且A、B均为无色液体,药品A是________,制取该气体是利用了B的_________。
③当石蕊试液充满烧瓶后,此时烧瓶内溶液物质的量浓度约为________。
五、(本题包括3小题,共16分)
28、(4分)(1)某二价金属碳酸盐和碳酸氢盐的混合物跟足量的盐酸反应,消耗H+和产生CO2的物质的量之比为6:5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为_______。
A、1:1 B、1:2 C、1:3 D、1:4
(2)根据硼在周期表中的位置,推断并写出氮化硼(其中硼为+3价)在赤热时与水蒸气反应生成两种物质的化学方程式:
_______________________________________________。
29、(6分)A、B、C、D是中学化学中常见的四种化合物,它们各由两种元素组成;甲、乙、丙是三种单质。这些化合物和单质之间存在如下关系:
![]()
![]()
![]() 单质丙 单质乙
单质丙 单质乙
化合物B ————单质甲 ——→ 化合物A
![]()
![]()
![]()
![]()
![]()
![]() ↓化合物D ↓ 化合物C ↓单质乙
↓化合物D ↓ 化合物C ↓单质乙
化合物A和单质丙 SO2和化合物B 化合物D
据此判断化合物A、B、C化学式:A________B_______C_______A的电子式________。
![]() 30、(6分)在10.0°C和200kPa的条件下,反应aA(g) dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度不变)。下表列出了不同压强下反应建立平衡时物质D的浓度:
30、(6分)在10.0°C和200kPa的条件下,反应aA(g) dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度不变)。下表列出了不同压强下反应建立平衡时物质D的浓度:
| 压强/Kpa | 200 | 500 | 1000 |
| D的浓度/mol·L-1 | 0.085 | 0.20 | 0.44 |
根据表中数据,回答下列回答:
(1)压强从200kPa增加到500kPa时,平衡向_______反应方向移动(填“正”或“逆”),理由是____________________________。
(2)压强从5ookPa增加到1000kPa时,平衡向________反应方向移动(填“正”或“逆”),理由是____________________________。
六、(本题包括2小题,共18分)
31、(8分)下面是一个合成反应的流程图:
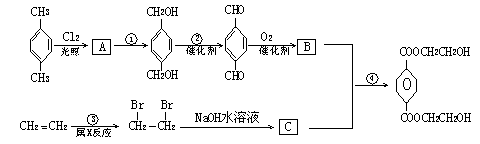 |
写出:(1)中间产物的结构简式:A_______B________C_______
(2)反应试剂:①_________②_______③_________④__________
(3)反应类型:x为_________。
32、(10分)工程塑料ABS树脂的片断为:
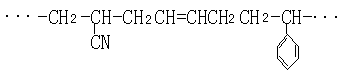 |
工业上制备它的过程如下:
H2O HCN
![]()
![]()
![]() R——→Y——→ A ———————————————————
R——→Y——→ A ———————————————————
加成 I II III
![]() Y+2Z——→HO-CH2-C=C-CH2-OH——→W—→B ——→ABS树脂
Y+2Z——→HO-CH2-C=C-CH2-OH——→W—→B ——→ABS树脂
反应
Cl2 消去反应
![]() X——→Q————→ S —————————————————
X——→Q————→ S —————————————————
光 催化剂△
回答下列问题:
(1)有机物的结构简式:X________ Y _________Z_________
(2)反应基本类型:I________II______III__________
(3)Q的结构简式可能为__________________________
(4)A、B和S三种单体中,碳氢比(C:H)值最小的单体是________。
(5)经元素分析可知该ABS样品的组成为CaHbNc(a、b、c为正整数),则原料中A和B的物质的量之比是____________(用a、b、c表示)。
七、(本题包括2小题,共14分)
33、(6分)有HCl和CuSO4混合溶液,向其中加入一定量的Ba(NO3)2后,得4.66g白色沉淀,过滤后检验滤液中含有Ba2-等,向此滤液中加入1mol/L AgNO3溶液150ml,刚好把Cl-全部沉淀完。将AgCl沉淀滤出后,向滤液中加入1mol/L的NaOH溶液xml,恰好可得到最大数值的蓝色沉淀。计算原混合溶液中HCl、CuSO4的物质的量及x的值。
34、(8分)有一批PbO和PbO2的混合物样品,用高锰酸钾法测定其含量。称取该样品加入20.00ml 0.2500mol·L-1草酸溶液,将PbO2还原为Pb2+,然后用氨水中和溶液,使全部Pb2+形成PbC2O4沉淀,化学方程式为:
PbO2+4H++C2O42-=Pb2++2H2O+CO2↑
Pb2++H2C2O4+2NH3·H2O=PbC2O4↓+2NH4++2H2O
过滤后将滤液酸化,用标准KMnO4溶液滴定,共用0.04mol·L-KMnO4溶液10.00ml;沉淀溶解于酸中再用同浓度的KmnO4标准溶液滴定,用去了30.00ml,化学方程式为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
计算试样中PbO和PbO2的质量分数(摩尔质量:PbO2-239g/mol,PbO-223g/mol)
第一学期期中考试
高三年级化学试题答案
班级______学号______姓名_______
一、二、三、选择题:(共83分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| B | D | A | C | D | D | AB | C | AD | BC | A | AC | BD |
| 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | / |
| C | CD | AB | C | B | C | D | C | C | D | D | A |
26、(9分)(1)无,理由溶液中肯定含Al3+,与SO32- 不能共存
(2)Fe(OH)3, Mg(OH)2
(3)Br-、NO3-
27、(8分)①微热烧瓶、吸滤瓶中产生气泡。
![]()
![]()
![]()
![]() ②A(固体)为NaOH,原因是NH3+H2O NH4+OH-,加入NaOH,增大
②A(固体)为NaOH,原因是NH3+H2O NH4+OH-,加入NaOH,增大
[OH-]平衡向左移动。A是浓盐酸利用了B的吸水性。
③0.045mol/L。 高温
28、(4分)(1)B(2)BN+3H2O=====NH3+H3BO3
![]()
![]()
![]()
![]() 29、(6分)A CO2 B H2O C H2S 。 A电子式
29、(6分)A CO2 B H2O C H2S 。 A电子式![]() : O :: C :: O :
: O :: C :: O :
30、(6分)(1)逆,理由是压强增大2.5倍,而D的浓度增大2.35倍
(2)正,理由是压强增大2倍,而D的浓度增大2.2倍,说明E可能已液化。
![]()
![]() CH2Cl COOH
CH2Cl COOH
![]()
![]() 31、(8分)(1)A O B O
C HO -CH2 -CH2-OH
31、(8分)(1)A O B O
C HO -CH2 -CH2-OH
![]()
![]() CH2Cl COOH
CH2Cl COOH
(2)①NaOH溶液 ②O2 ③Br2水 ④浓H2SO4
(3)x为加成反应
![]()
![]() CH2CH3
CH2CH3
![]() 32、(1)X O
Y CH CH
Z HCHO
32、(1)X O
Y CH CH
Z HCHO
(2)I加成反应 II消去反应 III加聚反应
![]()
![]() CH2CH2Cl CLCHCH3
CH2CH2Cl CLCHCH3
![]()
![]() (3) O
O
(4)B或C4H6
(3) O
O
(4)B或C4H6
(5)C:![]()
33、n![]() =
=![]() =0.02mol
=0.02mol
nHCl=0.15mol
X=190ml
34、PbO%=65.1%
PbO2%=34.9%