高三化学周练(二)
可能用到的原子量:
H-1 C-12 O-16 N-14 S-32 Cl-35.5 Fe-56 Cu-64 Ba-137
第Ⅰ卷(选择题 共60分)
一.选择题(每小题只有一个正确答案,将正确答案前的字母填在答题卡中。本题共有30小题,每小题2分,共60分。)
1.下列物质溶于水时无气体产生的是
A. 钾 B.五氧化二磷 C.电石 D.过氧化钠
2.不能用分液漏斗进行的操作是
A. 滴加液体 B.萃取 C.过滤 D.分液
3.下列物质在光照条件下不发生分解反应的是
A. 次氯酸 B.浓硝酸 C.溴化银 D.氢氧化钙
4.镁条在下列气体中不能燃烧的是
A. 二氧化碳 B.氮气 C.氩气 D.氧气
5.下列各组物质均为离子化合物的是
A. 硫酸、 硫酸铵 B.金刚石、 铁
C. 油脂、 酯 D.碳铵、 烧碱
6.在炼钢将要结束时,通常向钢水中加入一些硅铁,锰铁或金属铝目的是
A. 除去钢水中的氧 B.除去磷和硫
C.除去氧化亚铁 D.除去钢渣
7.某二价金属阳离子核外有18个电子,其质量数为40,则它的原子核内中子数为
A.18 B.20 C.22 D.24
8.属于原子晶体的化合物是
A. 甲烷 B.白磷 C.金刚石 D.水晶
9.能与稀盐酸或稀硫酸反应的黑色固体是
A.MnO2 B.石墨 C.FeO D.Fe2O3
10.下列物质中有Cl-存在的是
A. 液态氯化氢 B.氯水 C.次氯酸钙 D.氯酸钾
11.下列反应的产物是氧化铁的是
A. 细铁丝在氧气中燃烧 B.铁与灼热的水蒸气反应
C. 向铁水中吹入少量O2 D.加热灼烧Fe(OH)3沉淀物
12.在变化中浓硫酸只起氧化作用的是
A.浓H2SO4和H2S反应 B.浓H2SO4和Cu片反应
C.浓H2SO4和酒精共热 D.浓H2SO4和Na2SO3反应
13.下列实验现象描述是错误的是
A.氨气与氯化氢气体相遇形成白烟
B.硫化氢气体使湿润的醋酸铅试纸变黑
C.装浓硝酸试剂瓶打开瓶盖冒白烟,所以称为发烟硝酸
D.铜丝在氯气中燃烧,冒棕黄色的烟
14.制备干燥的氨气最适宜的药品是
A.NH4Cl溶液、NaOH溶液
B.饱和氨水、浓硫酸
C.NH4Cl晶体、NaOH溶液、无水氯化钙
D.NH4Cl晶体、消石灰、碱石灰
15.某气体有下列性质:①红棕色气体 ②水溶液呈酸性 ③加入NaOH溶液后褪色 ④加入AgNO3溶液无沉淀 ⑤使湿润的淀粉KI试纸变蓝。 由此检测它是
A.溴蒸气 B.NO C.Cl2 D.NO2
16.下列应用方法不恰当的是
A.用漂白粉作消毒剂 B.用硫酸钡作“钡餐”
C.工业上用浓硫酸和食盐反应生产盐酸 D.AgI用于人工降雨
17.下列各组离子中能大量共存的是
A.H+ K+ Fe2+ NO3- B.OH― Na+ Cl― NH4+
C.Ag+ NO3- Na+ S2- D.Mg2+ HCO3― Cl― K+
18.试管上沾有污物时,下列洗涤方法错误的是
A.用酒精洗涤碘 B.用热碱洗去油脂
C.用氨水洗去银镜 D.用二硫化碳洗去硫
19.下列叙述正确的是
A.把煤隔绝空气加强热使它分解的过程叫干馏
B.组成上相差一个或若干个-CH2原子团的有机物互为同系物
C.石油经过减压分馏的目的是为了得到更多的汽油
D.石油分馏和煤的干馏都属于化学变化
20.只用一种试剂就能鉴别硝酸银溶液、乙醇溶液、苯酚溶液、烧碱溶液、硫氰化钾溶液,该试剂是
A.溴水 B.盐酸 C.石蕊试液 D.氯化铁溶液
21.除去下列各组物质中混有少量杂质(括号内为杂质)所用试剂不正确的是
A.Fe2O3(Al2O3)用NaOH溶液 B.乙酸乙酯(乙醇)用乙酸
C.铜粉(FeS)用稀H2SO4 D.CO2(SO2)用饱和NaHCO3溶液
22.下列叙述正确的是
A.NaOH的摩尔质量是98克
B.22.4L HCl一定与1mol NH3完全反应
C.98 g纯硫酸约含有6.02×1023个硫酸分子
D.2mol/L NaOH溶液与1mol/L H2SO4溶液恰好完全反应
23.能证明碳酸的酸性比硅酸的酸性强的实验事实是
A.干冰是分子晶体,而SiO2是原子晶体
B.高温下能发生反应: Na2CO3+SiO2 ![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
C.CO2溶于水生成H2CO3 ,而SiO2却不溶于水
D.CO2 通入Na2SiO3溶液中有白色胶状沉淀生成
24.将4克NaOH溶解在10mLH2O中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度是
A.1mol/L B.0.1mol/L C.0.01mol/L D.10mol/L
25.将充有20mL N2和NO2气体的试管倒立在水槽中,充分反应后试管内残留气体10mL,则原混合气体中N2和NO2的体积比是
A.1∶1 B.1∶2 C.1∶3 D.2∶3
26. 下列关于铜电极的叙述, 不正确的是
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
27.在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e-→Cu或
Ag++e-→Ag在电极上放电,其析出铜的质量为1.92g,则析出银的质量为
A.1.62g B.6.48g C.3.24g D.12.96g
28. 银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
![]()
在此电池放电时,负极上发生反应的物质是 ( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
29.用石墨电极电解某酸、碱或盐的溶液时,在相同的条件下,阴阳两极收集到的气体的体积比是2∶1,则下列结论正确的是 ( )
A.阴极一定是H2,阳极一定是O2 B.电解后溶液的pH一定变大
C.电解后溶液的pH一定不变 D.电解后溶液的浓度一定变大
30.下列事实与胶体知识有关的是 ( )
①用盐卤点豆腐②水泥硬化③电泳电镀④明矾净水⑤在油脂的皂化液中加入食盐析出肥皂
A.②③④ B.①③⑤ C.①②⑤ D.全部都是
姓名:____________________
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
第Ⅱ卷(非选择题 共90分)
二.填空题(本题共有44个空格,每空格1分,共44分)
31.电解饱和食盐水时,电解槽的阳极是由 制成,阳极反应式 ,阴极是由 制成,阴极反应式 ,电解的离子方程
式 电解的化学方程式 。若在两极分别滴入酚酞试液,现象是 。设置隔膜的作用是 。
32.下图各容器中盛海水,铁会在其中发生变化。按铁极腐蚀的速度由快至慢的顺序为
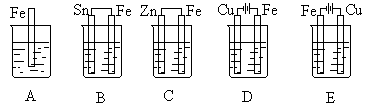
33.下图表示采用惰性电极电解相同物质量浓度,相同体积的KOH、CuSO4、NaCl溶液的情况。如果不考虑电解过程中溶液浓度变化对电极反应的影响,在相同的时间里,放出气体最多的是 溶液,放出气体最少的是 溶液。
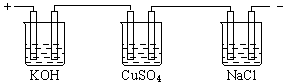
34.短周期元素A、B、C、D其核电荷数依次增大,A原子中最外层电子数为4,B的阴离子不能被任何氧化剂氧化,C原子最外层电子数为3,D元素位于第VA族。
(1)A元素的原子结构示意图是_______________
(2)B元素气态氢化物的电子式是______________,其水溶液是__________酸(填“强”或“弱”),该酸不能保存在玻璃瓶中,而应保存在______________ 中。写出工业上制取B元素的气态氢化物的化学方程式: _________________
(3)C元素的最高正价氧化物与氢氧化钠反应的化学方程式是
______________________________________________________
(4)D元素的最高正价氧化物的水化物化学式是________(只要写出最常用的一种)。1mol该物质吸收2.5mol氨气后的生成物是:___________________。
35. 地壳里含量最高的非金属元素是__________,金属元素是_________。这两种元素形成的化合物为___________,写出工业上通过该物质冶炼金属的化学方程式:____________________________________,具体生产过程中应加入__________作为熔剂,这是因为_________________________________的原因。
三.简答题(每小题4分,共8分)
41.为什么配制氯化亚铁溶液时,常常要加入少量盐酸,并放入一根铁钉?
42.用化学方程式表示由电石、食盐、水和必要的催化剂(允许加热等反应条件)合成聚氯乙烯。
四、完成下列化学反应的离子方程式(本题4分,每小题2分)
43.硫酸氢钠溶液与氢氧化钠溶液反应
44.实验室制取氯气
![]() 五、配平下列化学方程式(本题4分,每小题2分)
五、配平下列化学方程式(本题4分,每小题2分)
45.
46.□Cr2(SO4)3 +□H2O2 +□KOH —— □K2Cr2O7 +□K2SO4 +□H2O
六.实验题(共16分,其中第47题8分,第48题8分)
47.A、B、C、D四种可溶性盐,它们的阳离子可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子可能是NO3―、SO42―、Cl―、SO32―中的某一种(阴、阳离子都不重复使用)
(1)将四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
(2)向上述四支试管中分别加入盐酸,B盐溶液有沉淀产生,D盐溶液有刺激性气体逸出,则根据(1)(2)实验事实可推断它们的化学式为
A______________、B_____________、C____________、D____________
48.写出饱和FeCl3溶液与下列试剂发生反应时的现象和对应的化学方程式:
| 试 剂 | 现 象 | 化 学 方 程 式 |
| 硝酸银溶液 | ||
| 氨水 | ||
| 铁粉 | ||
| 沸水 |
七.计算题(第49题6分,第50题8分,共14分)
49.完全燃烧0.2mol某烃,生成14.4g水,试写出符合此条件的各种烃的分子式,并指出分别属于哪类烃。
50.取50.0毫升Na2CO3和Na2SO4的混和溶液,加入过量BaCl2溶液后得到14.51克白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66克,并有气体放出。试计算:(1)原混和溶液中Na2CO3和Na2SO4的物质的量浓度;(2)产生的气体在标准状况下的体积。