高三年级第1学期期末考试化学试卷
本试卷分第Ⅰ卷和第Ⅱ卷两部分。满分150分。
可能用到的相对原子质量:H—1 C—12 N—14O—16 Cl—35.5 Cu—64 Ag—108
第Ⅰ卷(选择题 共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.地处重庆市开县高桥镇的川东北气矿一矿井12月23日22时左右发生天然气“井喷”,事故发生后,当地医疗机构立即投入到紧张的抢救治疗工作中。目前的治疗方案主要是保证治疗室通风,为病人提供充足的氧气,必要时采用呼吸机。对于肺部感染的病人,对症采用美兰、细胞色素C、阿脱莫兰或某化学物质等药物进行静脉滴注。某化学物质可能是( )
A.NH4Cl B.KCl C.Na2S2O3 D.NaOH
2.以下说法正确的是( )
A.棉花、蚕丝和人造棉的主要成分都是纤维素
B.绿色食品是指不含任何化学物质的食品
C.制取镁粉时,可将镁蒸气在氮气中冷却
D.光导纤维是以二氧化硅为主要原料制成的
3.发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后产生的高温气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射场N2看到火箭喷出大量红烟,产生红烟的原因是( )
A.高温下N2遇空气生成NO2
B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2
D.NO与H2O反应生成H2和NO2
4.现有物质的量浓度均为0.1mol·L-1的下列三种物质的溶液:①HCl②CH3COOH③NH4Cl,其溶液中由水电离出的C(H+)的大小关系是 ( )
A.③>①>② B.①>②>③
C.③>②>① D.②>①>③
5.青苹果汁遇碘溶液显蓝色,熟苹果能还原银氨溶液,这说明( )
A.青苹果中只含淀粉不含糖类 B.熟苹果中只含糖类不含淀粉
C.苹果转熟时淀粉水解为单糖 D.苹果转熟时单糖聚合为淀粉
6.世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。下列说法正确的是 ( )
A.二氧化氯是强氧化剂 B二氧化氯是强还原剂
C.二氧化氯是离子化合物 D二氧化氯分子中氯为-1价
7.下列物质中:①NaHCO3、②Al(OH)3、③氨基乙酸、④CH3CH2OH,在一定条件下既能跟盐酸又能跟氢氧化钠反应的是 ( )
 A.①②
B.①③
A.①②
B.①③
C.①②③ D.①②③④
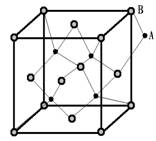
8.如图所示晶体中每个阳离子A或阴离子B,均可被另一种离
子以四面体形式包围着,则该晶体对应的化学式为( )
A.AB B.A2B C.AB3 D.A2B3
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分。)
9.化学反应过程中发生物质变化时,常常伴有能量的变化。这种能量的变化常以热能的形式表现出来,叫反应热。由于反应的情况不同,反应热可以分为多种,如燃烧热和中和热等等。下列△H表示燃烧热的是 ( )
A.2H2(g)+O2(g)===2H2O(l); △H1
B.C(s)+1/2O2(g)===CO(g); △H2
C.CH4(g)+2O2(g)===CO2(g)+2H2O(l); △H3
D.C(s)+O2(g)===CO2(g); △H4
10.下列各项性质的比较正确的是 ( )
A.熔点:K>Na>Li B.氧化性:Cu2+>H+>Fe2+
C.酸性:HClO4>H2SO4>H3AsO4 D.半径:K+>Cl->Al3+
11.下列反应的离子方程式正确的是 ( )
A.氯气溶于水:Cl2+H2O====H++HClO
B.金属铝溶于氢氧化钠溶液:Al+2OH-===AlO2-+H2↑
![]() C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2===2C6H5OH+CO32-
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2===2C6H5OH+CO32-
D.实验室制备氢氧化铁胶体:Fe3++3H2O Fe(OH)3(胶体)+3H+
12.下列各项实验操作中,正确的是 ( )
A.为使制取H2的速率加快,可向H2SO4中加少量CuSO4溶液
B.为加快过滤速度,可用玻璃棒搅拌过滤器中的食盐水
C.为迅速除去乙酸乙酯中的少量乙酸,可加入足量NaOH溶液并加热
D.为除去试管内壁上的“银镜”,可用氨水洗涤
13.可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应
①Br2+2e-=2Br- ②2Br- -2e-= Br2 ③Zn-2e-=Zn2+ ④Zn2+ +2e-=Zn-
其中表示充电时阳极反应和放电时的负极反应的分别是 ( )
A.②和③ B.②和① C.③和① D.④和①
14.下列各组中,两种气体的分子数一定相等的是 ( )
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.体积相等、密度相等的CO和C2H4 D.压力相同、体积相同的N2和O2
15.往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g)===2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件(混合气体总物质的量不变),且造成容器内压强增大,下列说法正确的是 ( )
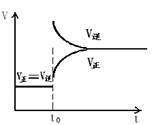 A.容器内气体颜色变深,平均相对分子质量不变
A.容器内气体颜色变深,平均相对分子质量不变
B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小
D.改变条件前后,速度图象为(如右图)
![]() 16.某二元酸(化学式用H2Y表示)在水中电离的方程式是:
16.某二元酸(化学式用H2Y表示)在水中电离的方程式是:
H2Y=H++HY- HY- H++Y2-
下列有关该酸的酸式盐NaHY水溶液的叙述中正确的是 ( )
A.若0.1mol·L-1NaHY溶液的Ph=2,则0.1mol·L-1H2Y溶液中氢离子的物质的量浓度小于0.1mol·L-1
B.在该盐的溶液中,离子浓度为:C(Na+)>C(Y2-)>C(HY-)>C(OH-)>C(H+)
![]() C.在该盐的溶液中,离子浓度为:C(Na+)> C(HY-)> C(H+)
>C(OH-)
C.在该盐的溶液中,离子浓度为:C(Na+)> C(HY-)> C(H+)
>C(OH-)
D.HY-水解方程式为:HY-+H2O H2Y+OH-
17.6.4gCu跟足量的浓硫酸共热,充分反应后,下列说法错误的是 ( )
A.有0.2molH2SO4被还原 B.有0.1molH2SO4被还原
C.有2.24LSO2气体生成 D.有0.2molH2SO4发生反应
18.两种有机物以一定比例混合,在一定条件下在aLO2(足量)中燃烧,充分反应后恢复到原状态,再通过足量Na2O2层,得到气体仍为aL,下列混合物符合此条件的是 ( )
A.CH4 C2H4 B.CH3OH CH3COOH
C.C2H6 HCHO D.HCOOH CH3COOCH3
第Ⅱ卷(非选择题 共78分)
三、(本题包括2小题,共18分)
19.氯化亚砜(SOCl2)是一种无色液体,沸点79℃,重要有机试剂,用于将ROH转化为RCl。氯化亚砜遇水水解(水解前后元素化合价无变化),需在无水条件下使用。
(1)试写出它与水完全反应的化学方程式:________________________________;
(2)设计一些简单的实验来验证你写的化学方程式是正确的。(只需给出实验原理,无须描叙实验仪器和操作。)__________________________________________
___________________________________________________________________
(3)实验室制取无水氯化锌是将ZnCl2·xH2O与SOCl2混合加热的方法。试回答:SOCl2的作用______________________________________________________。
20.乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
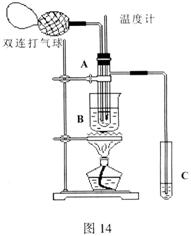 请回答下列问题:
请回答下列问题:
(1) 试管A内在60℃~80℃时发生的主要反
应化学方程式为(注明反应条件):
__________________________________
(2)在实验的不同阶段,需要调整________
(填仪器的名称)的位置;
(3)烧杯B内盛装的液体可以是__________
(写出一种即可);
(4)若想检验试管C中是否含有产物乙酸,请
你在所提供的药品中进行选择,设计一个
简便的实验方案。所提供的药物有:pH试
纸、红色的石蕊试纸、白色的醋酸铅试纸、
碳酸氢钠粉末(实验仪器任选)。该方案为______________________________。
(5)久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液。据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基。当n=3时,试写出(C2H4O)n的结构简式________________。
四、(本题包括2小题,共20分)
21.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①C(Cl-)>C(NH4+)>C(H+)>C(OH-)
②C(Cl-)>C(NH4+)> C(OH-) > C(H+)
③C(NH4+) > C(Cl-) > C(OH-)> C(H+)
④C(Cl-)> C(H+)> C(NH4+) >C(OH-)
填写下列空白(已知氨水的电离大于铵根离子的水解):
(1)若溶液中只溶解了一种溶质,则该溶质是________________,上述四种离子浓度大小顺序为___________(填序号)。
(2)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
C(HCl)____________C(NH3·H2O)(填“大于”、“小于”或“等于”);
(3)若上述关系中③是正确的,则该溶液中的溶质为__________________;
若上述关系中④是正确的,则该溶液中的溶质为__________________。
22.X、Y、A、B、C、D是中学化学教材中常见的化合物,且有如下转化关系。气体C的式量比气体X的式量大2,产物中水已忽略。
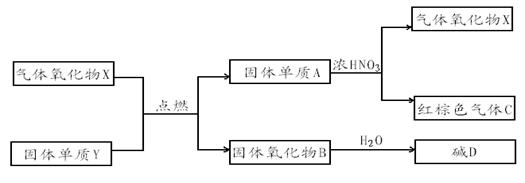
回答下列问题:
(1)X分子的电子式是______________________。
(2)在上述转化过程中作还原剂的物质有(填物质的化学式)___________________
(3)A与浓HNO3反应的化学方程式为_______________________________________
(4)测定气体C的相对分子质量,测得的数值与气体的相对分子质量有差异的原因是(用化学方程式表示)_____________________________________________________。
五、(本题包括2小题,共22分)
23.(1)乙酸中含有的基团有甲基、羰基、_____________、________________。
(2)实验测知:用CH3CO18OH和CH3CH2OH反应以后,在水溶液和乙酸乙酯中均测出含有18O,进一步实验表明所得到的乙酸乙酯的平均相对分子质量为89,据此推测得到的乙酸乙酯的结构简式可能是______________________和_______________,它们的物质的量之比为_________________。
(3)由(2)可知乙酸跟乙醇在浓硫酸存在并加热条件下发生的酯化反应可能经历了生成中间体这一步,请写出中间体可能的结构简式_______________________。
24.已知烯烃经臭氧氧化作用可发生如下反应:
![]()
以某烯烃A(含一个碳碳双键)为原料制取某有机物F(F的相对分子质量为88,分子中含有两个甲基),已知D能发生银镜反应,过程如下:
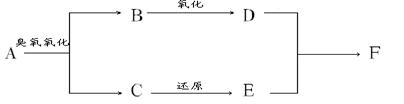
(1)试推断A、B、C、和F的结构简式:
A__________________ B___________________
C__________________ F___________________
(2)写出D和E 反应的化学方程式:_____________________________________。
六、(本题包括2小题,共18分)
25.为了测定一种气态烃A的化学式,取一定量的A置于一密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。学生甲、乙设计了两个方案,均认为根据自己的方案能求出A的最简式,他们测得的有关数据如下(图中的箭头表示气流的方向,实验前系统内的空气已排尽):
甲方案:燃烧产物![]() 增重2.52g
增重2.52g![]() 增重1.30g
增重1.30g![]() 生成CO21.76g
生成CO21.76g
乙方案:燃烧产物![]() 增重5.60g
增重5.60g![]() 增重0.64g
增重0.64g![]() 增重4g
增重4g
试回答:(1)______方案(填“甲”或“乙”)能求出A的最简式。
(2)若要确定A的分子式,是否需要测定其它数据?若需要,请给出合理数据加以求解;若不需要,请直接求解。(要有计算过程)
26.有一盐酸和硝酸的混合溶液,取出其中的10mL,加入足量的AgNO3溶液,过滤、洗涤、烘干,得到2.87g沉淀,滤液与2mol/LNaOH溶液反应,用去20mL碱液时恰好中和。
(1)求混合溶液中HCl和HNO3物质的量浓度。
(2) 另取10mL原混合酸溶液,加入0.64gCu粉共热,在标准状况下可收集到多少体积的NO气体?(反应过程中不考虑盐酸的挥发)
参考答案
一、(本题包括8小题,每小题4分,共32分)
1.C 2.D 3.B 4.C 5.C 6.A 7.C 8.A
二、(本题包括10小题)
9.D 10.BC 11.AD 12.A 13.A 14.BC 15.AD 16.AC 17.AC 18.BD
三、
19.(1)SOCl2+H2O===SO2+HCl
(2)取水解后的产物少量加入硝酸银溶液,若有白色沉淀生成,则正确
(3)SOCl2水解后产生HCl抑制锌离子的水解
20.(1)2CH3CHO+O2 → 2CH3COOH
(2)温度计
(3)乙二醇或甘油
(4)略
(5)略
四、
21.(1)NH4Cl 1 (2)小于
(3)NH3·H2O和NH4Cl NH4ClH和HCl
22.(1)略 (2)Mg C
(3)C+4HNO3===CO2+4NO2+2H2O
![]() (4)2NO2
N2O4
(4)2NO2
N2O4
五、(本题包括2小题,共18分)
23.(1)羟基 羧基
(2)CH3C18OOCH2CH3 CH3COOCH2CH3 1:1
OH
H2O
(3)CH3C(18OH)OCH2CH3
24.(1)CH2=CH(CH3)2 HCHO CH3COCH3 HCOOCH(CH3)2
(2)HCOOH +CH3CH(OH)CH3→HCOOCH(CH3)2+H2O
六、(本题包括2小题,共20分)
25.(1)甲 (2)不需要
分子式:CH4
26.(1)HCl 2mol/L HNO3 2mol/L
(2)0.15L