高三年级第六次考试化学试卷
本卷所需相对原子质量:H—1 O—16 N—14 Al—27 Fe—56
Zn—65 S—32 Na—23
一、选择题(每小题只有一个正确选项,3分×16=48分)
1、最新科技报导,美国夏威夷联合天文中心的科学家发现了新型氢微粒,这种微粒是由3个氢原子核(只含质子)和2个电子构成,对于这种微粒,下列说法中正确的是
A、是氢的一种新的同素异形体 B、是氢的一种新的同位素
C、它的组成可用![]() 表示
D、它比一个普通氢分子多一个氢原子核
表示
D、它比一个普通氢分子多一个氢原子核
2、已知HIO既能与酸反应又能和碱都发生中和反应,则它与盐酸反应的产物有
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
3、下列论述中,具有科学性的是
A、某蓄电池的总反应式为![]() ,则充电时,阳极上发生的反应为
,则充电时,阳极上发生的反应为![]()
B、用标准盐酸滴定未知浓度![]() 溶液,滴定前仰视读数,滴定后俯视读数,会使计算结果偏低
溶液,滴定前仰视读数,滴定后俯视读数,会使计算结果偏低
C、工业硫酸生产吸收![]() 时,
时,![]() 从吸收塔底部通入,水从塔顶喷下,剩余气体从塔上部放出
从吸收塔底部通入,水从塔顶喷下,剩余气体从塔上部放出
D、新型无机非金属材料虽然克服了传统无机材料的缺点,但强度比较差
4、回忆所学的知识,通过概括,综合作出判断,凡有味气体具有的其他性质中正确的是
A、溶于水 B、沸点较低 C、密度比空气大 D、有颜色
5、正常人胃液PH在0.3—1.2之间,酸(一般以盐酸表示)多了,需要治疗,某些用以治疗胃酸过多的药物中含![]() 、
、![]() ,还有酒石酸钠来治疗,这主要是由于
,还有酒石酸钠来治疗,这主要是由于
A、对人体而言酒石酸是营养品
B、![]() 、
、![]() 都是人体必需的元素
都是人体必需的元素
C、碳酸、酒石酸都不是强酸
D、![]() 、
、![]() 与胃酸作用生成
与胃酸作用生成![]() ,在服药后有喝汽水的舒服感
,在服药后有喝汽水的舒服感
6、将![]() 下列物质置于
下列物质置于![]() 水中充分搅拌后,溶液中阴离子数目最多的是
水中充分搅拌后,溶液中阴离子数目最多的是
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
7、在容积为672![]() 的烧瓶中充满
的烧瓶中充满![]() 、
、![]() 混合气体,将其倒立在水槽里并缓慢通入280
混合气体,将其倒立在水槽里并缓慢通入280![]()
![]() ,恰好完全反应,且烧瓶内充满液体,下列表达正确的是(均为标况下)
,恰好完全反应,且烧瓶内充满液体,下列表达正确的是(均为标况下)
A、总反应为![]()
B、总反应为![]()
C、生成![]() 的浓度约为
的浓度约为![]() D、生成
D、生成![]() 的物质的量约为
的物质的量约为![]()
8、下列各选项中所述的两个量,前者一定大于后者的是
A、![]() 中水的电离度
中水的电离度
B、将PH=4的![]() 分别稀释成PH=5的溶液所加水的量
分别稀释成PH=5的溶液所加水的量
C、物质的量浓度相同的![]() 溶液中
溶液中![]() 的浓度
的浓度
D、物质的量浓度相同的![]() 溶液的PH
溶液的PH
9、把![]() M和
M和![]() N混合于
N混合于![]() 的密闭容器中,发生反应
的密闭容器中,发生反应![]() ,5min后达平衡,容器内压强变小,已知Q的速率为
,5min后达平衡,容器内压强变小,已知Q的速率为![]() min,则下列说法错误的是
min,则下列说法错误的是
A、M的反应速率为![]() min B、平衡时N的转化率为20%
min B、平衡时N的转化率为20%
C、平衡时P的浓度为![]() D、平衡时容器内的压强为原来的0.8倍
D、平衡时容器内的压强为原来的0.8倍
10、在给定条件下,下列加点的物质在化学反应中能被完全消耗的是
A、用浓![]() 与
与![]() 共热制
共热制![]()
B、标况下,将![]() 铝片投入20
铝片投入20![]()
![]() 的
的![]() 中
中
C、向100![]()
![]() 的
的![]() 中加入
中加入![]()
D、在![]() 500℃和
500℃和![]() 触媒催化下,用
触媒催化下,用![]() 合成氨
合成氨
11、甲、乙两位同学各取相同的![]() 溶液
溶液![]() ,甲将溶液加热蒸发掉
,甲将溶液加热蒸发掉![]() 后冷却到20℃析出
后冷却到20℃析出![]() 晶体,乙将溶液蒸发掉
晶体,乙将溶液蒸发掉![]() 水后也冷却到20℃,析出
水后也冷却到20℃,析出![]() 晶体,则原
晶体,则原![]() 溶液的质量分数为
溶液的质量分数为
A、32% B、24.2% C、22.2% D、16.7%
12、等体积等物质的量浓度的![]() 、
、![]() 溶液分别放在甲、乙两烧杯中,各加等质量的
溶液分别放在甲、乙两烧杯中,各加等质量的![]() ,生成
,生成![]() 体积比为5:6,则甲、乙两烧杯中反应情况可能为
体积比为5:6,则甲、乙两烧杯中反应情况可能为
A、甲、乙中都是![]() 过量 B、甲中
过量 B、甲中![]() 过量,乙中碱过量
过量,乙中碱过量
C、甲中酸过量,乙中![]() 过量 D、甲中酸过量,乙中碱过量
过量 D、甲中酸过量,乙中碱过量
13、若PH=3的某酸溶液与PH=11的碱溶液等体积混合后溶液呈酸性,其原因可能为
A、生成了一种强碱弱酸盐 B、强酸与一元强碱反应
C、强酸与弱碱反应 D、浓的强酸与弱碱反应
14、现有![]()
![]() 、
、![]() 、
、![]() 三种全属粉末的混合物与一定质量的20%的
三种全属粉末的混合物与一定质量的20%的![]() 溶液恰好反应,得到溶液蒸干后称重为
溶液恰好反应,得到溶液蒸干后称重为![]() ,则生成的气体体积为(标况下)
,则生成的气体体积为(标况下)
A、![]() B、
B、![]() C、
C、![]() D、无法计算
D、无法计算
15、当盐酸与![]() 溶液PH、体积都相同时,下列叙述正确的是
溶液PH、体积都相同时,下列叙述正确的是
A、它们能中和等质量的![]() B、同等程度稀释时,PH变化相同
B、同等程度稀释时,PH变化相同
C、![]() 浓度与
浓度与![]() 浓度相同
浓度相同
D、它们与![]() 反应时,
反应时,![]() 反应产生
反应产生![]() 速率快且多
速率快且多
16、![]() 为短周期元素,
为短周期元素,![]() 的原子序数等于
的原子序数等于![]() 的原子序数之和,且
的原子序数之和,且![]() 离子比
离子比![]() 离子多三个电子层,下列推断不正确的是
离子多三个电子层,下列推断不正确的是
A、![]() 的原子半径大于
的原子半径大于![]() 的原子半径 B、
的原子半径 B、![]() 可能为金属元素
可能为金属元素
C、![]() 与
与![]() 不可能形成离子化合物
D、
不可能形成离子化合物
D、![]() 一定为非金属
一定为非金属
二、填空题(共44分)
 17、(6分)用铝箔包住金属钠,用针在铝箔上刺些小孔,
17、(6分)用铝箔包住金属钠,用针在铝箔上刺些小孔,
用镊子夹住放入水中:钠与水反应方程式为 ,
试管中收集到的气体是 。当钠块较大,而烧杯
中水较少时,实验过程中还可能发生另一个反应,
该反应的离子方程式为 。
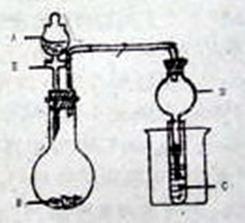
18、(18分)用右图所示装置进行实验,
将A逐滴加入B中:
(1)若A为浓![]() ,B为第三周期金属的
,B为第三周期金属的
片状单质,其在常温下难与水反应,C为
品红溶液,实验中观察到溶液褪色,则B
为 (写化学式),B与浓![]() 反
反
应化学方程式为 ,反应后
往烧杯中加入沸水,又可观察到C中
现象为 。
(2)若B为![]() ,C为
,C为![]() 溶液,
溶液,
实验中观察到小试管内溶液变浑浊,则
酸A应具有的性质是 。然后往烧杯中加入沸水,可观察到试管C中的现象是 。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好变澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁上有光亮的银镜,则A是 (写名称),C为 (化学式)与葡萄糖的混合液,仪器D的作用是 ,烧瓶中发生的反应化学方程式为 。
19、(14分)下列转化关系中,A——Z均为中学化学中常见物质,其中D为金属单质,B在常温常压下为液体,G为不溶于水但可溶于酸的白色固体,I为无色气体且能使湿润红色石蕊试纸变蓝,L为无色气体通空气变为红综色。
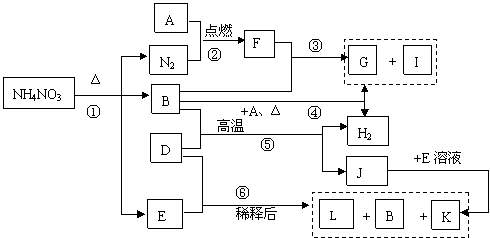 |
请回答:
(1)构成单质D的元素在周期表中处于 周期 族。
(2)I物质的电子式为 ,F物质化学式为 它们的晶体类型分别为
、 。
(3)写出下列反应的化学方程式③ ⑤ 。
(4)在反应⑤中如果有![]() J生成,则在反应中转移的电子为
J生成,则在反应中转移的电子为 ![]() 。
。
20、(6分)次磷酸![]() 是一种强还原剂,将它加入
是一种强还原剂,将它加入![]() 溶液中,加热到
溶液中,加热到
40℃——50℃,析出一种红棕色的难溶物A,经鉴定,反应后的溶液是磷酸和硫酸的混合物,![]() 射线衍射证实A是一种六方晶体,其中含两种元素,结构类似于纤维锌矿(
射线衍射证实A是一种六方晶体,其中含两种元素,结构类似于纤维锌矿(![]() ),组成稳定,A的主要性质如下:
),组成稳定,A的主要性质如下:
①温度超过60℃,分解成金属Cu和一种气体
②在![]() 中能够燃烧
中能够燃烧
③与盐酸反应放出气体
则(1)A的化学式为
(2)A与![]() 反应的化学方程式为
反应的化学方程式为
(3)A与盐酸反应生成的气体化学式为 。
三、计算题(8分)
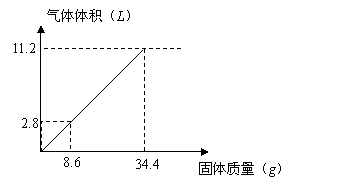 21、在100
21、在100![]() 溶液中加入
溶液中加入![]() 混合固体,加热后充分反应,下图表示加入固体质量与产生气体体积(标况下)关系:
混合固体,加热后充分反应,下图表示加入固体质量与产生气体体积(标况下)关系:
试计算:
(1)![]() 溶液的物质的量浓度。(3分)
溶液的物质的量浓度。(3分)
(2)若![]() 溶液为
溶液为![]() ,固体为
,固体为![]() 时充分反应时产生气体的体积(标况)(3分)
时充分反应时产生气体的体积(标况)(3分)
(3)若![]() 溶液为
溶液为![]() ,固体仍为
,固体仍为![]() 时充分反应时产生气体的体积(标况)(2分)
时充分反应时产生气体的体积(标况)(2分)
 高三年级第六次考试化学答卷
高三年级第六次考试化学答卷
一、选择题(16×3分=48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | B | B | C | C | B | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | C | C | B | A | C | C | B |
二、填空题(44分)
17、(6分) 2Na+2H2O==2NaOH+H2↑ 、
H2 、 2Al+2OH-+2H2O==2AlO2-+3H2↑
18、(18分)
(1) Mg 、 Mg+2H2SO4==MgSO4+SO2↑+2H2O 、
溶液变红
(2) 酸性比H2CO3强 、 溶液变澄清,后变浑浊
(3) 浓氨水 、 AgNO3 、 防倒吸 、
CaO+NH3·H2O==Ca(OH)2+NH3↑
19、(14分)
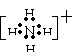 (1) 四 、 Ⅷ
(1) 四 、 Ⅷ
(2) 、 Mg3N2 、 分子 、 离子
(3)③ Mg3N2+6H2O==3Mg(OH)2↓+2NH3↑
⑤ 3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
(4) 16
20、(6分)
(1) CuH (2) 2CuH+3Cl2==2CuCl2+2HCl
(3) H2
三、计算题(8分)
21、⑴ NH4+ ~ OH- ~ NH3↑
0.5 0.5
∴c(NaOH)===5mol·L-1
⑵n(NH3)==0.125mol
![]()
![]() 80x+132y=8.6 x=0.025mol
∴=
80x+132y=8.6 x=0.025mol
∴=
x+2y=0.125 y=0.05mol
设51.6g有 amol NH4NO3,2amol (NH4)2SO4
80a+132×2a=51.6 a=0.15mol
共n(NH4+)=0.15+0.15×2×2=0.75mol
而n(NaOH)=0.14×5=0.7mol ∴NaOH不足
V(NH3)==0.7×22.4=15.68L
⑶n(NaOH)=0.18×5=0.9mol>0.75mol ∴ NH4+不足
∴V(NH3)=0.75×22.4=16.8L