高三全国模拟试卷化学卷2
可能用到的原子量:H 1 N 14 O 16 Na 23 Al 27 Cl 35.5 Fe 56 Cu 64
第Ⅰ卷 (选择题,共44分)
一、选择题(本题包括10小题,每小题2分,共20分。每小题只有1个选项符合题意)
1.化学反应中的能量变化,通常表现为热量的变化,如Ba(OH)![]() ·8H
·8H![]() 0与NH
0与NH![]() Cl的反应要吸收热量,在化学上叫做吸热反应。其原因是 ( )
Cl的反应要吸收热量,在化学上叫做吸热反应。其原因是 ( )
A.反应物所具有的总能量高于生成物所具有的总能量
B.反应物所具有的总能量低于生成物所具有的总能量
C.在化学反应中需要加热的反应就是吸热反应
D.在化学反应中需要降温的反应就是放热反应
2.哥伦比亚号航天飞机曾用金属铝粉和高氯酸铵(NH![]() C10
C10![]() )的混合物作固体燃料。在该固体燃料中,铝元素、氮元素及氯元素的化合价分别是 ( )
)的混合物作固体燃料。在该固体燃料中,铝元素、氮元素及氯元素的化合价分别是 ( )
A.+3、-3、+7 B.0、-3、+7 C.+3、+3、+5 D.O、+1、-1
3.下列物质的水溶液中,其pH小于7的是 ( )
A.Na![]() C0
C0![]() B.NHdN03 C.Na
B.NHdN03 C.Na![]() S0
S0![]() D.KN0
D.KN0![]()
4.在无色透明的强酸性溶液中,能大量共存的离子组是 ( )
A.NH![]() Na
Na![]() Cl
Cl![]() SO
SO![]() B.Cu
B.Cu![]() Mg
Mg![]() N0
N0![]() Cl
Cl![]()
C.A1![]() Ag
Ag![]() NO
NO![]() C1
C1![]() D.Ba
D.Ba![]() K
K![]() C0
C0![]() Cl
Cl![]()
5.N![]() 代表阿伏伽德罗常数的数值,下列说法正确的是 ( )
代表阿伏伽德罗常数的数值,下列说法正确的是 ( )
A.常温常压下11.2 L N![]() 含有的原子数为N
含有的原子数为N![]()
B.常温常压下l mol He含有的原子数为N![]()
C.71 g C1![]() 含有的原子数为N
含有的原子数为N![]()
D.18 g NH![]() ;含有的电子数为N
;含有的电子数为N![]()
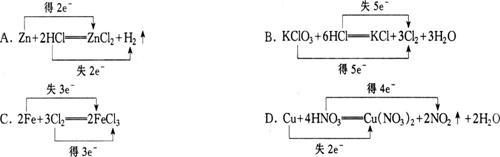
6.下列标明电子转移的方向和数目的化学方程式中正确的是 ( )
7.在一定条件下,反应A(g)+3B(g) ![]() 2C(g)达到平衡状态的标志是 ( )
2C(g)达到平衡状态的标志是 ( )
A.单位时间内生成C的物质的量与消耗C的物质的量相等
B.单位时间内生成a mol A的同时,生成3a mol B
C.A、B、C分子数之比为1︰3︰2
D.C的体积分数比A、B的大
8.欲配制2.0 mol/L NaCl溶液100 mL,下列操作方法中正确的是 ( )
A.称取5.85 g NaCl,使其溶于50 mL水中
B.称取11.7 g NaCl,使其溶于100 mL水中
C.称取11.7 g NaCl,溶于适量水后,再加水稀释到100 mL
D.称取11.7 g NaCl,溶于88.3 mL水中
9.下列离子方程式中,正确的是 ( )
A.醋酸与小苏打溶液反应H![]() +HCO
+HCO![]()
![]() C0
C0![]() ↑+H
↑+H![]() 0
0
B.碳酸钠水解 C0![]() +2H
+2H![]() 0
0![]() H
H![]() C0
C0![]() +20H
+20H![]()
C.铁与三氯化铁溶液反应 Fe+Fe![]()
![]() 2Fe
2Fe![]()
D.铝与氢氧化钠溶液反应2Al+20H![]() +2H
+2H![]() 0
0![]() 2A10
2A10![]() +3H
+3H![]() ↑
↑
10.下列各对物质中,互为同系物的是 ( )
A.CH![]() 一CH
一CH![]() 和CH
和CH![]() 一CH=CH
一CH=CH![]()
B.CH![]() =CH—CH
=CH—CH![]() 和CH
和CH![]() 一CH=CH
一CH=CH![]()
C.CH![]() —CH—CH
—CH—CH![]() 和CH
和CH![]() 一CH
一CH![]() CH=CH
CH=CH![]()
D.CH![]() —CH
—CH![]() CH
CH![]() 一CH
一CH![]() 和CH
和CH![]() 一CH(CH
一CH(CH![]() )一CH
)一CH![]()
二、选择题(本题包括8小题,每小题3分,共24分。每小题只有1个选项符合题意)
11.将40 mL 1.5 mol·L![]() 的CuS0
的CuS0![]() 溶液与30 mL 3 mol·L
溶液与30 mL 3 mol·L![]() 的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中CU
的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中CU![]() 或OH
或OH![]() 浓度都已变得很小,可忽略,则生成沉淀的组成可表示为 ( )
浓度都已变得很小,可忽略,则生成沉淀的组成可表示为 ( )
A.Cu(OH)![]() B.CuS0
B.CuS0![]() ·Cu(OH)
·Cu(OH)![]() C.CuS0
C.CuS0![]() ·2Cu(OH)
·2Cu(OH)![]() D.CuS0
D.CuS0![]() ·3Cu(OH)
·3Cu(OH)![]()
12.下列关于石油加工的叙述中,不正确的是 ( )
A.石油分馏所得的馏分是一种纯净物
B.石油裂化的主要目的是提高汽油等轻质油的产量
C.石油裂解的原料是石油分馏产物,包括石油气
D.煤的气化和液化是把煤转化为清洁燃料的有效途径
13.下列关于苯的说法中,正确的是 ( )
A.苯的分子式是C![]() H
H![]() ,不能使高锰酸钾酸性溶液褪色,所以属于饱和烃
,不能使高锰酸钾酸性溶液褪色,所以属于饱和烃
![]()
B.从苯的凯库勒式看,分子中含有双键,所以属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的键完全相同
14.“喷水溶液法”是一种使沙漠变绿洲的新技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土粒子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水的作用。下列对聚丙烯酸酯![]() 不正确的说法是 ( )
不正确的说法是 ( )
A.是由CH![]() 一CH=COOR聚合而成的 B.是一种分子量很大的有机物
一CH=COOR聚合而成的 B.是一种分子量很大的有机物
C.在一定的条件下能发生水解 D.含有n个![]() 双键
双键
15.维生素A对人体特别是对人的视力有重要作用,其结构简式如下:
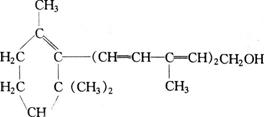
下列关于该化合物的说法中,正确的是 ( )
①维生素A是一种不饱和的一元醇 ②维生素A含有苯环结构
③维生素A的分子中含有两种官能团 ④维生素A的一个分子中含有3个双键
A.②④ B.①③ C.③④ D.全部正确
16.下列操作中错误的是
A.除去乙酸乙酯中的少量乙酸:加人乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯
B.除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层
C.除去C0![]() 中的少量S0
中的少量S0![]() :通过盛有饱和NaHC0
:通过盛有饱和NaHC0![]() 溶液的洗气瓶
溶液的洗气瓶
D.除去FeCl![]() 溶液中少量的FeCl
溶液中少量的FeCl![]() :加入Fe粉,过滤
:加入Fe粉,过滤
17.如下图,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强大小关系正确的是 ( )
| 编号 | ① | ② | ③ | ④ |
| A中气体 | C | H | NH | NO |
| B中气体 | 0 | C1 | HCl | 0 |
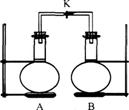
A.②<③=①<④ B.③<①<④<② C.③<④<②=① D.④<①=②=③
18.如果a g某气体中含有的分子数为6,则c g该气体在标准状况下的体积是(NA为阿伏伽德罗常数)
A.![]() L B.
L B.![]() L C.
L C.![]() L D.
L D.![]() L
L
第Ⅱ卷 (非选择题,共56分)
三、填空题(本题包括6小题,共48分)
19.(8分)某化学课外小组的同学们组装了下列仪器和装置,欲经过简单连接,制备中学化学常见的4种不同的气体(暂不考虑尾气的吸收)。请用化学反应方程式表示其制气原理:
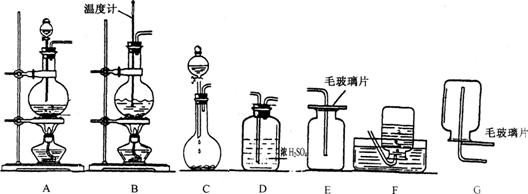
(1)甲同学用橡胶管连接了装置“A→D→E”,请用化学方程式表示这一连接装置可能制备的一种气体 ;
(2)乙同学用橡胶管连接了装置“B→F”,请用化学方程式表示这一连接装置可能制备的一种气体
(3)丙同学用橡胶管连接了装置“C→D→E'’,请用化学方程式表示这一连接装置可能制备的一种气体
(4)丁同学用橡胶管连接了装置“C→D→G'’,请用化学方程式表示这一连接装置可能制备的一种气体 。
20.(6分)已知反应:
①S0![]() +H
+H![]() 0
0![]() H
H![]() SO
SO![]() ② C1
② C1![]() +H
+H![]() 0
0![]() HCI+HCl0
HCI+HCl0
③2F![]() +2H
+2H![]() 0
0![]() 4HF+0
4HF+0![]() ↑
④2Na+2H
↑
④2Na+2H![]() 0
0![]() 2NaOH+H
2NaOH+H![]() ↑
↑
⑤2Na![]() 0
0![]() +2H
+2H![]() O
O![]() 4NaOH+0
4NaOH+0![]() ↑ ⑥Si0
↑ ⑥Si0![]() +2NaOH
+2NaOH![]() Na
Na![]() Si0
Si0![]() +H
+H![]() 0
0
(1)上述反直中不属于氧化还原反应的有 (填序号,下同)。H![]() 0被氧化的是 、H
0被氧化的是 、H![]() 0被还夏的是 。属于氧化还原反应,但其中的H
0被还夏的是 。属于氧化还原反应,但其中的H![]() 0既不被氧化,又不被还原的是 。
0既不被氧化,又不被还原的是 。
(2)写出方程式②的离子方程式 。
(3)标出方程式④的电子转移的方向和数目 。
21.(10分、在探索生命奥秘的过程中,科学家们日益认识到生命细胞的组成和元素周期律有密切的关系,约占人体总质量99.97%的11种宏量元素,全部位于周期表前20号元素之内,其余0.03%是由十多种人体不可缺少的微量元素组成。在微量元素中只有F和Si位于短周期,其余均属于第一长周期。在现用的周期表中,针对除H、N、P外的宏量元素填空:
(1)原子最外层电子数是最内层电子数2倍的元素是 (填元素符号,下同)。
(2)能显示最高化合价的元素是 ,跟它处在同一周期的、单质显非金属性的元素是 。
(3)原子半径最大的元素是 ,它的相邻元素是 和 。
(4)剩余的两种宏量元素,它们的离子电子层结构相同,且带电量也相同,但符号相反。它们是 和 。
(5)NH3的电子式为 ,其空间构型为 。
22.(9分)
(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片,可观察到铜片上 (填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(如图(a)所示),可观察到铜片上 (填“有”或“没有”)气泡产生。
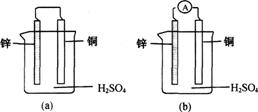
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连接(如图(b)所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。请用反应式来表示在导线中有电流通过的原因:
锌片上的反应式: ;铜片上的反应式: 。
可见,图(b)是一个将化学能转化为电能的装置,人们把它叫做原电池。那么,一个正在工作着的原电池的形成条件是: 。
23.(8分)从电石开始,可以发生如下图所示的一系列变化:
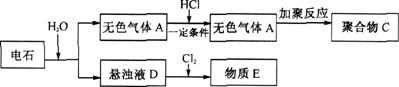
(1)写出电石与水反应的化学方程式:
。
(2)写出聚合物C的结构简式 。
(3)“D→E”是工业上生产漂粉精的主要原理。请写出这一过程的反应方程式:
。
(4)物质E在空气中放置,其主要成分会逐渐失效。请用化学方程式表示这一过程:
。
24.(7分)在某些酶的催化下,人体内葡萄糖的代谢有如下过程:
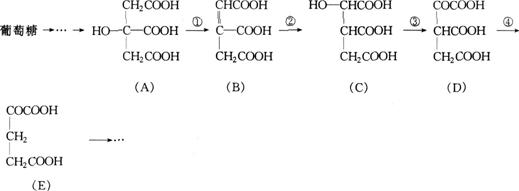
请填空:
(1)反应①的反应类型是 ,反应②的反应类型是 ,反应③的反应类型是 。
(2)反应④的另一种生成物是人体的一种最终代谢产物,其化学式为 。
(3)上述物质中 和 互为同分异构体(填字母)。
(4)新制的铜试剂[Cu(OH)![]() ]与葡萄糖反应会生成红色沉淀,因此可用该试剂检验糖尿病人尿液中葡萄糖的含量。如果将葡萄糖的结构简式CH
]与葡萄糖反应会生成红色沉淀,因此可用该试剂检验糖尿病人尿液中葡萄糖的含量。如果将葡萄糖的结构简式CH![]() 0H—(CHOH)
0H—(CHOH)![]() —CHO简化为GCHO。试写出GCHO与Cu(OH)
—CHO简化为GCHO。试写出GCHO与Cu(OH)![]() 反应的化学方程式:
反应的化学方程式:
四、计算题(本题包括1小题.共8分)
25.(8分)将等物质的量的Al![]() 0
0![]() 和Fe
和Fe![]() O
O![]() 溶于100 mL盐酸中,而后逐渐滴加1 mol/L的Na0H溶液,当加入的NaOH 的体积V
溶于100 mL盐酸中,而后逐渐滴加1 mol/L的Na0H溶液,当加入的NaOH 的体积V![]() =50 mL时,开始有沉淀析出,且沉淀量随NaOH的加入而逐渐增加;当Na0H的体积V
=50 mL时,开始有沉淀析出,且沉淀量随NaOH的加入而逐渐增加;当Na0H的体积V![]() =650 mL时,沉淀量达最大值;继续滴加Na0H时,沉淀量逐渐减少;当V
=650 mL时,沉淀量达最大值;继续滴加Na0H时,沉淀量逐渐减少;当V![]() ≥750 mL时,沉淀量不再改变。
≥750 mL时,沉淀量不再改变。
(1)最初加入的50 mL Na0H溶液的作用是 。
(2)计算所用盐酸的浓度。
(3)计算 0j和Fe2()3的物质的量。