高三全国模拟试卷化学卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分。考试时间120分钟。
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 A1 27 S 32
CI 35.5 K 39 Fe 56 Cu 64 As 75 I 127 Ba 137
第Ⅰ卷 (选择题,共74分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.下列关于某些社会热点问题的说法中,不正确的是 ( )
A.禁止使用含铅汽油是为了提高汽油的燃烧效率
B.甲醇超标的酒不能饮用
C.甲醛是某些劣质装饰板材释放的常见污染物之一
D.臭氧在高空对人类有保护作用
2.下列气体不能用碱石灰干燥的是 ( )
A.0![]() B.N0
B.N0![]() C.NH
C.NH![]() D.C
D.C![]() H
H![]()
3.下列关于胶体性质的叙述中,错误的是 ( )
A.胶体有丁达尔现象 B.胶体有布朗运动
C.胶体有电泳现象 D.胶体能透过半透膜
4.下列关于只含非金属元素的化合物的说法中,正确的是 ( )
A.一定是共价化合物 B.其晶体不可能是离子晶体
C.其晶体不可能是原子晶体 D.有可能是离子化合物
5.完全溶解28.4 g碳酸铜和氢氧化铜的混合物需要消耗1 mol·L![]() 的盐酸500 mL。若灼烧相同质量的上述混合物,能得到氧化铜的质量为 ( )
的盐酸500 mL。若灼烧相同质量的上述混合物,能得到氧化铜的质量为 ( )
A.40 g B.30 g C.20 g D.16 g
6.用石墨电极电解含有相同物质的量的Na![]() S0
S0![]() 和CuS0
和CuS0![]() 的溶液一段时间后,溶液显浅蓝色,此时若要使溶液中的Na2S04和CuS0
的溶液一段时间后,溶液显浅蓝色,此时若要使溶液中的Na2S04和CuS0![]() 都恢复到电解前的浓度,应向其中加入适量的 ( )
都恢复到电解前的浓度,应向其中加入适量的 ( )
A.Na![]() S04和CuS0
S04和CuS0![]() B.CuO C.Na
B.CuO C.Na![]() 0和CuO D.H
0和CuO D.H![]() 0和CuS0
0和CuS0![]()
7.把铝粉和氧化亚铁粉配成铝热剂,分成两等份,一份在高温下恰好完全反应后,再与足量盐酸反应,另一份直接放入足量的烧碱溶液中充分反应;前后两种情况下生成的气体质量比是 ( )
A.3︰2 B.2︰3 C.1︰1 D.28︰9
8.某有机物甲经氧化得乙(![]() ),而甲在NaOH水溶液中加热反应可得丙。1 mol丙和2 mol 反应得一种含氯的酯(
),而甲在NaOH水溶液中加热反应可得丙。1 mol丙和2 mol 反应得一种含氯的酯(![]() )。由此可推断甲的结构简式为 ( )
)。由此可推断甲的结构简式为 ( )

二、选择题(本题包括10小题,每小题5分,共50分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分。但只要选错一个,该小题就为0分)
9.将50 mL O.1 mol·L![]() 的MgCl2溶液与50mL
O.2 mol·L
的MgCl2溶液与50mL
O.2 mol·L![]() 的NaHC0
的NaHC0![]() 溶液混合后,加热煮沸一段时间(不断地补充蒸发的水),产生的白色沉淀的是 ( )
溶液混合后,加热煮沸一段时间(不断地补充蒸发的水),产生的白色沉淀的是 ( )
A.Mg(HC0![]() )
)![]() B.MgC0
B.MgC0![]() C.MgCl
C.MgCl![]() 和MgC0
和MgC0![]() D.Mg(OH)
D.Mg(OH)![]() 和MgC0
和MgC0![]()
10.下列说法中,正确的是 ( )
A.室温下,CH![]() COOH分子不可能存在于pH>7的碱性溶液中
COOH分子不可能存在于pH>7的碱性溶液中
B.在[OH![]() ]=[H
]=[H![]() ]的溶液中,A10
]的溶液中,A10![]() 不可能大量存在
不可能大量存在
C.在NaAl0![]() 溶液中,HCO
溶液中,HCO![]() 不可能大量存在
不可能大量存在
D.在水溶液中石炭酸比碳酸容易电离
11.下列事实中,能说明氯的非金属性比硫强的是 ( )
A.高氯酸(HCIO![]() )的酸性比硫酸强 B.次氯酸的氧化性比稀硫酸强
)的酸性比硫酸强 B.次氯酸的氧化性比稀硫酸强
C.氯化氢比硫化氢的热稳定性好 D.氯原子最外层电子数比硫原子最外层电子数多
12.下列书写的离子方程式中,正确的是 ( )
A.向次氯酸钙溶液中通人少量二氧化硫 Ca![]() ++2C1O
++2C1O![]() +S0
+S0![]() +H
+H![]() 0
0![]() CaS0
CaS0![]() ↓+2HCIO
↓+2HCIO
B.向氨水中通人少量二氧化碳 2NH![]() ·H
·H![]() 0+CO
0+CO![]()
![]() 2NH
2NH![]() +CO
+CO![]() +H
+H![]() 0
0
C.向硫酸铁的酸性溶液中通入硫化氢 2Fe![]() +S
+S![]()
![]() 2Fe
2Fe![]() +S↓
+S↓
D.向硫酸铝溶液中加入小苏打 A1![]() +3HCO
+3HCO![]()
![]() 3C0
3C0![]() ↑+Al(OH)
↑+Al(OH)![]() ↓
↓
13.已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,则下列推断中,不正确的是 ( )
A.D位于第2周期 B.A、D可能属同一族
C.A、B、E一定位于不同周期 D.C和D的单质有可能化合形成离子化合物
14.已知反应BeCl![]() +Na
+Na![]() Be0
Be0![]() +2H
+2H![]() 0
0![]() 2NaCl+2Be(OH)
2NaCl+2Be(OH)![]() ↓能完全进行,则下列推断中,正确的是 ( )
↓能完全进行,则下列推断中,正确的是 ( )
A.BeCl![]() 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B.Na![]() Be0
Be0![]() 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C.Be(OH)![]() 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液
D.BeCl![]() 水溶液的导电性强,因此BeCl
水溶液的导电性强,因此BeCl![]() 一定是离子化合物
一定是离子化合物
15.向100mL NaOH溶液中通人标准状况下的C0![]() 1.12 L后,将溶液小心蒸干得到不含结晶水的固体5.08g,则下列说法中,正确的是 ( )
1.12 L后,将溶液小心蒸干得到不含结晶水的固体5.08g,则下列说法中,正确的是 ( )
A.原NaOH溶液的浓度是1.00 mol·L![]() ,所得固体是Na
,所得固体是Na![]() C0
C0![]()
B.原NaOH溶液的浓度是O.500 mol·L![]() ,所得固体是Na
,所得固体是Na![]() C0
C0![]() 和NaHC0
和NaHC0![]()
C.原NaOH溶液的浓度是1.00 mol·L![]() ,所得固体是NaOH和Na
,所得固体是NaOH和Na![]() C0
C0![]()
D.原NaOH溶液的浓度是0.900 mol·L![]() ,所得固体是Na
,所得固体是Na![]() C0
C0![]() 和NaHC0
和NaHC0![]()
16.在一定条件下,向密闭容器中按3︰2的体积比充入CO和水蒸气使其反应,当CO+H![]() 0(气)
0(气) ![]() C0
C0![]() +H
+H![]() 达到平衡时,水蒸气与H
达到平衡时,水蒸气与H![]() 的体积分数相等,则下列叙述中,错误的是 ( )
的体积分数相等,则下列叙述中,错误的是 ( )
A.平衡时CO的体积分数为40% B.平衡时CO的转化率为25%
C.平衡时水的转化率为50% D.平衡时混合气体的平均相对分子质量为24
17.同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH![]() ,②NO
,②NO![]() 进行喷泉实验,经充分反应后,瓶内的溶液中溶质的物质的量浓度为 ( )
进行喷泉实验,经充分反应后,瓶内的溶液中溶质的物质的量浓度为 ( )
A.①>② B.①<② C.①=② D.不能确定
18.对反应14CuS0![]() +5FeS
+5FeS![]() +12H
+12H![]() 0 7Cu
0 7Cu![]() S+5FeS0
S+5FeS0![]() +12H
+12H![]() S0
S0![]() ,下列结论正确的是 ( )
,下列结论正确的是 ( )
A.只有CuS0![]() 作氧化剂 B.FeS
作氧化剂 B.FeS![]() 既是氧化剂又是还原剂
既是氧化剂又是还原剂
C.被氧化的硫和被还原的硫的质量之比为3︰7 D.1 mol CuS0![]() 可以氧化5/7 mol硫元素
可以氧化5/7 mol硫元素
第Ⅱ卷 (非选择题,共76分)
三、(本题共2小题,21分)
19.(8分)实验室用下图所示装置进行苯与溴反应的实验。
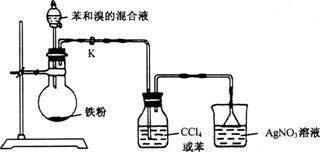
请回答下列问题:
(1)若装置中缺洗气瓶,则烧杯中产生的现象无法说明苯与溴的反应是取代反应,理由是____________ 。
(2)反应后得到的粗溴苯中溶有少量的苯、溴、三溴苯、溴化铁和溴化氢,可通过以下操作除去: ①水洗; ②碱洗; ③水洗; ④干燥; ⑤……。
其中,操作②碱洗的目的是 完成操作④干燥后,接下来的操作⑤是 (填操作名称)。
(3)如果省略(2)中的操作①,一开始就进行碱洗,会对后面的操作造成什么影响?(简要说明理由)____________________________________ 。
20.(13分)已知FeS0![]() 在高温下分解生成Fe
在高温下分解生成Fe![]() O
O![]() 、S0
、S0![]() 和SO
和SO![]() 。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeS0
。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeS0![]() 的质量。
的质量。
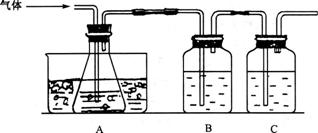
请回答下列问题:
(1)实验时,A瓶内盛水,水中滴有数滴 溶液,B瓶内盛品红试液,C瓶内盛NaOH溶液,NaOH溶液的作用是________________________________________________。
(2)A瓶内所盛试剂的作用是___________ __,A瓶要用冰水冷却的原因是_________________________________________________________________。
(3)检验后,用A瓶内的混合物测定FeS0![]() 已分解的质量,其实验操作的第一步是(简述操作步骤)____________________________________________________________。
已分解的质量,其实验操作的第一步是(简述操作步骤)____________________________________________________________。
(4)测定过程中,在过滤器上将沉淀洗净后,将沉淀灼烧并冷却至室温,称量其质量为a![]() g,再次灼烧冷却至室温称量其质量为a
g,再次灼烧冷却至室温称量其质量为a![]() g,且a
g,且a![]() <a
<a![]() ,接下来的操作应当是_____________________________________________________________
。
,接下来的操作应当是_____________________________________________________________
。
(5)已经分解的FeS0![]() 的质量是___________
_(填计算式)。
的质量是___________
_(填计算式)。
四、(本题共2小题,20分)
21.(10分)某温度(t℃)时,测得0.0l mol·L![]() 的NaOH溶液的pH为11,则该温度下水的K
的NaOH溶液的pH为11,则该温度下水的K![]() =
。在此温度下,将pH=a的NaOH溶液V
=
。在此温度下,将pH=a的NaOH溶液V![]() L与pH=b的H
L与pH=b的H![]() S0
S0![]() 溶液V
溶液V![]() L混合。
L混合。
(1)若所得混合液为中性,且a=12,b=2,则V![]() ︰V
︰V![]() =
;
=
;
(2)若所得混合液为中性,且a+b=12, 则V![]() ︰V
︰V![]() =
;
=
;
(3)若所得混合液的pH=10,且a=12,b=2,则V![]() ︰V
︰V![]() =
。
=
。
22.(10分)铁、铝、碳三种单质的混台物,在适当条件下可以按下面的示意图进行反应。已知图中的各字母分别代表纯净物或混台物。G、H、K、L在室温下都是气体,E是红褐色固体,P是白色固体。
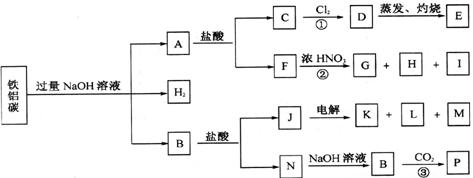
请回答:
(1)E的化学式是______________,M的化学式是_________________________。
(2)反应①的离子方程式是_________________________ 。
(2)反应②的化学方程式是__________________________ 。
(3)反应③的离子方程式是___________________________ 。
五、(本题共2小题,16分)
23.(8分)百合醛![]() 是一种香料,可由异丁基苯经一系列的反应得到,其合成路线如下:
是一种香料,可由异丁基苯经一系列的反应得到,其合成路线如下:
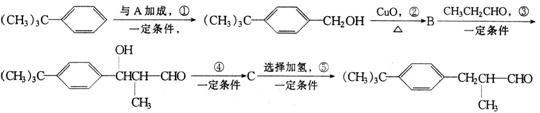
请回答:
(1)写出A和B的结构简式:A_________ ,B_______ _。
(2)反应④的反应类型是 (填有机化学反应类型名称),其化学方程式是:
_____________________________________ _。
24.(8分)某有机物A含C 54.8%,H 5.58%,N 7.11%,其余含0,A的相对分子质量不超过300。A是a-氨基酸,分子中不存在甲基(一CH![]() ),能与FeCl
),能与FeCl![]() 溶液发生显色反应,1 mol A最多能与3 mol NaOH完全反应。
溶液发生显色反应,1 mol A最多能与3 mol NaOH完全反应。
请回答:
(1)有机物A的相对分子质量为________,其分子式为_________。
(2)符合上述条件的有机物A的可能结构有________(填数字)种,写出其中的任一种的结构简式__________
六、(本题共2小题,19分)
25.(7分)将一定量的氧化铜加入到100.0 g质量分数为19.6%的硫酸溶液中,完全溶解后溶液显蓝色,再加入19.6g铁粉充分反应后,经过滤干燥得到的固体仍为19.6g。
(1)通过计算说明干燥后的固体是什么物质?
(2)求原氧化铜的质量。
26.(12分)去年,我国南方某省发生了一起严重的“12·11”砒霜泄漏事件。砒霜是三氧化二砷(As![]() 0
0![]() )的俗名,剧毒。有关方面采用石灰中和等措施,使被污染的河水含砷量降低到国家允许的标准内,消除了这一事件所造成的危害。
)的俗名,剧毒。有关方面采用石灰中和等措施,使被污染的河水含砷量降低到国家允许的标准内,消除了这一事件所造成的危害。
测定砷是利用下述反应: AsO![]() +I
+I![]() +H
+H![]() 0
0![]() AsO
AsO![]() +2I
+2I![]() +2H
+2H![]()
这反应是可逆的,控制溶液的酸碱性,可以测定不同价态(+3或+5)的砷。
今有一试样,含As![]() 0
0![]() 与As
与As![]() 0
0![]() 及其他对测定没有影响的杂质。将此试样用NaOH溶液溶解后,在中性溶液中用0.025 00 mol·L
及其他对测定没有影响的杂质。将此试样用NaOH溶液溶解后,在中性溶液中用0.025 00 mol·L![]() 的I
的I![]() -KI溶液滴定.用去20.00 mL。测定完毕后,使溶液呈酸性,加入过量的KI。由此析出的碘又用0.150 0 mol·L
-KI溶液滴定.用去20.00 mL。测定完毕后,使溶液呈酸性,加入过量的KI。由此析出的碘又用0.150 0 mol·L![]() 的Na
的Na![]() S
S![]() 0
0![]() 溶液滴定,用去30.00 mL。试计算试样中As
溶液滴定,用去30.00 mL。试计算试样中As![]() 0
0![]() 和As
和As![]() 0
0![]() 的质量。(已知2Na
的质量。(已知2Na![]() S
S![]() 0
0![]() +I
+I![]()
![]() Na
Na![]() S
S![]() 0
0![]() +2NaI)
+2NaI)