高三化学第二学期质检试题
一、选择题(每题只有一个选项符合题意)
1、通常听说的“白色污染”是指( )
A.冶炼厂的白色烟尘 B.石灰窑的白色粉尘
C.聚乙烯等白色塑料垃圾 D.白色建筑废料
2、“纳米材料”(1nm=10-9m)是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。“纳米材料”是指研究开发直径为几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,对于所得分散系的叙述正确的是 ( )
①所得物质一定是溶液 ②能全部透过半透膜 ③有丁达尔现象 ④所得液体可以全部透过滤纸
A、①② B、②③ C、 ③④ D、①④
3、最近,科学家在实验室成功地在高压下将CO2转化为类似Si02的原子晶体结构,下列关于CO2晶体的叙述中不正确的是 ( )
A.晶体中C、O原子个数比为1:2
B.该晶体的熔点、沸点高,硬度大
C.晶体中C--O--C键角为180。
D.晶体中C、O原子最外层都满足8电子结构
4、2001年9月北京世界大学生运动会结束时,数万只小气球腾空而起,若从安全角度考虑,气球中不应充H2,而适宜用下列气体中的( )
A.Ne B.He C.CH4 D.空气
5、下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个离子方程式表示的是( )
A、稀盐酸,Na2CO3溶液 B、Cu,FeCl3溶液
C、稀H2SO4溶液,NaAlO2溶液 D、铁与稀硝酸溶液
6、X、Y为短周期元素,X原子所具有的电子层数是最外层电子数的![]() ,Y原子次外层电子数是最外层电子数的
,Y原子次外层电子数是最外层电子数的![]() ,X与Y能形成多种原子团,其中一定不存在的是( )
,X与Y能形成多种原子团,其中一定不存在的是( )
A.X2Y![]() B.XY
B.XY![]() C.XY
C.XY![]() D.X2Y
D.X2Y![]()
7、下列分子中所有原子都满足最外层为8电子结构的是(
)。
A.次氯酸 B.四氯化碳 C.二氟化氙 D.三氟化硼
8、一定量的质量分数为6%的NaOH溶液(密度为d1g·cm-3),物质的量浓度为a mol·L-1,加热溶液使其质量分数的和为30%(密度为d2g·cm-3),此时溶液的浓度为b mol·L-1,则a与b的关系是 ( )
A. b=5a B.b>5a C.b<5a D.无法判断
9、欲使100 mL纯水的pH由7变为4,所需0.1 mol/ L的盐酸溶液的体积(mL)约为( )
A.10.0 B.1.0 C.0.1 D.0.05
10、在体积aL的密闭容器中,放入2LA气体和1LB气体,在一定条件下发生反应:3A(气)+B(气)![]() nC(气)+2D(气),反应达平衡后,A的浓度减少到原来的1/2,混合气体的平均相对分子质量增大了1/8倍,则反应式中的n值为()
nC(气)+2D(气),反应达平衡后,A的浓度减少到原来的1/2,混合气体的平均相对分子质量增大了1/8倍,则反应式中的n值为()
A、1 B、2 C、3 D、4
11、在一定条件下CO和CH4燃烧的热化学反应方程式为:
2CO(g)+O2(g)=2CO2(g);△H= —566 kJ/mol;
CH4(g)+2O2(g)→CO2(g)+2H2O(l) ;△H= —890 kJ/mol
由1mol CO和3mol CH4组成的混合气体在上述条件下完全燃烧后,释放出的热量 ( )kJ
A. 2912 B.2953 C. 3236 D. 3827
12、金属X的原子量是金属Y的2/3倍,等质量的X和Y在相同条件下跟过量的稀硫酸反应,所产生氢气的体积VX是VY的一半。则X、Y两元素的化合价分别 为( )
A、+3、+1 B、+3、+2 C、+2、+3 D、+1、+3
13、用惰性电极电解M(NO3)x的水溶液,当阴极上增重 ag 时,在阳极上同时产生 b L 氧气(标准状况),从而可知 M 的相对原子质量为( )
![]()
14、下列关于Na2O2的说法中,正确的是( )
A、H2O2 、Na2O2 、MnO2都是过氧化物
B、2Na2O2+2CO2=2Na2CO3+O2该反应中转移的电子总数为4e-
C、能使澄清的石灰水变浑浊
D、阴阳离子个数比为1:1
15、将Na2SO4•10H2O、Na2CO3•10H2O、NaCl、Na2O各10g分别投入100g水的四只烧杯中,所得溶液质量分数最小的是( )
A. Na2SO4•10H2O B. Na2CO3•10H2O C. NaCl D. Na2O
16、碱金属与卤素所形成的化合物大都具有的性质是①高沸点②能溶于水③水溶液能导电④低熔点⑤熔融状态不导电( )
A.①②③ B.③④⑤ C.①④⑤ D.②③⑤
17、世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。则二氧化氯
A.是强氧化剂 B.是强还原剂 C.是离子化合物 D.分子中氯显-1价
18、近年查明,二氧化三碳(C3O2)是金星大气层的一个组成部分,下列关于二氧化三碳的说法中错误的是( )
A.结构简式是 O=C=C=C=O B.C3O2、CO、CO2都是碳的氧化物
C.C3O2与CO都可以燃烧生成CO2 D. C3O2与CO2都是碳酸的酸酐
19、三氟化氮(NF3)是无色无味的气体,它可由氨气和氟气反应得到:
![]()
下列有关NF3的叙述正确的是( )
A、NF3的氧化性比F2强 B、NF3是离子化合物
C、NF3中N呈-3价 D、NF3分子呈三角锥形
20、利用厨房用过的废食用油,加入强碱共煮后可制得下列物质中的( )
A、蜡烛 B、机油 C、肥皂 D、面霜
21、现代的防晒霜中含有能吸收紫外线的防晒剂,例如:对氨基苯甲酸丁酯,它能吸收到达皮肤上99%的紫外线,具有十分理想的防晒效果。下列关于对氨基苯甲酸丁酯的说法正确的是( )
A、从有机物分类角度看,它属于氨基酸类、酯类、芳香烃类
B、它能与NaOH溶液反应,但不能与盐酸反应
C、甲酸丁酯基(-COOC4H9)有3种不同结构
D、它的分子式为C11H15NO2
22、下列过程中,不涉及化学变化的是( )
A、向燃料煤中添加生石灰以减少二氧化硫的排放
B、鸡蛋清的水溶液中加入饱和Na2SO4溶液后,有白色沉淀生成
C、用SO2漂白过的草帽日久变黄
D、NO2气体经过加压变成无色液体
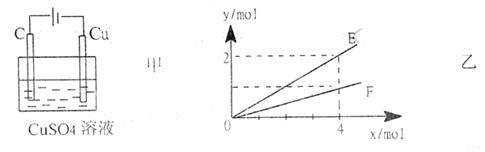
23、按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是 ( )
|
A.E表示生成铜的物质的量 B.E表示反应消耗水的物质的量
C.F表示生成硫酸的物质的量 D.F表示反应生成氧气的物质的量
二、填空题
24、250C时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va <Vb和a=0.5b.请填写下列空白:
1)a值可否等于3(填“可”或“否”) ,其理由是——。
2 )a值可否等于5(填“可”或“否”) ,其理由是一一一。
3 )a 的取值范围是
25、用废铁屑与稀硫酸反应,可制得硫酸亚铁。在100C和500C时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6g.常温下,从溶液中析出的晶体是FeSO4·7H2O。现取 200 ml 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约 15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4·7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是 。
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的PH值
(2)反应 15 min后过滤,其目的是 。
(3)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 。它是由 而产生的,其检测的方法是 。
(4)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 500C时,溶液的体积约为50.0 ml,该溶液是否达饱和?试通过计算加以说明。(500C时,FeSO4饱和溶液的密度为1.36 g/cm3)
(5)若要计算在800C下将溶液蒸发至体积为70.0 ml,再冷却至100C时,所得到的FeSO4 ·7H2O的质量,你认为_ (填编号),并简述所选之理由。答: .
A.前面提供的数据已经足够
B.还需要提供 100C时饱和溶液的密度: 1.42 g/cm3
C.还需要提供 800C时溶液的密度:1.30 g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0 ml
(6)根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从100C 50.0 ml溶液中结晶析出的FeSO4·7H2O的质量。(本大题计算结果保留3位有效数字)
26、有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X、Y、Z。已知X是由a和b元素按原子个数比为1:1组成的化合物。
(一)若Y是由c和b元素按原子个数比为1:1组成的化合物。,又知X分子含18个电子,化合物Y含38个电子,请填空:
①元素b在第 周期。
②化合物X的分子式是 。
③化合物Y的电子式是
(二)若a、b、c三种元素形成的单质(仍用a、b、c表示)和组成的化合物间反应关系式如下(未配平):
①b+c![]() Y
②a+c
Y
②a+c![]() Z
Z
③X+Y![]() m ④X+Z
m ④X+Z![]() c+n
c+n
⑤Y+Z![]() c+n
c+n
回答下列各题:
(1)最有充分理由说明上述反应中一定属于氧化还原反应的是 (填序号),其充分理由是 。
(2)如果m是一种无色、粘稠的油状液体化合物,则Y、Z分别是 ;写出下列反应方程式③ 。
27、(1)某温度下,向某容积固定的密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若保持温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,令X、Y、Z分别代表初始加入的N2、H2、NH3的物质的量。请填写下列空白:
①若X=0,Y=0,则Z= 。
②若X=0.75,Y= ,Z=- 。
③X、Y、Z应满足的一般条件是 。(请用两个方程式表示,其中一个只含X和Z,另一个只含Y和Z)
(2)若维持温度和压强不变,在一个可变容积的容器中发生上述反应。请填写下列空白:
①若X=0、Y=0,则Z= 。
②若X=0.75,则Y= ,Z= 。
③X、Y、Z应满足的一般条件是
28、已知连接羟基的碳原子上没有氢原子的醇不能发生催化氧化反应。A是一种重要的化工原料,其分子组成为C4H9Cl,A有如下转化关系:
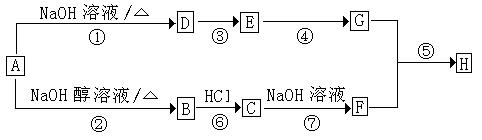
其中F不能发生催化氧化反应,E和G都能和新制Cu(OH)2反应,但反应条件、实验现象不同,H是一种果香味的液体。回答下列问题;
(1)A的同分异构体共有 种,符合条件的A的结构简式为
(2)与①、⑦反应类型相同的反应是 (填序号),若A中混有C,对生成B的纯度是否有影响 (填“是”或“否”),理由是
(3)写出下列反应的化学方程式:
![]()
![]()
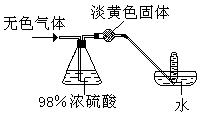 29、有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),如图示通过洗气瓶,发现气体体积减小一部分;通过干燥管后气体呈红棕色,再将该气体适量地通入盛满水倒立于水槽中的试管内,发现试管内水位下降后又缓慢上升,最后试管内全部充满液体。由此判断:
29、有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),如图示通过洗气瓶,发现气体体积减小一部分;通过干燥管后气体呈红棕色,再将该气体适量地通入盛满水倒立于水槽中的试管内,发现试管内水位下降后又缓慢上升,最后试管内全部充满液体。由此判断:
原气体中一定有 、一定没有 。
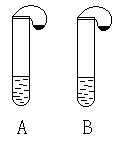 30、右图所示的A、B两支大试管中各盛有等质量的同一种液体,试管口各系有一个小气球,气球内分别装有等质量的不同固体(纯净物),实验时将两气球抬起,将其中固体同时倾入试管内,固体全部溶解,同时看到两气球都鼓气胀大,但A试管气球胀大的速度及最终胀大的体积都明显大于B。若两试管产生同一种气体,试推测A、B中盛放的液体和固体的可能组合,将各组合填入下表,要求各组分产生的气体不能相同。(可以不填满)
30、右图所示的A、B两支大试管中各盛有等质量的同一种液体,试管口各系有一个小气球,气球内分别装有等质量的不同固体(纯净物),实验时将两气球抬起,将其中固体同时倾入试管内,固体全部溶解,同时看到两气球都鼓气胀大,但A试管气球胀大的速度及最终胀大的体积都明显大于B。若两试管产生同一种气体,试推测A、B中盛放的液体和固体的可能组合,将各组合填入下表,要求各组分产生的气体不能相同。(可以不填满)
| 组合编号 | A、B中的液体 | A中的固体 | B中的固体 | 产生的气体 |
| ① | ||||
| ② | ||||
| ③ | ||||
| ④ | ||||
| ⑤ | ||||
| ⑥ |
31、50ml 0.5mol·L-1的盐酸与50ml0.55mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:
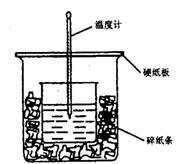
(l)从实验装置上看,图中尚缺少的一种玻璃用品是 。由图可知该装置有不妥之处,应如何改正? 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用 60 mL 0.50 mol· L-1的盐酸跟 50mL 0.55 mol· L-1的 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。简述理由 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会 ;用50mL 0.50 mol·L-1的 NaOH溶液进行上述实验,测得的中和热的数值会_(均填“偏大”“偏小”“无影响”)。
32、在下图中,当容器A中的反应开始后,再进行下列操作:
(1) 若弹簧止水夹c打开, B容器中有什么现象发生
.
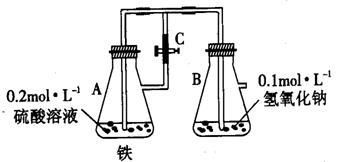 (2)若止水夹C关闭一段时间后,而容器A中的反应仍在进行时,B中有什么现象发生
(2)若止水夹C关闭一段时间后,而容器A中的反应仍在进行时,B中有什么现象发生
,写出B中有关反应的化学方程式 .
(3)若先打开止水夹 C一段时间,让 A中的反应进行,然后再关闭止水夹 C一会儿,B 中所发生的现象是 。其原因是 .
参考答案
1、C 2、C 3、C 4、 B 5、B 6、B 7、B 8、B 9、C 10、A 11、B 12、D 13、C 14、C 15、B 16、A 17、A 18、D 19、D 20、C 21、D 22、B 23、C 24、解答(1)否; b=6 溶液显酸性 (2)否; a=5, Va/Vb = 10 > 1 不可能 (3) 7/2 < a < 14/3 25、解答:(1)AB (2)除去过量的铁屑。(3) Fe2(SO4)3 ;废铁屑中含有氧化生成Fe2O3(或Fe3O4)被H2SO4溶解生成Fe2(SO4)3。FeSO4被空气氧化生成Fe2(SO4)3;取少许滤液,加KSCN溶液,观察溶液是否变血红色。
(4)解法一:若反应后得到的FeSO4在50℃时配成饱和溶液,其体积为x则,
![]()
所以,蒸发后溶液尚未饱和.
解法二:若该溶液是饱和的,则其所含的 FeSO4溶质的质量为y 则
![]()
按题意 H2SO4完全反应得到的 FeSO4的质量为:
0.5 X 200 X 10-3 X 152 =15.2
因 15.2g<22.24 g,则溶液尚未达到饱和.
解法三:饱和溶液时,溶液中溶质的质量分数为:
![]()
实际溶液中溶质的质量分数为。
![]()
因 32.71%>22.35%,故溶液尚未达到饱和。
(5)C;(4)中求证 50℃时溶液饱和否,涉及溶解度的计算.用到了1.36 g/cm3
(50℃时)的密度数据。同理,涉及 80℃时溶解度的计算也要用到 80℃时对应的溶液的密度数据。
(6)解法一:
①(5)中所给 80℃时 50.0 ml溶液中含溶剂水的质量为:
![]()
②设析出的FeSO4·7H2O的质量为X,则可列出
![]()
解法二:
10℃,饱和溶液中FeSO4的质量分数![]()
则![]()
X =11.0 (g)
26、解答:(一)① 二 ②H2O2 (二)(1)①②④⑤ 这些反应中有单质生成或单质参加反应 (2)SO2 H2S H2O2+SO2===H2SO4
27、解答:(1)①Z= 2 mol 。 ②Y= 2.25mol,Z=- 0.5mol 是X+Z/2=1 , Y+3Z/2=3 (2)①Z= >0 。 ②Y= 2.25mol ,Z= .>=0 。 ③. Y=3X, Z>=0
28、(1)4 (2)⑤ 否 29、NH3、CO2、NO;O2、HCl、NO2、H2、N2
30、①稀盐酸(或稀硫酸)、镁粉、铁粉、H2 ②稀盐酸(或稀硫酸)、NaHCO3、Na2CO3、CO2 ③稀盐酸(或稀硫酸)、Na3S、FeS、H2S ④稀硝酸、铁粉、铜粉、NO 31、(l)环形玻璃搅拌棒;在大小烧杯间填满碎泡沫(或纸条)使小烧杯口与大烧杯口相平 (2)减少实验过程中的热量损失 (3)偏小 (4)不等;相等;因为酸、碱发生中和反应放出的热量与酸、碱的用量有关,而中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。与酸、碱的用量无关 (5)偏小;偏小 32、(l)产生氢气气泡 (2)A中产生FeSO4溶液被压入B中,产生白色沉淀,沉淀迅速变成浅绿色,再变成深绿色,再后变成红褐色
FeSO4 + 2NaOH = Fe(OH)2 十Na2SO4
4Fe(OH)2 十O2十2H2O=4Fe(OH)3
产生白色沉淀,并保持较长一段时间,NaOH溶液中溶解的O2被H2驱除,容器B内充满了H2,阻止了空气的进入。