高三化学第四次周考
理综化学试题
第Ⅰ卷 选择题(共48分)
本卷共8个小题,每小题6分,共48分,每小题只有一个正确选项。
1.根据科学文献记载,德国试行用汽水喷灌植物,它的作用是:①加速植物的光合作用;②改良碱性土壤,调节pH;③有利于土壤中钙和镁离子被植物吸收;④对防治病虫害有利
A.只有① B.只有①③ C.只有②③ D.①②③④
2.下列离子方程式正确的是
A.将Ba(OH)2溶液滴入NaHSO4溶液中至恰好沉淀完全:
Ba2+ +2OH- + 2H++ SO42-=BaSO4↓+ 2H2O
B.Na2CO3溶液中滴加盐酸至刚好出现气泡时停止:CO32- + 2H+=CO2↑+ H2O
C.碳酸氢钙溶液跟稀硝酸反应:HCO3- + H+=CO2↑+ H2O
D.氯化铁溶液中通入SO2气体:Fe3+ + SO2 + 2H2O=Fe2+ + SO42- + 4H+
3.中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A.用反应热数据的大小判断不同反应的反应速度的快慢
B.用沸点数据推测将一些液体混合物用分馏的方法分离出来的可能性
C.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3
D.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性的强弱
![]()
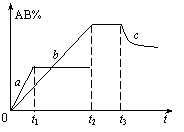 4.反应A2
+ B2
2AB ;
4.反应A2
+ B2
2AB ;![]() kJ/mol,在不同温度和压强改变条件下,产物AB的生成情况如右图所示:a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
kJ/mol,在不同温度和压强改变条件下,产物AB的生成情况如右图所示:a为500℃,b为300℃时情况,c为300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
A.A2、B2、AB均为气体,Q < 0
B.AB为气体,A2、B2中最少有一种为非气体,Q < 0
C.AB为气体,A2、B2中最少有一种为非气体,Q > 0
D.AB为固体,A2、B2中最少有一种为非气体,Q > 0
5.向10mL pH = 12的NaOH溶液中加入10mL某酸,再滴入几滴甲基橙,则溶液呈现红色,这种酸可能是
A.pH = 2的硫酸 B.pH = 2的醋酸
C.0.01mol/L的甲酸 D.0.01mol/L的硝酸
6.下表A~D各项中,在有乙与甲共存的情况下,用丙检验甲的存在,不能成功的是(不得使用加热、过滤、萃取等实验操作)
| 序号 | 甲 | 乙 | 丙 |
| A | SO42- | SO32- | 稀盐酸、BaCl2溶液 |
| B | I- | Cl- | AgNO3溶液 |
| C | Fe2+ | Fe3+ | KSCN溶液 |
| D | Al3+ | Ag+ | 稀氨水 |
 7.下图是三种有机物分子的比例模型,有关它们的推断不正确的是
7.下图是三种有机物分子的比例模型,有关它们的推断不正确的是
A.甲、乙、丙三种物质互为同分异构体
B.甲和丙为同类别物质
C.甲、乙、丙均能在一定条件下发生消去反应
D.甲和丙都能被足量KMnO4酸性溶液氧化为二元羧酸
 8.按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是
8.按如图甲装置进行实验,若乙中横坐标x表示流入电极的电子的物质的量,下列叙述不正确的是
A.F表示生成硫酸的物质的量
B.E表示反应消耗水的物质的量
C.E表示生成铜的物质的量
D.F表示生成氧气的物质的量
D.③④
第II卷 非选择题(共62分)
本卷共4道大题.
9.(14分)X是一种重要的化学试剂,它的水溶液有如下反应:
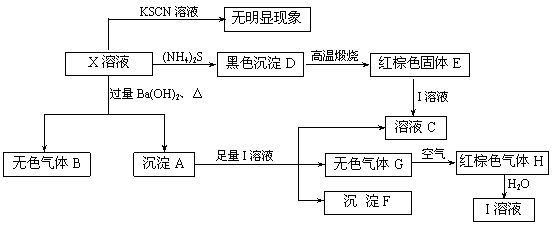 |
根据以上关系,按要求填空:
(1)气体B的化学式为________________,沉淀F的化学式为______________。
(2)X的化学式为________________,其俗称______________。
(3)A与I溶液反应的离子方程式是__________________________________________。
(4)写出D高温煅烧生成E的化学方程式_____________________________________。
28.(14分)X、Y、Z、R为短周期四种常见元素,X的原子序数与Y的原子序数之和等于Z的原子序数,且原子序数X<Y;Z与R同一主族,在一定条件下,X的单质与Y的单质反应生成化合物A,A的分子为三角锥形。在一定条件下,A与Z的单质反应生成化合物B和化合物C,B只含X和Z,C只含Y和Z。请填写下列空白:
(1)元素X是__________,Y是__________,Z是__________,R是__________。
(2)只含Y与Z的化合物的化学式有_______________________________。
(3)在一定条件下,A与Z的单质反应生成B和C的化学方程式为
________________________________________________________________。
(4)含有X、Y、Z、R四种元素的离子化合物有__________________________________。(5)X与Z形成的某化合物可和Z与R形成的某化合物发生氧化还原反应,其化学方程式为________________________________________________________________。
10.(15分)2002年诺贝尔化学奖表彰的是在“看清”生物大分子真面目方面的科技成果,一项是美国科学家约翰·芬恩与日本科学家田中耕“发明了对生物大分子的质谱分析法”;另一项是瑞士科学家库尔特·维特里希发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法。质子核磁共振(NMR)是研究有机物结构的有力手段之一,在所有研究的化合物分子中,每一结构中的等性氢原子在NMR中都给出了相应的峰(信号),谱中峰的强度与结构中的等性H原子个数成正比。例如乙醛的结构简式为CH3CHO,在NMR中有两个信号,其强度之比为3∶1。
(1)某烃的含氧衍生物,它的相对分子质量为74.0,碳的质量分数为64.9%,NMR中有
2个信号,其结构简式可能为____________________________________________。
(2)甲、乙、丙三种稳定有机物,分子式均为C2H4O2,已知甲不溶于水,乙和丙均易溶于水,在NMR中甲和乙均有2个信号,丙有3个信号。
则甲为________________,乙为________________,丙为________________。
请在下表中填写区分乙、丙两种化合物所用的试剂和化学方程式。
| 物质 | 信号强度之比 | 试 剂 | 化 学 方 程 式 |
| 乙 | |||
| 丙 |
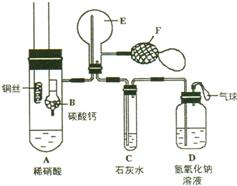 11.(19分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如右图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
11.(19分)为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如右图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当产生___________
__________现象时,立刻将B装置上提,使之与稀硝酸分离。该组学生的设计此步骤操作的目的为_______________________________________________________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为________________________________________________;装置E中开始时出现红棕色气体,原因是_________________________________________
______________________________________________________________________;用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生此现象的原因是
_____________________________________________________________________。
一段时间后,C中产生_____________________现象,其原因是________________
______________________________________________________________________。
(3)装置D的作用是___________________________________________________,其中化学方程式是_______________________________________________________。
(4)若需在E装置中收集到纯净的NO气体,E装置应如何改进?
______________________________________________________________________。