高三化学第一次调研测试卷
化学
可能用到的相对原子质量:H:1 Na:23 C:12 O:16 S:32 Cl:35.5
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,共48分,每小题只有一个正确答案)
1.据最新科技报导,用10B合成的10B20有非常好的抗癌、治癌作用,下列有关说法正确的是
A.10B和10B20互为同位素 B.10B20是一种高熔点硬度大的物质
C.10B和10B20互为同分异构体 D.10B中子数与核外电子数相同
2.下列有关性质判断正确的是
A.沸点:HBr<HCl B.水中溶解性: CH3CH2Br<C2H5OH
C.熔点:Li<Na<K D.密度:氨水>水
3.一定温度下,某纯净物溶于水形成的溶液中,由水电离出来的c(H+)=10-10mol·L-1,该溶液的溶质不可能是
A.NaHSO4 B.Al2(SO4)3 C.NaOH D.HCl
4.光缆通讯能同时传输大量信息,一条光缆通路可同时容纳十亿人通话,也可以同时传送多套电视节目,是一种现代化通讯手段,制造电缆主要材料是
A.光导纤维 B.氧化铝陶瓷 C.人造纤维 D.天然有机高分子
5.“绿色化学”对化学反应提出了“原子经济性”(即节约原子)的新概念及要求。理想原子经济性反应是原料分子中原子全部转化为所得到的产物中,不产生副反应,实现零排放。下列反应可能符合这一要求的是
①取代反应;②化合反应;③消去反应;④加成反应;⑤水解反应;⑥加聚反应;
A.①③⑤ B.②④⑥ C.①②③ D.④⑤⑥
6.下列变化属于物理变化的是
A.苏打晶体风化 B.浓硝酸“发烟” C.O2在放电条件下变成O3
D.漂白的草帽久置于空气中变黄
7.仅能在水溶液中导电的电解质是
A.SO3 B.NaCl C.Na2CO3 D.NH4Cl
8.T℃时,将一定量的混合气体在密闭容器中发生反应:aA(g)+bB(g)![]() cC(g)+dD(g),平衡后测得B气体浓度为0.6mol·L-1,恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体浓度为0.4mol·L-1,下列叙述正确的是
cC(g)+dD(g),平衡后测得B气体浓度为0.6mol·L-1,恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体浓度为0.4mol·L-1,下列叙述正确的是
A.重新达到平衡时,D的体积分数减小 B.a+b<c+d
C.平衡向右移动 D.重新达到平衡时,A气体浓度增大
9.t℃时,Na2CO3溶解度为Ag,现有饱和Na2CO3溶液(100+A)g,溶质质量分数为a%;向该溶液中投入无水碳酸钠Ag,静置后析出碳酸钠晶体(Na2CO3·10H2O)Bg;加水使晶体全部溶解,所得溶液质量分数为a%,则加水的质量为
A.(100+A)g B.100g C.(100-180A/286)g D.(100-A·a%)g
10.用98%、密度1.84g/cm-3的浓H2SO4配制1mol·L-1的稀硫酸100mL,给出下列可能用到仪器:①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒;按使用仪器先后顺序排列正确的是
A.④③⑦⑤⑥ B.②⑤⑦⑥ C.①③⑤⑦④⑥ D.②③⑦⑤⑥
11.将200mL0.1mol·L-1醋酸与 100mL0.2mol·L-1 氢氧化钠溶液混合,则混合溶液中各离子浓度的大小顺序是
A.c(Na+)>C(CH3COO-)>c(H+)>c(OH-) B.c(Na+)>C(CH3COO-)>c(H+)=c(OH-)
C.c(Na+)>C(CH3COO-)>c(OH-)>c(H+) D.c(Na+)=C(CH3COO-)>c(OH-)>c(H+)
12.将SO2通入BaCl2溶液中至饱和未见有沉淀生成,继续通入另一气体,仍无沉淀生成,则通入气体可能是
A.O3 B.NH3 C.Cl2 D.HI
13.已知在25℃ 101kPa下,1.00gC2H2完全燃烧生成液态水和CO2时放出49.8kJ的热量,则下列热化学方程式正确的是
A.C2H2(g)+O2(g)==2CO2(g)+H2O(l) ΔH=-49.8kJ·mol-1
B.C2H2(g)+O2(g)==2CO2(g)+H2O(g) ΔH=-49.8kJ·mol-1
C.C2H2(g) +O2(g)=2CO2(g)+H20(l) ΔH=+1294.8kJ·mol-1
D.C2H2(g) +O2(g)==2CO2(g)+H2O(l) ΔH=-1294.8kJ·mol-1
14.常温下某溶液能与Al反应放出H2,下列离子组可能在该溶液中大量共存的是
A.Ba2+,Cl-,Na+,SO42- B.Br-,NO3-,Fe2+,Ba2+
C.SO32-,HCO3-,Na+,NH4+ D.NO3-,Cl-,Na+,K+
15.某有机物A经氧化后得B(B分子式为C2H3O2Br),而A水解得C,1molC和2molB反应得一种含溴的酯(分子式为:C6H8O4Br2),由此推断A的结构简式为
A.CH2CHO B.CH2-CH2
Br OH OH
![]() C.CH2─CH2OH D. H─C─OCH2Br
C.CH2─CH2OH D. H─C─OCH2Br
Br O
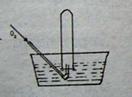
16.将体积为VmL的试管充满NO气体,按右图进行实验,当通入
相同条件下O2 49mL时,液面仍在原来位置,则试管体积V为
A.49mL B.28mL C.30mL D.24.5mL
Ⅰ卷答题表
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
第Ⅱ卷 (非选择题 共52分)
二、实验题(本大题包括2小题,共13分)
17.(3分)下列实验仪器插入液面下的是_________________
①用胶头滴管吸取NaOH溶液滴入FeSO4溶液制Fe(OH)2
②制备H2的简易装置中长颈漏斗的下端;
③分离石油时,控制温度用的温度计;
④用无水乙醇与浓H2SO4共热制乙烯所用的温度计;
⑤用水吸收氯化氢时的导管口;
⑥用胶头滴管向装有BaCl2溶液的试管中滴加AgNO3溶液
18.(10分)某课外活动小组利用下图仪器装置和药品进行物质性质与转化关系的探究。当将Ⅱ中铂丝加热至红热时,打开K阀使气流缓缓通过。请回答下列有关问题:
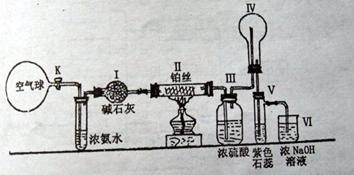
⑴如何检查该装置的气密性:_________________________________________________________________________________________
⑵写出Ⅱ中发生的化学方程式:________________________________________
⑶装置Ⅳ(烧杯)中的现象:__________________________________________
装置Ⅴ(试管)中的现象:__________________________________________
⑷装置Ⅰ与Ⅲ都能起到干燥气体作用,两者能否调换位置使用:_______(填“能”或“不能”);理由:____________________________________________________________________;
⑸烧杯中NaOH溶液的作用:__________________________________________。
三、填空题(本大题包括5小题,共31分)
19.(5分)⑴在一定条件下,RO3-和氟气各发生如下反应:RO3-+F2+OH-─RO4-+F-+H2O
则与1molRO3-反应所需OH-的物质的量为_________mol
⑵已知在25℃,101kPa下,合成氨的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1在该条件下,将1molN2、3molH2置于一密闭容器中,在催化剂存在下反应,测得反应热总小于92.4kJ,其原因是___________________________________________________________
2NH3(g) ΔH=-92.4kJ·mol-1在该条件下,将1molN2、3molH2置于一密闭容器中,在催化剂存在下反应,测得反应热总小于92.4kJ,其原因是___________________________________________________________
20.(6分)含有0.4molCuSO4和0.4molKCl的混合溶液1L,用惰性电极进行电解,当某一电极析出0.3molCu时,则通电过程中,电路中通过的电子的物质的量为________,另一电极的产物是__________。
21.(8分)下图中A~G是化合物,H是一种无色气态单质,D常温下是一种无色液体,它们之间有如下转化关系:
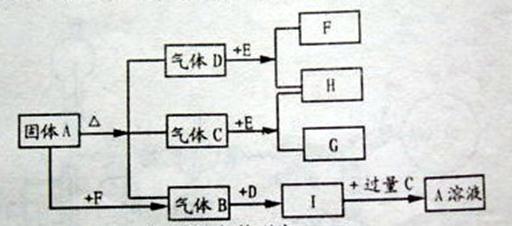
⑴写出:A的名称:____________________;B分子的空间构型为:_____________;
C的结构简式:___________;E的电子式____________;
⑵C与E反应的化学方程式:______________________________________
⑶A溶液与F溶液反应的离子方程式:__________________________________。
22.(4分)某学生写出如下十种一氯戊烷的同分异构体。
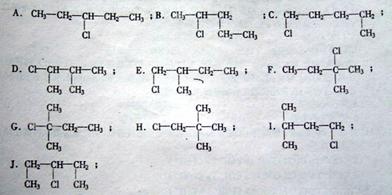
⑴你认为一氯戊烷共有________种同分异构体;
⑵上述十种结构中,属于同种分子的是___________________(填序号)。
![]() 23.(8分)在红磷存在时,羧酸与溴起反应,可以在与羧基相连的碳原子上导入溴原子,例如:
23.(8分)在红磷存在时,羧酸与溴起反应,可以在与羧基相连的碳原子上导入溴原子,例如:
RCH2COOH RCHCOOH
Br
丙酸存在下列各步变化:
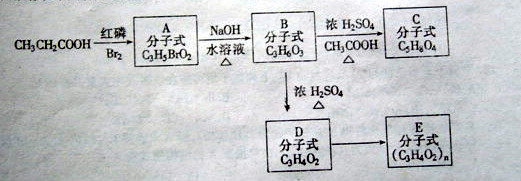
⑴写出生成C的化学方程式:_______________________________________________
⑵写出D的结构简式_______________________________________
⑶写出生成A、C、D、E的反应类型:A_______C________D_________E________
四、计算题(本大题共8分)
24.(8分)白色粉末A由Na2S、Na2SO3、Na2SO4和NaCl等物质中的三种混合而成,取一定A的样品,投入100mL2.2mol·L-1盐酸中,充分反应后过滤,最终得100mL含H+的物质的量浓度为1mol·L-1的滤液。若将此滤液蒸干,只得到8.19g纯净物B。
⑴纯净物B的化学式为______________;
⑵A中是否有NaCl________(填“有”或“没有”)
理由是___________________________________________________________。
⑶若反应后还生成0.896L(标态)气体,且该气体不会使品红退色。求所取的A样品中含有Na2S的物质的量。
(已知2S2-+SO32-+6H+==3S↓+3H2O)
参考答案及平分标准
一、(每小题3分,共48分)
1D 2B 3B 4A 5B 6B 7D 8A 9B 10D 11C 12D 13D 14D 15C 16B
二、实验题(共13分)
17.(3分)①②④
18.(10分)⑴打开K阀,观察Ⅵ处有无气泡产生,或关闭K微热Ⅱ处,观察Ⅵ处有无气泡。(2分)
⑵4NH3+5O2![]() 4NO+6H2O (2分)
4NO+6H2O (2分)
⑶Ⅳ中产生红棕色气体;Ⅴ中紫色石蕊变红 (2分)
⑷不能;浓H2SO4吸收氨气,使后续反应不能进行,碱石灰也吸收NO2气体。(3分)
⑸吸收尾气,防止NO,NO2污染空气(1分)
三、填空题(共31分)
19.(5分) Ⅰ 2mol (2分)Ⅱ反应热92.4kJ是指1molN2与3molH2反应生成2molNH3放出的热,1molN2与3molH2的反应为可逆反应,不可能全部生成NH3,所以总小于92.4kJ (3分)
![]() 20.(6分) 0.6mol(2分) Cl2和O2
(4分)
20.(6分) 0.6mol(2分) Cl2和O2
(4分)
21.(8分)⑴A 碳酸氢铵 B 三角锥形 C O=C=O D Na+ [ O O ]2-Na+ (每空1分,共4 分)
⑵2CO2+2Na2O2==2Na2CO3+O2 (2分)
⑶NH4++HCO3-+2OH-==NH3·H2O+CO32-+H2O(写成:NH3+2H2O也可)(2分)
22.(4分)8 (2分) F与G,A与J (2分)
23.(8分)⑴CH3CHCOOH+CH3COOH![]() CH3CHCOOH+H2O (2分)
CH3CHCOOH+H2O (2分)
OH OOCCH3
⑵CH2==CHCOOH (2分)
⑶取代、酯化、消去、加聚(每空1分,共4分)
四、计算题
24.(8分)⑴NaCl ⑵有;最后得到的NaCl为0.14mol,而由反应生成的NaCl仅为0.12mol(3分)
⑶设Na2SO3的物质的量为x,生成0.896LH2S气体消耗盐酸的物质的量为y。
Na2SO3+2Na2S+6HCl==3S↓+6NaCl+3H2O
1 2 6
X 2x 6x (1分)
Na2S+2HCl==2NaCl+H2S↑
1 2 1
y/2 y 0.896/22.4 (1分)
![]() 6x+y=(2.2×0.1)- (0.1×1.0)
6x+y=(2.2×0.1)- (0.1×1.0)
y=2×
x=0.0067mol y=0.08mol
n(Na2S)=0.0067×2+=0.053mol