高三化学对口班普化期末试卷
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Cl-35.5
一、
单项选择题
1、"黄色炸药"TNT爆炸力强,存放安全,至今仍是常规战争中最重要的弹药,下面关于TNT的认识,正确的是
A.它是甲苯和浓硝酸发生酯化反应的产物 B.不能燃烧,只能用雷管引爆
C.它的化学成份是硝基甲苯 D.它属于分子晶体
2、有机物甲能发生银镜反应,甲经催化加氢还原为乙,1mol乙与足量钠反应产生氢气
22.4L(标准状况下),据此推断乙可能是
A. CH3—CH2—OH B. CH3—CH2—CH2—OH
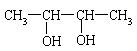 C. HO—CH2—CH2—CH2—OH
D.
C. HO—CH2—CH2—CH2—OH
D.
3、2000年12月我国部分地区发生了用石蜡油等工业用油加工大米的"毒米事件"。食用油和石蜡油虽然都称作"油",但从化学组成和分子结构看,它们是完全不同的。下列说法正确的是
A. 食用油属于纯净物,石蜡属于混合物
B.食用油属于酯类,石蜡属于烃类
C. 食用油属于有机物,石蜡属于无机物
D. 食用油属于高分子化合物,石蜡属于小分子化合物
一些珍贵的古书字画,为了珍藏,可以抽成真空后再充填氩气等稀有气体,为降低成本也可以充入氮气。回答4--6题:
4、空气冷却分离是工业制取氮气的主要方法。若将空气冷却液化,然后缓缓升温,最先分离出的气体是
A.N2 B.O2 C.CO2 D.H2O
5、除了从空气中分离的方法,还可以用其它方法得到少量氮气,其中一个方法是:NaNO2 +NH4Cl = NaCl + N2↑+ 2H2O,在反应中作氧化剂的是
A.NH4Cl B.NaNO2 C.NaCl D.N2
6、模拟生物固氮是科学家的一个重要研究课题。下列不属于氮的固定的是
A.N2与H2合成氨气
B.N2和O2反应生成NO
C.氨水中能通入CO2制得NH4HCO3 D.N2与Mg反应生成氮化镁
7、2001年5月26日湛江市一化工厂硫酸罐发生硫酸泄漏,造成多人重伤。为防止事态漫延,海军某部防化营官兵急速运来10多吨某物质,使事故现场得到有效控制。这种物质是
A.NH4Cl B.Na2CO3 C.NaCl D.HNO3
8、不能从溴水中萃取溴的试剂是
A.C2H5OH B.C6H6 C.直馏汽油 D.四氯化碳
9、下列物质中,属于离子晶体且含有非极性共价健的是
A.NaOH B.Na2O2 C.NaCl D.N2
10、下列气体不能用排水法收集的是
A. NO B.O2 C.CH4 D.NO2
11、在标准状况下,V L氯化氢气体溶于1L水中,所得溶液密度为dg/cm3。则此溶液浓度的表示方法正确的是
A、3650V/(36.5V+22400)% B、36.5V/(36.5V+22400)%
C、Vd/(36.5V+22400)mol/L D、1000Vd/(36.5V+22400)mol/L
12、下列污染都对人类的健康构成巨大威胁,但其中一般不被称作环境污染的是
A.乱扔废电池造成的地下水污染 B.医疗用的血制品被污染
C.大量使用涂改液造成教室内空气污染
D.粮食蔬菜被农药污染
13、最近科学家冶炼出纯度高达99.999%的铁,你估计它不会具有的性质是
A.硬度比生铁低 B.不能与浓盐酸反应
C.在冷的浓硫酸中钝化 D.能从硫酸铜溶液中置换出铜
14、镁粉是制造烟花的重要原料之一,生产镁粉时,将镁蒸气在某种气体中冷却,下列可作为冷却气体的是
A.
空气 B.氩气 C.氮气 D.二氧化碳
15、宣传科学知识,介绍高新科技,揭露伪科学,是科学工作应尽的义务,下列属于伪科学的是
A.用催化剂将水变成油 B.高温高压下将石墨变成金刚石
C.用碘化银人工降雨 D.用催化剂将速度很慢的反应变成瞬间完成
26、下列离子方程式正确的是
A.澄清石灰水中加入稀硝酸
Ca(OH) 2 + 2H+ = Ca2+ + 2H2O
B.FeCl3溶液中通入H2S气体 Fe3+ + S2-
= Fe2+ + S↓
C.碳酸氢钠溶液中加入盐酸
HCO3-- + H+ = CO2↑ + H2O
D.铜和稀硝酸反应 3Cu +
8H+ = 3Cu2+ + 2NO↑ + 4H2O
17、2000年诺贝尔化学奖授予了二位美国科学家黑格、马克迪尔米德和一位日本科学家白川英树,以奖励他们在导电聚合物研究中的杰出成就。聚乙炔是他们重点研究的一种物质,下列关于聚乙炔的说法不正确的是
A.聚乙炔是一种高分子化合物 B.聚乙炔不稳定易被氧化
C.聚乙炔不可能导电 D.聚乙炔有导电性是因其结构特征和掺杂物质起作用
18、下列说法正确的是
A.常温下,1mol CO2的体积为22.4L B.1mol O2的质量为32g
C.1mol CH4含有6.02×1023个原子 D.1mol氩气含1.204×1024个原子
19、Murad等三位教授最早提出NO分子在人体内有独特功能,因此获得1998年诺贝尔医学及生理学奖。关于NO的叙述不正确的是
A.NO可以是某些含低价氮物质的氧化产物 B.NO不是HNO2的酸酐
C.NO可以是某些含高价氮物质的还原产物 D.NO是红棕色气体
20、下列不具有氧化性的微粒是
A. H+ B.O2
C.F- D.NO2
21、铁钉溶于稀盐酸后,加入过量氢氧化钠溶液,然后放置于空气中一段时间,此时铁的存在形式为
A. Fe(OH)3 B.Fe(OH) 2 C.FeCl2 D.FeCl3
22、PH=13的溶液中能大量共存的离子组为
A.NO3- NH4+ Na+ Cl-
B.NO3- SO42-- K+ Al3+
C.Cl- SO42-- K+ Cu2+
D.CO32-- SO42-- K+ Na+
23、下列各组溶液中,不用其它试剂就能鉴别的是
A.NH4Cl NaNO3 KCl
Al2(SO4)3 B.NaAlO2 HCl
NaCl AgNO3
C.NaCl H2SO4 AlCl3 KNO3 D.FeCl3 Na2SO4 BaCl2 Al2(SO4)3
24、铜片投入稀H2SO4中不溶解,但加入某物质后,铜片溶解,则加入的物质为
A. KCl B.CaCl2 C.Fe2(SO4)3 D.Al2(SO4)3
姓名____________
班级_______ 学号_______ 成绩____________
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
二、填空题
1、铁酸钠(Na2FeO4)是一种新型净水剂。净水时它被还原成胶状的氢氧化铁,吸附水里悬浮的杂质并能消毒杀菌。工业上制取铁酸钠的化学方程式如下:
aFe(NO3)3 + 16NaOH + bCl2 = cNa2FeO4 + dNaNO3 + 6NaCl + 8H2O
(1)系数a、b、c、d分别是 、 、 、 。
(2)反应中还原剂是 。
(3)反应中转移电子总数是 mol。
2、配平下列方程式
KMnO4 + HCl = MnCl2 + Cl2 + KCl + H2O
P + HNO3+ H2O = H3PO4+ NO
3、根据元素周期表中短周期元素回答:(写元素符号或化学式)
(1)最稳定的氢化物是________,最高价氧化物的水化物酸性最强的是________。
(2)金属性最强的元素是_______,
(3)电子总数为10个且带正电荷的微粒是___________________。
4、海洛因和吗啡都是严格查禁的毒品,其中吗啡分子含碳71.58%,含氢6.67%,含氮4.91%,其余的为氧;吗啡分子中含3个氧原子。求:
(1) 吗啡的分子量是 吗啡的分子式是
5、已知一种具有水果香味的有机物M的分子式为C4H8O2,M在一定条件下可进行如图所示的转化:
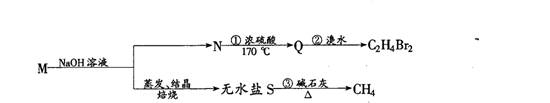
则:
1)M的结构简式是 。
2)反应①的类型为 反应。 3)反应②的类型为 反应。
4)反应③的化学方程式为:
。
三、实验题
1、请用下列编号为①--④的实验装置设计一实验,以验证实验室制乙烯时所得气体中含有二氧化碳,二氧化硫和水蒸汽。
A B C
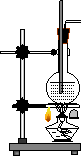 | |||||||
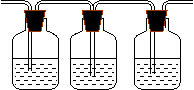 |  |  | |||||
品红溶液 KMnO4(H+) 品红溶液
① ② ③ ④
(1)用装置的编号表示装置的连接顺序(按产物的气流从左到右的流向)
_________ →_______→________→__________.
(2)能说明混合气中含有二氧化硫的实验现象是_______________________________。
能说明混合气中含有二氧化碳的实验现象是_______________________________。
(3)装置③中的固体药品是_________________。
四、计算题
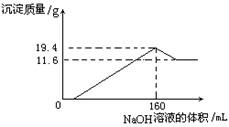
1、将一定质量的镁铝合金全部溶于100 mL某浓度的
盐酸中。向所得溶液中滴加5.0mol/L的NaOH溶液,
生成沉淀质量与加入的NaOH溶液体积关系如右图所
示。则盐酸的物质的量浓度为 ___ mol/L。
2、氧化铁和铁粉的混合物19.2 g,恰好溶于150 mL某浓度的稀硫酸,并收集到3.36 L(标准状况下)的气体。向反应后的溶液中滴加硫氰化钾溶液,不显血红色。求:
(1) 原混合物中铁粉的质量。
(2) 稀硫酸的物质的量浓度。
第一卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | D | C | B | A | B | C | B | A | B | D | D | B | B | A | B |
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
| 答案 | A | D | A | C | B | D | C | A | D | B | AC | BD | AC | C | AD |
31.(1)a=2 b=3 c=2 d=6 (2)Fe(NO3)3 (3) 6
32(1)铁 2Fe3++Fe==3Fe2+ (2)C+CO2 高温===== 2CO 碳
33 (1)HF HClO4 (2)Na (3)NH4+、Na+ 、Mg2+ 、Al3+
34、①②③④
35、①CH3COOC2H5 ②消去 ③加成 ④CH2=CH2+Br2 →CH2BrCH2Br
36、(1)② (2)③④
37、(1)④→③→①→② (2)品红溶液褪色 第二瓶品溶液不褪色,装置②中的澄清石灰水变浑浊。 (3)无水硫酸铜
38、8
39、(1)285 (2)C17H19NO3
40、(1)11.2g (2)2 mol/L