高三化学对口班普化周练(九)
一、 选择题
1.人类未来理想的燃料是
A.煤 B.石油 C.天然气 D.氢气
2.下列物质中,属于纯净物的是
A.氨水 B.盐酸 C.液氯 D.漂粉精
3.在门窗紧闭的室内用煤炉取暖易发生煤气中毒。引起煤气中毒的主要气体是
A.CO2 B.O2 C.CO D.N2
4.下列物质在常温常压下为液体的是
A.甲烷 B.乙醇 C.乙烯 D.乙炔
5.常温下能用铁制容器盛放的是
A.稀硫酸 B.稀硝酸 C.浓硫酸 D.硫酸铜溶液
6.下列物质中,能发生银镜反应的是
A.乙醇 B.乙醛 C.乙酸 D.乙酸乙酯
7.下列物质的水溶液,其pH大于7的是
A.Na2CO3 B.(NH4)2SO4 C.KNO3 D.Na2SO4
8.某元素最高价氧化物对应水化物的化学式是H2XO3,这种元素的气态氢化物的化学式为
A.HX B.H2X C.XH3 D.XH4
9.下列物质属于天然高分子化合物的是
A.油脂 B.蔗糖 C.淀粉 D.聚乙烯
10.实验室制取下列气体时,只能用排水法收集的是
A.NH3 B.H2 C.SO2 D.NO
11.下列物质中,既有离子键又有共价键的是
A.H2O B.CaCl2 C.KOH D.C12
12.下列过程不可逆的是
A.蛋白质的盐析 B.蛋白质的变性 C.氯化铁的水解 D.醋酸的电离
13.气体甲能使湿润的红色石蕊试纸变蓝,气体乙可在空气中产生白雾,当甲与乙相遇可能生成
A.NH4C1 B.NH4HCO3 C.(NH4)2CO3 D.(NH4)2SO4
14.下列各组性质的比较中,不正确的是
A.碱性:NaOH>Mg(OH)2 B.热稳定性:NH3>PH3
C.金属性:K>Na D.原子半径:Cl>S
15.下列有关厨房铝制品的使用与洗涤中,你认为合理的是
A.盛放食醋 B.烧煮开水 C.用金属丝擦表面的污垢 D.用碱水洗涤
16.下列物质中,其分子式为C6H14的是
A.2-甲基丁烷 B.2,3-二甲基戊烷 C.2-甲基己烷 D.2,3-二甲基丁烷
17.往下列物质的水溶液中,分别滴加稀硫酸和氯化铝溶液,均有可能产生白色沉淀的是
A.BaCl2 B.Ba(OH)2 C.Na2CO3 D.KOH
18.进行如下实验时,所选用的试剂错误的是
A.用稀盐酸清洗做焰色反应的铂丝 B.用稀盐酸和二氧化锰制取氯气
C.用稀硝酸洗去残留在试管壁上的银镜 D.用浓硫酸吸收二氧化硫中水蒸气
19.在强酸性溶液中,可以大量共存的离子组是
A.Na+、K+、CH3COO—、Cl— B.Ba2+、Na+、CO32—、NO3—
C.Na+、Ag+、SO42—、Cl— D.Al3+ 、Fe3+、NO3—、SO42—
20.下列变化中,不属于化学变化的是
A.SO2使品红溶液褪色 B.氯水使有色布条褪色
C.活性炭使红墨水褪色 D.O3使某些染料褪色
21.多少克的氧气中含有1mole—
A.2g B.4g C.16g D.32g
22.下列对于实验室事故的处理,合理的是
A.酒精灯失火后,立即用水扑灭 B.金属钠失火,立即用泡沫灭火器灭火
C.苯酚沾在手上,立即用氢氧化钠溶液洗涤 D.不慎将碱溅到皮肤上,立即用水冲洗
23.在一定条件下,发生反应:2NO2![]() N2O4,该反应达到化学平衡后,降低温度,混合物的颜色变浅,下列有关说法正确的是
N2O4,该反应达到化学平衡后,降低温度,混合物的颜色变浅,下列有关说法正确的是
A.正反应为放热反应 B.正反应为吸热反应
C.降温后NO2的浓度增大 D.降温后各物质的浓度不变
24.下列说法正确的是
A.在加碘食盐中,碘以单质形式存在
B.纳米材料是指一种称为“纳米”的新物质制成的材料
C.光导纤维是以二氧化硅为主要原料制成的
D.绿色食品是指不含任何化学物质的食品
25.下列离子方程式书写正确的是
A.少量的金属钠投入水中:2Na+2H2O===2Na++2OH-+H2↑
B.铝片投入稀盐酸中:Al+6H+===Al3++3H2↑
C.氢氧化钡溶液与稀硫酸混合:Ba2++SO42-===BaSO4↓
D.氧化铝溶于烧碱溶液:Al2O3+2OH-===AlO2-+H2O
26.下列反应既属于氧化还原反应,又是吸热反应的是
A.铝片与盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应 D.甲烷在氧气中的燃烧反应
27.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,主要由于维生素C具有
A.酸性 B.碱性 C.氧化性 D.还原性
28.人造地球卫星用到一种高能电池——银锌蓄电池,其电极反应式为:
Zn+2OH—-2e—====ZnO+H2O,Ag2O+H2O+2e—====2Ag+2OH—。据此判断氧化银(Ag2O)是
A.负极,被氧化 B.正极,被还原 C.负极,被还原 D.正极,被氧化
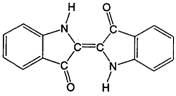 29.历史上最早应用的还原性染料——靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中不正确的是
29.历史上最早应用的还原性染料——靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中不正确的是
A.靛蓝由碳、氢、氧、氮四种元素组成
B.它的分子式是C16H10N2O2
C.该物质是高分子化合物
D.它是不饱和的有机物
30.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|
|
|
|
|
|
|
|
|
|
|
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
|
|
|
|
|
|
|
|
|
|
|
| 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
|
|
|
|
|
|
|
|
|
|
|
试 卷 Ⅱ
二、 填空题
31.检验生石灰里是否含石灰石和石英的方法是:取少许试样,加入过量的______,有_______产生说明生石灰中含有___________,充分振荡后过滤,有滤渣存在说明含______________。
32.在石棉网上点燃硫粉和铁粉的混合物,可见到的现象为________________,生成______色的__________(填名称),该反应的化学反应方程式是________________________。
33. A是第三周期某金属元素的盐。在其溶液中加入适量的氢氧化钡溶液,有大量白色沉淀B生成。过滤除去滤液,将沉淀B加入过量的氢氧化钠溶液中,沉淀B部分溶解。再次过滤,在所得滤液C中逐滴加入稀硫酸,逐渐有白色沉淀D生成,继续滴加稀硫酸,沉淀D又逐渐溶解,所得溶液中含有A。据此
⑴写出A和D的化学式:A__________;D___________。
⑵滤液C中滴加稀硫酸生成沉淀的离子方程式为___________________;继续滴加稀硫酸,沉淀D溶解的离子方程式为____________________。
34.有下列五种酸溶液,A、浓盐酸 B、浓硫酸 C、浓硝酸 D、亚硫酸溶液 E、氢硫酸溶液 ,将它们敞口久置于空气中:
(1)溶液变混浊的是___________________________。
(2)产生白雾的是_____________________________。
(3)溶液变色的是_____________________________。
(4)溶液变质,但无任何现象变化的是_____________________________。
(5)溶液不变质,但质量增加的是_________________________________。
35.在三个烧杯中各盛有100mL3mol/L的盐酸,其中分别加入下列金属:
A.9.2g钠 B.11.2g铁 C.2.7g铝
(1)反应最剧烈的是___________________________。
(2)反应后放出氢气量最大的是_________________。
(3)反应后溶液中有不溶物的是_________________。
(4)反应后溶液中呈碱性的是___________________。
36.写出下列反应的化学方程式:
(1)苯酚溶液中滴加NaOH溶液 。
(2)硫酸铝溶液中加入过量氨水 。
(3)NaHCO3发生水解反应(写离子方程式) 。
37.已知B可以发生银镜反应,D气体密度是氢气的14倍。根据下列图示:
试写出A、B、C的结构简式:A 、B 、C 。
38.已知某无色透明的水溶液中只含有4种离子:
(1)若该溶液中已含有NH4+、Cl—离子,则另2种离子应是 (填离子符号)
(2)该溶液所含的上述4种离子的物质的量浓度之间相对大小的关系可能的是[用符号来表示,如Cl—离子浓度用c(C1—)表示]:
① ;② ;……
(每个空格中填一种情况,有几种情况就填几种)
39.配平下列方程式
___Cu2S + ___HNO3 —— ___H2SO4 + ___NO› + ___Cu(NO3)2 + ___H2O
(2)____SO3![]() +____MnO4
+____MnO4![]() +____H
+____H![]() ——_____ Mn
——_____ Mn![]() +____SO4
+____SO4![]() +____H2O
+____H2O
三、实验题
40.分别除去下列各物质中的杂质,在空白处写出所用试剂的化学式。
(1)除去SiO2中混有的少量CaCO3,可选用试剂 ▲ 。
(2)除去铁粉中混有的少量铝粉,可选用试剂 ▲ 。
(3)除去乙烷中混有的少量乙烯,可选用试剂 ▲ 。
41.为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置
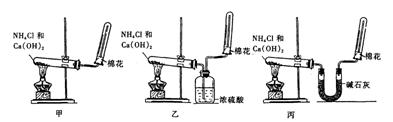
(1)实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”) ▲ 。
(2)写出制取氨气的化学方程式 ▲ 。
(3)如何检验氨气是否收集满(简述操作方法、现象和结论) ▲ 。
三、 计算题
42.L—多巴是一种有机物,它可用于帕金森综合症的治疗。这种药物的研制获得了近两年的诺贝尔化学奖、生理医学奖。经分析,该物质的相对分子质量约为甲烷的12.3倍,其组成元素C、H、O、N的物质的量比为9:11:4:1。试通过计算求出L—多巴的分子式。
43.取一定量的NH4NO3和(NH4)2SO4固体混合物,分成质量相等的两等份。一份与足量的NaOH浓溶液共热,在标准状况下收集到6.72LNH3,;另一份加水完全溶解后,加入过量的BaCl2溶液得到11.65g白色沉淀。试计算:
(1)原固体混合物中(NH4)2SO4的质量。
(2)原固体混合物中氮元素的质量分数。