高考化学预测模拟综合试卷
时量:120分钟 分值:150分
相对原子质量 C 12 H1 O16 N 14 S 32 Cl 35.5 Fe 56 Cu 64
第Ⅰ卷 选择题(共70分)
一、选择题(本大题共26道小题,每题2分,共52分,每小题只有一个选项最符合题意)
1. 近年来,建筑装璜装饰材料进入家庭,调查发现经过装修的居室中由装璜装饰材料缓慢释放出来的化学污染物浓度过高,影响健康。这些污染物中最常见的是( )
A、CO B、SO2 C、甲醛、甲苯等有机物蒸气 D、臭氧
2. 国庆50周年庆典结束时,数万只小气球腾空而起,若从安全角度考虑,气球中不应充H2,而适宜用下列气体中的 ( )
A、N2 B、He C、CH4 D、空气
3、下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是 ( )
A、SO2和SiO2 B、CO2和H2O C、NaCl和HCl D、CCl4和KCl
4. 最近科学界合成一种“二重结构”的球形物质分子,是把足球型C60分子容纳在足球型Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种物质的叙述中,正确的是 ( )
A、是混合物 B、是化合物 C、不含极性键 D、其晶体属于原子晶体
5. 据报道,N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质。下列说法正确的是 ( )
A、N5和N2互为同位素 B、1个18O2中含18个中子
C、原子半径:N<18O D、2N5 = 5N2是化学变化
6.“可燃冰”是水与天然气相互作用形成的晶体,主要存在于冻土层和海底大陆架中,晶体中平均每46个水分子构建成8个笼,每个笼可容纳五个CH4分子或者一个游离H2O分子。若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O填充。由此可判断下列说法中正确的是 ( )
A.“可燃冰”的平均组成为CH4·6H2O
B.“可燃冰”在常温、常压下是一种稳定物质
C.高温、低压有助于可燃冰的形成
D.“可燃冰”的平均组成为CH4·8H2O
7.下列分离方法正确的是 ( )
①用盐析法可以提纯蛋白质 ②用渗析法可以除去淀粉中的NaCl ③用加热法可以除去I2中的NH4Cl ④用重结晶法可以分离KNO3和NaCl ⑤用分液法可以除去苯中的甲苯
A.①②③④ B.①②④⑤ C.②③④⑤ D.①②④
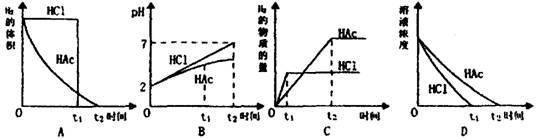
8.在体积均为1L,pH均等于2的盐酸与醋酸溶液中,分别投入0.28g铁,则图中哪组曲线比较符合反应事实 ( )
9.铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝土矿,如Al2O3中。用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为 ( )
A.镓酸酸性强于铝酸 B.铝酸酸性强于镓酸
C.镓浓度小,所以不沉淀 D.Al(OH)3是难溶物
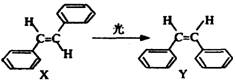 10.1999年诺贝尔化学奖授予具有埃及和美国双重国籍的科学家艾哈迈德·泽维尔,以表彰他使“运用激光技术观测化学反应时分子中原子的运动”成为可能,在他的研究中证实了光可诱发如右所示变化:
10.1999年诺贝尔化学奖授予具有埃及和美国双重国籍的科学家艾哈迈德·泽维尔,以表彰他使“运用激光技术观测化学反应时分子中原子的运动”成为可能,在他的研究中证实了光可诱发如右所示变化:
这一事实可用于解释人眼的夜视功能,有关X、Y的叙述不正确的是 ( )
A、X和Y都可发生加聚反应
B.X和Y是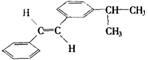 的同系物
的同系物
C.X和Y中所有原子可以处于同一平面
D.X的同分异构体(有两个苯环结构)只有四种
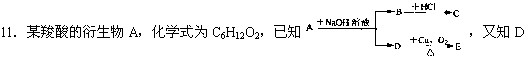 不与Na2CO3溶液反应,C和E都不能发生银镜反应,则A结构可能有 ( )
不与Na2CO3溶液反应,C和E都不能发生银镜反应,则A结构可能有 ( )
A.2种 B.3种 C.4种 D.6种
12.下列操作中,能使电离平衡H2O![]() H++OH-,向右移动且溶液呈酸性的是( )
H++OH-,向右移动且溶液呈酸性的是( )
A、向水中加入NaHSO4溶液 B.向水中加入Al2(SO4),溶液
C.向水中加入Na2CO3溶液 D.将水加热到100°C,使pH=6
13.已知某饱和溶液的:
①溶液的质量 ②溶剂的质量 ③溶液的体积
④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度
从以上条件的组合上,不能用来计算该饱和溶液的物质的量浓度的是 ( )
A.①④⑥ B.④⑤⑥ C.①②③④ D.①③④⑤
14.测定阿伏加德罗常数的实验方法中有一种电解法:以石墨为电极电解CuCl2溶液,当电流为IA,通过时间为t min,阴极增重mg(设一个电子的电量为qC,铜的相对原子质量为M),则阿伏加德罗常数可表示为 ( )
![]()
![]()
![]()
![]()
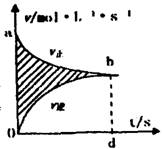
15.在容积固定的4L密闭容器中,进行可逆反应:
X(g)+2Y(g)![]() 2Z(g)并达到平衡,在
2Z(g)并达到平衡,在
此过程中,以Y的浓度改变表示的
反应速率v(正),v(逆)与时间t的关系如右图所示。
则图中阴影部分面积表示 ( )
A.X的浓度的减少 B.Y物质的量的减少
C.Z浓度的增加 D.X物质的量的减少
16.钛和钛合金在航空工业有重要的应用。冶炼钛的过程中发生反应之一是:
TiO2+2C+2Cl2 = TiCl4+2CO。对此,下列说法错误的是 ( )
A、TiO2是氧化剂 B、C是还原剂
C、生成1molTiCl4时,转移电子4mol D、尾气必须净化处理
17. “喷水溶液法”是一种使沙漠变绿洲的新技术,它是先在沙漠中喷洒一定量的聚丙烯酸酯水溶液,水溶液中的高分子与沙土料子结合,在地表下30~50cm处形成一个厚0.5cm的隔水层,既能阻止地下的盐分上升,又有拦截、蓄积雨水的作用。下列对聚丙烯酸酯
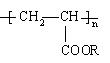 不正确的说法是
( )
不正确的说法是
( )
A、 是由CH2=CH—COOR聚合而成的
B、 是一种分子量很大的有机物
C、 在一定的条件下能发生水解
D、含有n个“C=C”双键
![]() 18. 在一定条件下,向密闭容器中按3:2的体积比充入CO和水蒸气使其反应,当CO+H2O(气) CO2+H2达到平衡时,水蒸气与H2的体积分数相等,则下列叙述中,错误的是
( )
18. 在一定条件下,向密闭容器中按3:2的体积比充入CO和水蒸气使其反应,当CO+H2O(气) CO2+H2达到平衡时,水蒸气与H2的体积分数相等,则下列叙述中,错误的是
( )
A、 平衡时CO的体积分数为40%
B、 平衡时CO的转化率为25%
C、 平衡时水的转化率为50%
D、平衡时混合气体的平均相对分子质量为24
19. 用铂电极电解CuSO4溶液,当溶液中Cu2+浓度降至一定范围时,需加入适量的物质。如果要使加入物质后溶液的浓度和体积恢复到电解前的状况,所加入的物质是
( )
A、CuSO4 B、CuSO4•5H2O C、CuO D、Cu(OH)2
20. 24mL0.05mol/L的Na2SO3溶液,恰好与20mL0.02mol/L的K2Cr2O7 溶液完全反应,则Cr在还原产物中的化合价是 ( )
A、+6 B、+3 C、+2 D、0
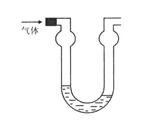 21.双球洗气管是一种多用途仪器,常用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作。下图是用水吸收下列某气体时的情形,根据下面附表判断由左方进入的被吸收气体是
( )
21.双球洗气管是一种多用途仪器,常用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作。下图是用水吸收下列某气体时的情形,根据下面附表判断由左方进入的被吸收气体是
( )
A、Cl2 B、HCl C、H2S D、CO2
附:四种气体的溶解度表(室温下)
| 气体 | Cl2 | HCl | H2S | CO2 |
| 1体积水约能吸收气体体积数 | 2 | 500 | 2.6 | 1 |
22. 下列各组离子在水溶液中能大量共存的是 ( )
A、H+、K+、CO32-、HCO3- B、Na+、Fe3+、Cl-、I-
C、K+、Al3+、NO3-、AlO2- D、K+、Br-、HCO3-、CO32-
23. 在下列各说法中,正确的是 ( )
A、 △H>0表示放热反应,△H<0表示吸热反应
B、 热化学方程式中的化学计量数表示物质的量,可以是分数
C、 1molH2SO4与1molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D、1molH2与0.5molO2反应放出的热就是H2的燃烧热
24. A、B为短周期元素,二者能形成化合物AB2,已知A的原子序数为n,B的原子序数为①n+2 ②n+5 ③n+10 ④n+13 ⑤n-3 ⑥n-6 ⑦n-8 ⑧n+1 其中 ( )
A、①②⑤不可能 B、④⑥不可能 C、⑤⑥不可能 D、都可能
25、将3.48g四氧化三铁完全溶解在100mL1mol/L硫酸中,然后加入K2Cr2O7溶液25mL,恰好使溶液中Fe2+全部转化为Fe3+,Cr2O72-离子全部还原为Cr3+。则K2Cr2O7溶液的物质的量浓度为 ( )
A、0.05mol/L B、0.1mol/L C、0.2mol/L D、0.3mol/L
26、25℃时若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,则下列符合a值的是 ( )
A、3 B、4 C、5 D、6
二、选择题(本大题共6道小题,每小题3分,共18分,每题有不止一个选项符合题意。每小题全对者得3分,其他情况不给分)
27、X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是 ( )
A、X的原子序数比Y的小 B、X原子的最外层电子数比Y的大
C、X的原子半径比Y的大 D、X元素的最高价正价比Y的小
28、下列离子方程式中,正确的是 ( )
A、氨气通入醋酸溶液中:CH3COOH+NH3=CH3COONH4
A、 澄清石灰水跟盐酸反应:H++OH-=H2O
B、 碳酸钡溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑
D、金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑
29、0.03mol铜完全溶于硝酸,产生氮的氧化物(NO、NO2、N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是 ( )
A、30 B、46 C、50 D、66
30、用铁酸钠(Na2FeO4)对未来河湖的淡水消毒是城市饮水处理新技术,下列对铁酸钠用于饮水处理的分析正确的是 ( )
A、Na2FeO4在溶液中显酸性,能消毒杀菌
A、 在Na2FeO4中铁元素显+6价,具有强氧化性,能消毒杀菌
B、 Na2FeO4的还原产物Fe3+易水解产生Fe(OH)3胶体,使水中悬浮物聚沉
D、Na2FeO4还原产物Fe2+水解得Fe(OH)2胶体,使悬浮物聚沉
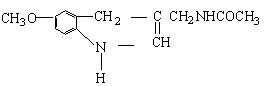 31、脑白金的有效成分结构简式为
31、脑白金的有效成分结构简式为
下列对该化合物的叙述正确的是 ( )
A、它属于芳香烃 B、它属于高分子化合物
C、分子式为C13N2H16O2 D、在一定条件下可以发生加成反应
32、日常所用的干电池的电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2氧化吸收H2),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-=2NH3+H2,根据上述叙述判断下列说法正确的是 ( )
A、 干电池中锌为正极,碳为负极
B、 干电池工作时,电子由锌极经外电路流向碳极
C、 干电池长时间连续工作时,内装糊状物可能流出腐蚀用电器
D、干电池可实现化学能向电能的转化和电能向化学能的转化
第Ⅱ卷 非选择题 (共80分)
三、非选择题(本大题包括10个小题,共80分)
33. 最近开发出的一种新型手机电池,它是以液态甲醇为燃料的燃料电池,它以金属为电极,插入KOH溶液中并发生如下总反应:
2CH3OH+3O2+4KOH=2K2CO3+6H2O
请完成以下问题:
(1)正极反应为: ;
负极反应为: 。
(2)若此燃料电池用于发电,输出电流强度为1A,则每小时消耗CH3OH多少克?(已知阿佛伽德罗常数NA=6.02×1023mol-1,电子的电量e=1.60×10-19C)
34.阅读下列材料:
材料一 2001年9月11日,美国纽约的标志性建筑曼哈顿区世贸中心塔楼被炸毁,带来了一场意想不到的环境灾难:石棉污染。
材料二 美国自“9·11”恐怖事件后,在华盛顿、新泽西、佛罗里达等地相继发生“炭疽邮件”事件,使有些人感染了炭疽热孢子而患炭疽热病。
材料三 大多数种类的炭疽热都对青霉素非常敏感。医生建议:在预防和治疗炭疽热病时应使用青霉素,并配合环丙沙星、强力青霉素等抗生素。
回答下列问题:
 (1)最常见的石棉是钙镁的硅酸盐,已知正硅酸盐阴离子SiO44-为正四面体形,如右图:
(1)最常见的石棉是钙镁的硅酸盐,已知正硅酸盐阴离子SiO44-为正四面体形,如右图:
钙镁硅酸盐链状结构片断如下图:
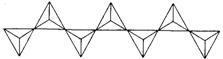
链与连接一个钙离子和三个镁离子组合成一个结构单元,请写出钙镁硅酸盐的化学式: ,并写出该盐氧化物形式的化学式: 。
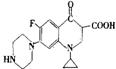
(2)环丙沙星的结构简式如右图所示:
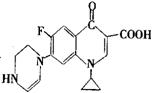
①该物质的分子式为____________________________________________________。
②在通常条件下1mol该物质最多能与_________________molH2加成。
③用一个氯原子代替该物质中碳原子上的一个氢原子,其产物有_____________种。
④写出该物质与CH3CH218OH在催化剂作用下发生反应的化学方程式: 。
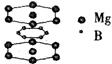
35. 美国《科学》杂志评选的2001年十大科技进展之一是当年科学家发现了一种在接近40K的温度下成为超导材料的硼镁化合物。这种硼镁超导物质的晶体结构单元如右图所示:
(1)试写出这种超导材料的化学式 。
 (2)完成并配平下列化学反应方程式。
(2)完成并配平下列化学反应方程式。
+HCl——B4H10+B+H2+
硼镁超导物质
(3)写出B4H10在空气中燃烧的化学方程式。
(4)假设硼镁超导材料晶体结构中的边长为a cm,棱长为b cm,试求此晶体的密度。
36.金属M可以在不同条件下发生下列五个反应:
M+A→I;M+B→H;M+C→H+F;M+D→H+A;M+E→I+G,其中:
①A、B、C、D在通常状况下都是气体,并知C是CO2;
②上述反应的产物,在不同条件下,还可和有关反应物发生下列反应:F+B→C,G+A→E;
③I是一种离子化合物,它可以水解产生一种白色沉淀和气体E。该白色沉淀加热可分解为H和H2O。而E则是分子晶体,其分子中共有10个电子。
回答下列问题:
(1)在实验室中收集气体E的方法是__________________________________________。
(2)写出I和水反应的化学方程式____________________________________________。
(3)B的化学式是____________________________________________________。
(4)在实验室中,如果要获得干燥纯净的气体A,实验装置设计如图所示:
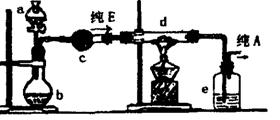 |
在上列装置b中原装的是一种固体物质,当s中的溶液滴入b内反应一段时间后,所得产物经装置c即为纯净气体E;在装置d中原装的是氧化铜,当E通入d时,氧化铜逐渐变为铜,最后从装置e中出来的气体是纯净的A气体。
①a中溶液和b中固体反应的化学方程式是_____________________________________。
②c装置盛放的试剂是______________________________________________________。
③纯净E通过d时反应的化学方程式是________________________________________。
④装置e盛放的试剂是______________________________________________________。
⑤收集干燥气体A的方法是(选a、b或c)____________________________。
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
37. 最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,质量数是85。根据材料回答下列问题:
(1)铷Rb-37位于周期表的第 周期、第 族。
(2)关于铷的结构和性质判断正确的是 。
①与水反应比钠剧烈 ②它的原子半径比钠小 ③它的氧化物暴露在空气中易吸收CO2 ④它的阳离子最外层电子数和镁相同 ⑤它是还原剂
A ①③④ B ②③⑤ C ②④ D ①③⑤
(3)氢化铷与水反应可放出氢气,则下列叙述正确的是 。
A 氢化铷溶于水显酸性 B 氢化铷中氢离子被还原为氢气
C 氢化铷与水反应时,水是还原剂 D 氢化铷中氢离子最外层有两个电子
(4)现有铷和另一种碱金属形成的合金50g,当它与足量水反应时,放出标准状况下的氢气22.4L;这种碱金属可能是 。
A Li B Na C K D Cs
38. 科学家制造出了一种神奇塑料,它能自动愈合自身内部的细微裂纹,即具有自我修复功能,它是由液态二环戊二烯和一种催化剂合成的,试根据以下信息回答有关问题:
信息一:烯烃可以发生双烯合成。
CH2=CH—CH3+CH2=CH2→![]() (简写为
(简写为![]() )
)
信息二:CH2=CH—CH=CH2与HBr反应的化学方程式为:
![]() +HBr→
+HBr→![]() +
+![]()
20% 80%
环戊二烯在双分子合成时一个发生1,2一加成,另一个就发生1,4—加成。
信息三:“![]() ”极不稳定。
”极不稳定。
信息四:![]()
A 二环戊二烯 神奇塑料
问题:(1)写出A和![]() 反应的化学方程式,并指出1mol产物最多能消耗多少克NaOH,写出产物和Cl2发生加成反应的产物的结构简式。
反应的化学方程式,并指出1mol产物最多能消耗多少克NaOH,写出产物和Cl2发生加成反应的产物的结构简式。
(2)写出A→B、B→C的化学方程式,并指出B→C的反应类型。
(3)写出A的所有开链不饱和烃的同分异构体。
(4)科学家看到人的身体受到伤害流血结痂的过程而想到制备出这种神奇塑料,这种原理我们称之为 学。
39. (1)①高空中的氧气受阳光中紫外线照射,通过下面的反应形成臭氧:
a.O2![]() 2O b.O2+O→O3写出以上a、b反应的总方程式。
2O b.O2+O→O3写出以上a、b反应的总方程式。
_______________________________________________________________________________
②人类大量使用“消耗臭氧层物质”(简称ODS),是使臭氧层被破坏的主要原因,其中CFC(氟利昂)的使用是破坏臭氧层的祸首,氟利昂在阳光下可分解产生氯原子,其破坏臭氧的反应式如下:a.O2![]() 2O b.O3+Cl→O2+ClO c.ClO十O→O2+Cl
2O b.O3+Cl→O2+ClO c.ClO十O→O2+Cl
试写出b、c的总反应方程式。
______________________________________________________________________________。
(2)臭氧是一种具有鱼腥味的胆蓝色气体,能使湿润的碘化钾淀粉试纸变蓝,则反应的化学方程式为____________________________________________,反应中还原产物是____________________________________________。
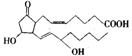 40、野依良治最重要的发现是成功合成了对人的生理起支配作用的激素物质“前列腺素”,有一种可用来治疗“哮喘”的“前列腺素”PGE2(Ⅱ)的结构如右:
40、野依良治最重要的发现是成功合成了对人的生理起支配作用的激素物质“前列腺素”,有一种可用来治疗“哮喘”的“前列腺素”PGE2(Ⅱ)的结构如右:
提示:A ![]() 可以表示为
可以表示为 ![]()
B 碳原子上连有四个不相同的基团时,称该碳原子为手性碳原子,每个手性碳原子会出现两个光学异构体。
根据材料回答下列问题:
(1)写出这种化合物的分子式 。
(2)此化合物含有的官能团有 。
A 羧基 B 醛基 C 酯基 D 酮基
E 羟基 F 酚 G 烯基
(3)1mol此物质和NaOH溶液反应,需NaOH g,如果此物质为液态,1mol该物质耗用金属钠 mol。
(4)该物质分子结构中有 个手性碳原子,有 种不同的光学异构体。
41、以淀粉为原料制取酒精,若有1kg含质量分数为40%淀粉的植物果实,经反应制得227g质量分数为80%的酒精,则淀粉的转化率是多少?
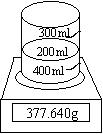
42、下图是测定Na2O2(含Na2O)杂质纯度的实验装置,不同时间电子天平的读数如下表所示:
| 实验操作 | 时间 |
|
| 烧杯 | 370.00 | |
| 烧杯 + 水 + 样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 | |
|
|
|
试计算样品中Na2O2的质量分数,并估算最后溶液的pH。
答案
一、1.C 2. B 3.B 4.B 5.D 6.D 7.D 8.B 9.A 10.D 11.A 12.B 13.A 14.B 15.C 16.A 17.D 18.B 19.C 20.B 21.B 22.D 23.B 24、D 25、B 26、B
二、27、CD 28、BD 29、BC 30、BC 31、CD 32、BC
三、33. (1)正极:6H2O+3O2+12e-=12OH-
负极;2CH3OH+16OH--12e-=2CO32-+12H2O
(2)Q=It=1A×3600s=3.6×103C 电路上通过的电子为n=3.74×10-2mol
![]() =0.2g
=0.2g
34.(1)CaMg3(SiO3)4 CaO·3MgO·4SiO2
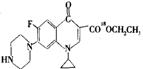
(2)①C17H18O3N3F ②5 ③7 ④
 +CH3CH218OH
+CH3CH218OH![]()
 +H2O
+H2O
35. (1)MgB2
(2)6MgB2+12HCl=B4H10+8B+H2↑+6MgCl2
(3)2B4H10+11O2=4B2O3+10H2O
(4)![]() g·cm-3
g·cm-3
36.(1)向下排空气法 (2)Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(3)O2 (4)①NaOH+NH4Cl=NaCl+NH3↑+H2O ②生石灰或碱石灰
③2NH3+3CuO![]() 3Cu+N2↑+3H2O ④浓硫酸 ⑤c
3Cu+N2↑+3H2O ④浓硫酸 ⑤c
37. (1)5 1A (2)D (3)D (4)A、B
38. (1)![]() +
+![]()
![]()
![]() ,80gNaOH,
,80gNaOH,![]()
(2)![]() +
+![]() →
→![]() ,n
,n![]()
![]()
![]() ,加聚反应
,加聚反应
(3)开链不饱和烃的同分异构体有四种:CH≡C-CH=CH-CH3,
CH≡C-CH2-CH=CH2,CH2=CH-C≡C-CH3,![]()
(4)仿生
39. (1)①3O2 ![]() 2O3, (4分)②O3+O
2O3, (4分)②O3+O![]() 2O2 (4分)
2O2 (4分)
(2)O3+2KI+H2O=2KOH+I2+O2 (4分),KOH(3分)
40.(1)C20H32O5 (2)A、D、E、C (3)40 3 (4)4 16
41、80%
42、92%;14
 天平读数/克
天平读数/克