高考考前辅导化学卷
第Ⅰ卷选择题
1.关于“绿色化学”、“绿色食品”、“白色污染”、“臭氧空洞”、“温室效应”、
2.“非典”、生活中的化学
[例2]过氧乙酸是无色有强烈刺激气味的液体,对皮肤有腐蚀性,对眼睛有强烈刺激作用,温度稍高即分解并放出氧气,可作杀虫刹、杀菌剂。消毒时可用2%过氧乙酸溶液按8 mL•m-3气溶胶的用量喷雾,1小时后通风换气。下列有关过氧乙酸的说法正确的是( D )
A.过氧乙酸溶液浓度过大,杀菌效果越好
B.可以用手直接接触过氧乙酸溶液
![]() C.过氧乙酸性质稳定
C.过氧乙酸性质稳定
D.过氧乙酸的结构简式为
[习题1]亚硝酸钠(![]() )可将人体血红蛋白中的
)可将人体血红蛋白中的![]() 离子转化为
离子转化为![]() 离子,生成高铁血红蛋白而丧失与氧气结合的能力,误食亚硝酸钠中毒,可服维生素C缓解,下列叙述中表现亚硝酸钠和维生素C的性质正确的是 ( B )
离子,生成高铁血红蛋白而丧失与氧气结合的能力,误食亚硝酸钠中毒,可服维生素C缓解,下列叙述中表现亚硝酸钠和维生素C的性质正确的是 ( B )
A.还原性和氧化性 B.氧化性和还原性
C.氧化性和酸性 D.还原性和碱性
[习题2]吸入人体内的O2有2%转化为活性氧(如 ),活性氧能加速人体衰老,目前正尝试用亚硒酸钠Na2SeO3(Se为VIA族元素)消除活性氧。下列说法中不正确的是( C )
A.Na2SeO3溶液的pH>7 B.消除活性氧时,Na2SeO3是还原剂
C.H2SeO4的酸性比H2SO4强 D.H2Se的稳定性比HBr弱
3.诺贝尔化学奖、纳米技术(10-9米)
[例3]在分子结构中的等性氢原子在质子核共振谱(PMR)中都给出相关的信号峰,如乙醛的
结构式为 ,其PMR谱中有两个信号峰,其强度比为3:1,则测定
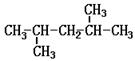 |
的PMR信号峰个数与强度比为( D )
A.7个 3:3:1:2:1:3:3 B.5个 6:1:2:1:3
C.3个 3:1:2 D.3个 6:1:1
4.有机结构官能团(醇与醚、醛与酮、酸与酯、)、同分异构体种数(含有苯环)
[例4].C8H8O2 (含有苯环)属于酯类 6种,属于羧酸类______种,属于醛类 种。
C3H6O2的同分异构体数目有____________种
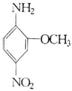 [习题3]2一氨基一5一硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式如右所示。若分子式与红色基B相同,且氨基(
[习题3]2一氨基一5一硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式如右所示。若分子式与红色基B相同,且氨基(![]() )与硝基(
)与硝基(![]() )直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能为( D )
)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能为( D )
A.2种 B.4种 C.6种 D.10种
5.实验药品保存、仪器洗涤、“厨房化学”
[例5]白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成的实验是
①检验自来水中是否含氯离子 ②鉴别食盐和小苏打 ( B )
③蛋壳能否溶于酸 ④白酒中是否含甲醇
A ①② B ①④ C ②③ D ③④
6.化学反应速度与化学平衡(选择或填空)
[例6]将a mol A(g),d mol D(g)置于体积可变的密闭容器中加热至一定温度,发生如下反应:
2A(g) ![]() 2B(g)+C(g),
2D(g)+C(g)
2B(g)+C(g),
2D(g)+C(g) ![]() 2E(g)
2E(g)
t min时建立平衡,平衡时测得B的物质的量为m mol,C的物质的量为n mol,试回答:
(1)平衡时,D的物质的量为 mol(用含d、m、n的代数式表示)
(2)平衡时若温度压强与反应前相同,则反应前和平衡时气体的密度之比为(用含a、d、m、n的代数式表示)__________________________
答案:d+2n-m (a+d+n): (a+d)
7.原电池原理及其应用(选择或填空)
[例7] 烧过菜的铁锅未及时洗涤(残液中含NaCl等),第二天便出现红棕色锈斑[Fe(OH)3失水的产物]。下列反应表示整个过程可能发生的变化,其中不符合事实的是(B)
A.2H2O+O2+4e-====4OH- B.Fe====Fe3++3e-
C.Fe2++2OH-====Fe(OH)2 D.4Fe(OH)2+O2+2H2O====4Fe(OH)3
[例8]一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH====4K2CO3+10H2O,有关此电池的推断正确的是 (C)
A.负极反应为14H2O+7O2+28e-====28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
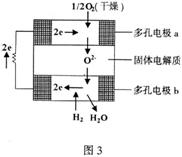 [习题4]固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆
一 氧化钇为电解质,这种固体电解质在高温下允许氧离子(
[习题4]固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆
一 氧化钇为电解质,这种固体电解质在高温下允许氧离子(![]() )在其间通过。该电池的工作原理如图3所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是(D )
)在其间通过。该电池的工作原理如图3所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是(D )
A.有![]() 放电的a极为电池的负极
放电的a极为电池的负极
B.有![]() 放电的b极为电池的正极
放电的b极为电池的正极
C.a极对应的电极反应为![]()
D.该电池的总反应方程式为![]()
[习题5]熔融碳酸盐燃料电池(MCFS),发明于1889年,上世纪的30~60年代在荷兰得到广泛的发展,而且建成了寿命超过40000小时的电池,可应用于中心电站。
现有一个碳酸盐燃料电池,以一定比例Ll2CO3和Na2CO3低熔混合物为电解质。操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2)直接作燃料,其工作原理如图所示。
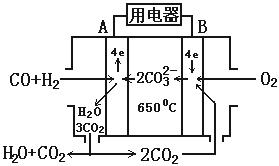 |
请回答下列问题:
(1)B极为 极,发生 (填“氧化”或“还原”)反应,该极发生的电极反应为 ;
|
|
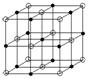 8.晶体结构(离子晶体、原子晶体、分子晶体——纳米)
8.晶体结构(离子晶体、原子晶体、分子晶体——纳米)
[例题]最近,发现了一种由某金属原子M和非金属原子N构成的气态
团簇分子,如右图所示,顶角和面的原子是M原子,棱中心和体心的
原子是N原子,它的分子式为( C )
A.M4N4 B.MN
 C.M14N13
D.条件不够,无法写出分子式
C.M14N13
D.条件不够,无法写出分子式
[例题]如图所示晶体中每个阳离子A或阴离子B,均可被另一种离子以
四面体形式包围着,则该晶体对应的化学式为( A )
A.AB B.A2B C.AB3 D.A2B3
9.计算型选择题:
[例题]有一不纯的铝样品中含有硅和铁两种杂质,现取两份等质量的样品分别与足量的盐酸、氢氧化钠溶液反应,充分反应后生成等质量的气体。已知在常温下,硅可与强碱溶液反应生成硅酸盐和氢气。则此不纯的铝样品中含铁和硅的质量之比为( A )
A.4:1 B.2:1 C.3:1 D.1:1
[习题]已知乙炔、苯、乙醛的混合蒸气中含碳元素的质量分数为84%,则混合物中氢、氧元素的质量分数分别为( C )
A.6%和8% B.8%和10% C.8%和8% D.4%和12%
[习题]向1L 0.4mol•L-1 H2SO4溶液中加入10.1g KNO3和9.6g铜粉,充分反应后产生的气体在标准状况下的体积为( A )
A.2.24L B.3.36L C.4.48L D.5.60L
[习题]在100mL某混合溶液中,c(HNO3)=0.4mol•L-1, c(H2SO4)=0.1mol•L-1,向其中加入1.92gCu粉,微热充分反应后溶液中的c(Cu2+)为(C )
A.0.15mol•L-1 B.0.3mol•L-1 C.0.225mol•L-1 D.无法计算
|
![]() CO2 ≥ NO
CO2 ≥ NO
|
![]() NO2 ≥ NO
NO2 ≥ NO
第Ⅱ卷
一、无机推断题(两种类型 )
1.无机框图推断
N2 ![]() NH3
NH3
![]() NO
NO ![]() NO2
NO2
![]() HNO3
HNO3
Na ![]() Na2O
Na2O ![]() Na2O2
Na2O2 ![]() NaOH
NaOH ![]() Na2CO3
Na2CO3
![]() NaHCO3
NaHCO3
也可以结合到计算题
[例题]有混合气体x,它是由NO、H2、CO2组成,通入足量的Na2O2层后,变成混合气体y,将y用电火花引燃使其充分反应,只得到浓度为70%的HNO3溶液,无其他任何气体,求x中各气体体积之比。 (2∶4∶7)
[习题]在一定条件下可实现如图所示物质之间的变化:
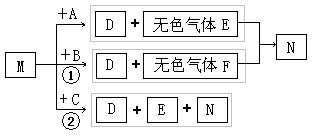
框图中的所有物质均含元素X(不含X的产物已略去)。其中A、B、C、D在火焰上灼烧,其焰色反应均为黄色。单质X为淡黄色固体。
请填写下列空白:
(1)试描述气体E的物质性质 SO2 是无色有刺激性气味的气体,密度比空气大,易溶于水,易液化,有毒 。
(2)元素X是 S ,物质M是 H2SO4 ;
(3)写出下列反应的离子方程式:
反应① S2― + 2H+ ![]() H2S↑
;
H2S↑
;
反应② S2O32― + 2H+ ![]() SO2
+ S↓+ H2O
。
SO2
+ S↓+ H2O
。
2.物质结构与元素周期律
[例题]A、B、C都是短周期元素,原子序数的相对大小为A<B<C,A、B同主族,B、C可形成共价化合物BC4,试回答:
(1)写出BC4的电子式 。
(2)这三种元素对应氢化物的稳定性由强到弱的顺序是 。(用氢化物的化学式表示)
(3)BC4不稳定,遇水易生成B的含氧酸及C的氢化物,近代海战中常采用喷BC4和液氨的方法形成烟幕,有关化学反应的方程式为 。
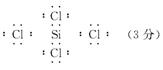
答案:(1)
(2)HCl CH4 SiH4 (3分)
(3)SiCl4+4H2O====4HCl+H4SiO4(3分)HCl+NH3====NH4Cl(3分)
二、实验题
1.基本仪器、基本操作:过滤(一贴、二低、三靠)、蒸发、萃取分液
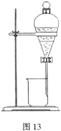 (3)依据图11所示,在萃取操作中应选取的有机溶剂为(多选不给分)_____________;
(3)依据图11所示,在萃取操作中应选取的有机溶剂为(多选不给分)_____________;
A.四氯化碳 B.甲苯 C.乙醇 D.裂化汽油
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是 ____________ ;
如图13所示,待分液漏斗内的混合液分层后,应采取的操作是 __________________________________________________________ ;
(5)加热蒸发溶液D时,除需带有铁圈的铁架台、坩埚钳和火柴外,还必须用到的仪器有 、 、 ;
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是__________________________。
2.装置图
[例题]用下列仪器、药品验证由铜和适量浓硝酸反应的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制)。
已知:①NO+NO2+2OH-====2NO![]() +H2O ②气体液化温度NO2 21℃;NO -152℃
+H2O ②气体液化温度NO2 21℃;NO -152℃
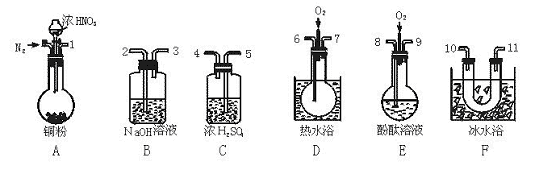
图2—2
试回答:(1)仪器的连接顺序(按由左→右连接,填各接口的编号)为 。
(2)反应前先通入N2,目的是 。
(3)验证反应产生的气体中含NO的现象是 。
(4)装置F的作用是 。
(5)如果O2过量,则装置B中发生反应的化学方程式为 。
答案:(1)1、5、4、10、11、6、7、2(3分,其中10和11可颠倒,错一个即不给分)
(2)驱赶装置中的空气,防止反应产生的NO被氧化(2分)
(3)通入O2后装置D中有红棕色气体生成(2分)
(4)分离NO和NO2(或使NO2液化)(其他合理回答都给分,共2分)
(5)4NO2+O2+4OH-====4NO![]() +2H2O(3分)
+2H2O(3分)
[习题]铜与硝酸在酸浓度不同时生成不同的产物,某课外活动小组为了证明并观察到![]() 铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置。
铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置。
请你根据他们的思路,选择药品,完成该实验,并叙述实验步骤。
药品:稀硝酸、稀盐酸、Zn粒、CaCO3固体
(1)步骤:①检查装置的气密性;② ;③ ;④ ;⑤ ;⑥用注射器向广口瓶内推入氧气(或空气)。
(2)推入氧气或空气的目的是 。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者成绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗?(填“同意”或“不同意”),原因是 ;另一同学提出溶液呈“绿色”是Cu2+与NO2混合的结果,请你设计一个实验证明之(简述实验方案和实验现象) 。
答案:(1)②向试管中加入一定量CaCO3 固体③向试管中倒入过量的稀硝酸,并迅速塞紧带铜丝和导管的橡皮塞④待反应完全后,将右边导管插入试管内接近液面⑤将铜丝插入到溶液中(2)检验生成NO气体(3)不同意 铜片质量相同,溶液体积相同,生成Cu2+ 浓度相同,加热绿色溶液,有红棕色气体产生,溶液变成蓝色。
三、有机推断题(两种类型)
1.有机物燃烧规律
[例题]充分燃烧只含有碳、氢、氧的一类有机物,消耗氧气的体积与生成二氧化碳的体积之比为9:8(相同条件下)。
(1)符合该条件的有机物的通式为 。
(2)若符合该通式的某有机物的相对分子质量为136,则其化学式为 ;若该有机物属于酯类且分子中含有苯环,则其可能的同分异构体有 种,写出其中任意两种的结构简式: ; 。
(3)若符合该通式的有机物相对分子质量为136,令该物质为A,它不能使FeCl3溶液显色,但可以被新制的银氨溶液氧化成B,B能在浓H2SO4存在和加热时,发生分子内的酯化反应生成C,C分子中有一个含氧的五元环,则A的结构简式为 。
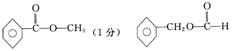 答案:(1)(C2H)n(H2O)m(3分)
答案:(1)(C2H)n(H2O)m(3分)
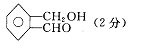 (2)C8H8O2
(2分) 6种 (2分)
(2)C8H8O2
(2分) 6种 (2分)
(3)
[习题]某类有机物CnHxOy完全燃烧需要O2的物质的量为该有机物的n倍,生成CO2
和H2O的物质的量之比为1:1
(1)该类有机物的分子通式为(CnHxOy中的x、y均以n表示) 。
(2)若n=3,写出符合下列条件的物质的结构简式(各一种):
①呈酸性,且能发生缩聚反应: 。
②呈中性,且能发生水解反应: 。
(3)有一种符合此通式的有机物,可以在一定条件下用农作物的秸秆制取,写出反应的
化学方程式(该有机物用结构简式表示): 。
![]()
![]() 答案(1) CnH2nOn (2) ①HOCH2—CH2—COOH(或CH3—CH—COOH)
答案(1) CnH2nOn (2) ①HOCH2—CH2—COOH(或CH3—CH—COOH)
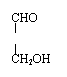 ②H—C—O—CH2—CH2OH(或HO—CH2—C—O—CH3)
②H—C—O—CH2—CH2OH(或HO—CH2—C—O—CH3)
(3) (C6H10O5)n+ n H2O n(CHOH)4
2.有机框图推断 (含醛基)
四、计算题(三种)
1.数据分析、处理;图象分析;范围讨论。
[例题]在标准状况下,取甲、乙、丙各30.0 mL,相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化);
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/Ml | 280 | 336 | 336 |
请回答:
(1)甲组实验中,盐酸(选填“适量”“过量”或“不足量”,下同) ,乙组实验中盐酸 。
(2)盐酸的物质的量浓度为 ;
(3)合金中Mg、Al的物质的量之比为 ;
(4)丙实验之后,向容器中加入一定量1.00 mol·L-1 NaOH溶液,能使合金中的铝粉恰好完全溶解,再过滤出不溶性固体,求所得滤液中各溶质的物质的量浓度(要求写出计算过程)。
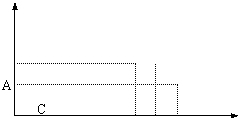 [习题]HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐渐加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量关系如图所示:
[习题]HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐渐加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量关系如图所示:
|
|
 B
B
0 3.0 15 16.5 18.5 V(NaOH)(ml)
请回答:(1)与HNO3反应后Fe元素的化合价是 +3价 。
(2)纵坐标中A点数值是 0.008 mol ,B点数值是 0.016mol 。原HNO3的浓度是 0.72mol/L 。
[习题]a g Mg在盛有b L(标准状况)CO2和O2混合气体的密闭容器中燃烧。
(1)若反应容器中CO2有剩余,则容器内的固体物质中一定含有___________。
(2)若反应后容器中O2有剩余,则容器内固体的质量为___________,此时有b L CO2和O2的混合气体中O2的体积(VO2)必须满足的条件是_______________。
(3)若反应后容器中无气体剩余,则容器内固体物质的质量(m)的取值范围为___________。
答案:(1)MgO(3分) (2)![]() g(3分) b>VO2>
g(3分) b>VO2>![]() a (4分)
a (4分)
(3)(a+![]() ×32)<m<(a+
×32)<m<(a+![]() ×44) (4分)
×44) (4分)