高三第二学期元素化合物检测题
第I卷
(选择题,共72分)
可能用到的原子量:H-1 C- 12 N- 14 O-16 Na-23 Mg-24 S-32 Ba -137
一、选择题(每小题4分,共40分。每小题只有一个选项符合题意。)
1.下列物质中,不属于合金的是
A.硬铝 B.黄铜 C.钢铁 D.水银
2.标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是
A.H2S、SO2 B.O2 C.H2S D.SO3
3.少量下列化学药品应保存在水里的是
A.金属钾 B.白磷 C.硫磺 D.苯
4.等体积硫酸铝、硫酸锌、硫酸钠溶液分别与足量的氯化钡溶液反应。若生成的硫酸钡沉淀的质量比为1︰2︰3,则三种硫酸盐溶液的物质的量浓度比为
A.1︰2︰3 B.1︰6︰9 C.1︰3︰3 D.1︰3︰6
5.某温度下,将C12通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21:5 B. 11:3 C.3:1 D.4:1
6.在含2 mol H2SO4的浓H2SO4溶液中加入足量的Zn粉,使其充分反应,则下列推断中错误的是
①放出的气体中除SO2外还有H2 ②只放出SO2气体,其物质的量为1 mol
③反应结束时转移的电子的总物质的量为4 mol
A.① B.② C.②③ D.①②
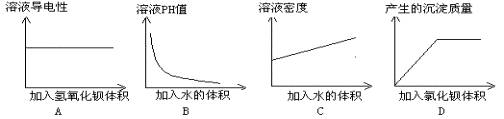
7、某同学在一定量的稀硫酸溶液中加入一定量的其他溶液,并测定有关的实验数值。实验后,将有关实验数据绘制成如下图象,其中正确的是
8.取χg铜和镁的合金完全溶于浓硝酸,若反应中硝酸被还原只产生8960mL的NO2气体和672mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为17.02g,则χ等于
A.8.64g B.9.20g C.9.00g D.9.44g
9.将下列物质分别加入溴水中,溴水颜色不变浅的是
A.KCl晶体 B.H2S气体 C.CCl4 D.Mg
10.由H2、CH4、CO组成的混合物的混合气体a mL,完全燃烧时消耗相同条件下O2的体积也为a mL,则原混合气中CH4的体积分数为:
A.1/3 B.2/3 C.1/2 D.3/5
二、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11、某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种。现将13.8克样品加入足量水,样品全部溶解。再加入过量的CaCl2溶液,得到9克沉淀。对样品所含杂质的正确判断是
A.可能有KNO3 B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3 D.肯定没有Na2CO3和Ba(NO3)2
12. 某无色气体可能含有H2S、SO2、CO2、HI、HCl气体中的一种或几种。将气体通入氯水后,得无色溶液,向该溶液中滴加氯化钡溶液,有白色沉淀产生。则下列叙述正确的是
A.该气体中肯定含有H2S和SO2 B.该气体中肯定含有SO2
C.该气体中肯定含有CO2和SO2 D.该气体中肯定含有H2S、CO2和H I
13.下列各组溶液,不用其它试剂就可以将它们区别开的是
A.盐酸、氢氧化钾、硫酸钾、碳酸钾 B.硝酸钠、盐酸、氯化铵、氢氧化钾
C.氯化钡、氯化钙、硫酸钠、硝酸钾 D.氢氧化钾、碳酸钾、硫酸镁、硫酸氢钾
14.能正确表示下列化学反应的离子方程式是
A.用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C.硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
D.碳酸钙溶于硝酸中:CO32-+2H+=H2O+CO2↑
15、在pH = 1的溶液中,因发生氧化还原反应而不能大量共存的离子组是:
A.Ag+、Ca2+、Cl-、HCO3- B.Fe2+、K+ 、NO3-、Cl-、
C.SO32-、SO42-、Na+、Mg2+ D.K+ 、Na+、S2 - 、SO32-
16、有一铁的氧化物样品,用5 mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标况下0.56L Cl2,使亚铁离子全部变成Fe3+,则该氧化物可能的化学式为
A.Fe2O3 B.Fe3O4 C.Fe4O3 D.Fe5O7
17、有下列四种叙述:①两种酸之间未必都不发生化学反应;②两种碱之间未必都不发生化学反应;③可燃烧的未必都是一些非金属单质或非金属化合物;④含金属元素的离子未必都是阳离子。试判断正确的组合是
A.①②③④ B.①②④ C.①③④ D.②③④
18、1.92g铜投入一定量的浓HNO3中,铜完全溶解,生成的气体颜色越来越浅,共收集到标况下672mL气体。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2恰好使气体完全溶于水中,则通入O2的体积是
A.504mL B.168mL C.224mL D.336mL
第II卷(非选择题,共78分)
三、(本题包括4小题,共46分)
19.(共14分)北京时间10月15日9时42分,我国在酒泉卫星发射中心成功的发射了“神舟”五号载人飞船。这标志着“炎黄子孙千年飞天梦想实现了,中国人的太空时代开始了。”
⑴ 火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
⑵ 火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:N2O4 + N2H4
→ N2 + H2O 。请配平该反应方程式:
————N2O4
+ ————N2H4 → ————N2 + ————H2O
该反应中被氧化的原子与被还原的原子物质的量之比是 。
这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 。
⑶ 为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。
① 写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似):
; 。
② 你选择的供氧剂是: ,原因是: 。
20.(共18分)常温下, A是只含X和Y两种短周期元素的气体,X的原子序数小于Y,甲、乙分别是X、Y元素的单质,丙也是某元素的单质。甲、乙、丙和B、C、D都是常见的物质,他们之间有如下的转化关系,请回答下列问题:
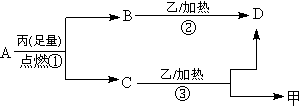
试回答下列问题:
⑴若气体A是纯净物,且X和Y的质量比为1:3,则A的化学式是 (写化学式),它的分子构型是 ,键角是 。
⑵若气体A中X和Y的质量比大于1:3,则气体A中肯定有 (写化学式)。
⑶若气体A的分子为线形结构,且Y和X的质量比在数值上等于Y的相对原子量,则A的化学式为
⑷写出化学式:B C D 甲
⑸仅由X与丙所含元素可以形成两种化合物,它们的电子式分别为 和 。
⑹写出反应①②③中属于置换反应的化学方程式: 。
21.(共10分)在加热氯酸钾的分解反应中,二氧化锰作催化剂的问题,到目前还没有肯定的解释。鉴于制得的氧气中有氯气的气味,生成的氯化钾带紫红色,认为反应过程如下:
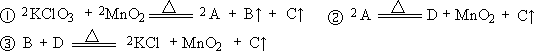 ⑴ 写出 A、B的化学式:A ;B
⑴ 写出 A、B的化学式:A ;B
⑵ 第①步反应中,氧化产物是 ,被还原的元素是 。
⑶ 第③步反应的化学方程式为 。
22.(共6分)在25℃时,若体积为Va、pH=a的某一元强酸与体积为Vb、pH=b的某一元强碱混合,恰好完全中和,且Va<Vb、a = 0.5b。
⑴ a值可否等于3?(填“可”或“否”) 。
⑵ a值可否等于5?(填“可”或“否”) 。
⑶ a的取值范围是 。
四、实验题
23.(共10分)工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI
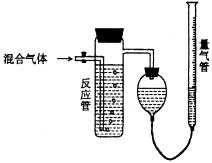 ⑴ 混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
⑴ 混合气体进入反应管后,量气管内增加的水的体积等于 的体积(填写气体的分子式)。
⑵ 反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量 (选填:偏高,偏低,不受影响)。
⑶ 反应管内的碘的淀粉溶液也可以用 代替(填写物质名称)。
⑷ 若碘溶液体积为VamL,浓度为C mol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C、Va、Vb表示SO2的体积百分含量为: 。
⑸ 将上述装置改为简易实验装置,除导管外,还需选用的仪器为 : (选下列仪器的编号)。
a.烧杯 b.双孔塞 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞
五、有机题
24.(共12分)下列A和E都是含两个六元环的有机物,其中A是两个单环,E是一个共碳双环,C的水溶液显两性,环上有两个取代基,其钠盐与碱石灰共热反应后(类似制CH4的反应)则只余下一个取代基。
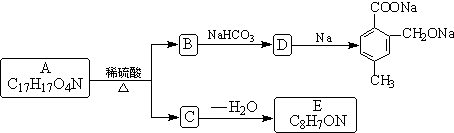
回答下列问题:
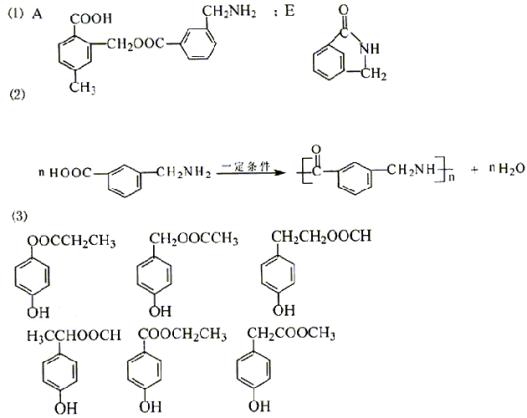
⑴ A的结构简式是 ;E的结构简式是 。
⑵ 在一定条件下C可形成高聚物,其反应的化学方程式是 。
⑶ 和B的分子式相同的只有两个对位取代基且其中一个是酚羟基、另一个含有酯基的同分异构体的结构简式有 。
六、(本题包括1小题,共8分)
25.将8.8 g FeS固体置于200 mL 2.0 mol·L-1的盐酸中,以制备H2S气体。反应完全后,若溶液中H2S的浓度为0.10 mol·L-1,假定溶液体积不变,试计算:
(1)收集到的H2S气体的体积(标准状况)。
(2)溶液中Fe2+和H+的物质的量浓度。
答 题 纸
班级_______姓名_______学号_______
一、二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | C | B | B | D | C | D | B | A | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
| 答案 | B | B | AD | A | BD | D | A | D |
|
|
三、(本题包括4小题,共46分)
19.(共14分)
⑴ B;
⑵ 1N2O4 + 2N2H4 = 3N2
+ 4H2O 2∶1;产物无污染。
⑶ ① 2Na2O2 + 2CO2 = 2Na2CO3
+ O2 ;4KO2+ 2CO2 = 2K2CO3 + 3O2
。
② KO2,原因是:单位质量产生氧气多。
20.(共18分)
⑴ A的化学式是 :CH4,分子构型是:正四面体,键角是:109°28′。
⑵ H2。
⑶ C2H2
⑷ B、CO2 ;C、H2O;D、CO;甲:H2
⑸ ![]()
⑹ C+H2O ![]() CO+H2
CO+H2
21.(共10分)
⑴ A、KMnO4;B、Cl2
⑵ KMnO4、O2; ![]()
⑶Cl2+K2MnO4=2KCl+MnO2+O2
↑
22.(共6分)
⑴否。⑵否。⑶3.5<a<14/3。
四、
23.(共10分)
⑴N2、O2
⑵偏低
⑶酸性高锰钾等
⑷![]()
⑸c b e
五、
24. (共12分)
六、(本题包括1小题,共8分)
25.
⑴1.792L
⑵C(Fe2+)=0.5 mol/ L C(H+)=1 mol/ L