高三第一次模拟考试化学科试卷
可能用到的原子量:N--14 H--1 O--16 C--12 S--32 P--31 Na--23
Ⅰ卷 客观题
一、选择题:(共20小题,每小题3分,每小题有且只有一个选项符合题意)
1、“保护环境,就是保护自己”。目前,在我国城市环境中主要的大气污染物是 ( )
A.SO2、NO2、CO、烟尘 B.CO2、Cl2、N2、酸雨
C.HCl、SO2、N2、粉尘 D.CO2、NO、NH3、雾
2、在NO2被水吸收的反应中,被还原和被氧化的元素的质量比为( )
A.3:1 B.1:3 C.1:2 D.2:1
3、不是构成原电池必需具备的条件是 ( )
A.活泼性不同的两极 B.闭合回路 C.电源 D.电解质溶液
4、一定条件下下列变化不可能通过一步反应实现的是: ( )
A.Na2CO3→Na2SiO3 B.Si→SiO2
C.SiO2→H2SiO3 D.CuSO4→CuCl2
5、下列电子式书写正确的是 ( )
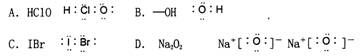
6、下列各项性质的比较中正确的是 ( )
A.稳定性:H2O<H2S<HBr<HCl
B.氧化性:Cu2+>H+>Fe3+>Na+
C.酸性:HClO4>H2SO4>H2PO4>H3AsO4
D.半径:K+>Cl->Al3+>Mg2+
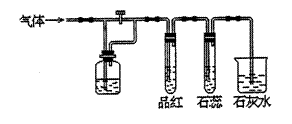 7、如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,石灰水变浑浊,若打开活塞,则品红溶液褪色,石蕊试液变红,石灰水变浑浊.据此判断气体和广口瓶中盛放的物质是 ( )
7、如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,石灰水变浑浊,若打开活塞,则品红溶液褪色,石蕊试液变红,石灰水变浑浊.据此判断气体和广口瓶中盛放的物质是 ( )
A.H2S和浓H2SO4
B.SO2和NaHCO3溶液
C.Cl2和NaHCO3溶液
D.Cl2和氯水
8、下列叙述中,正确的是
A.G4H10的一种同分异构体只能生成一种一氯代物
B.CH3—CH=CH—C≡C—CF3分子结构中6个碳原子不可能都在一条直线上
C.某物质的名称为:2—甲基—3—乙基丁烷
D.制取1,2—二溴乙烷的最合理的方法是乙烯与HBr进行加成反应
9、设NA表示阿伏加德罗常数。下列说法不正确的是 ( )
A.质量均为mg的H2SO4和H3PO4中含有的电子数均为50mNA/98
B.标准状况下,1升辛烷完全燃烧后,所生成气态产物的分子数为8NA/22.4个
C.在1L0.5mol·L-1的Na2CO3溶液中,离子总数一定大于1.5NA个
D.1molH2O2与MnO2充分作用下转移的电子总数为NA个
10、下列实验事实能用同一原理解释的是 ( )
A.SO2、Cl2均能使品红溶液褪色
B.NH4Cl晶体、固态碘受热时均能变成气体
C.苯酚,乙烯均能使溴水褪色
D.福尔马林,葡萄糖与新制的Cu(OH)2共热均有红色沉淀
11、在pH=0无色透明溶液中,因氧化还原反应而不能大量共存的离子组是( )
A.Na+、K+、MnO-4、Cl- B.Cl-、SO2-3、K+、Na+
C.Na+、Cl-、CH3COO-、K+ D.K+、I-、Na+、ClO-
12、A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的是 ( )
A.A和M原子的电子总数之和可能为11 B.A和M的原子序数之差为8
C.A和M原子的最外层电子数之和为8 D.A和M原子的最外层电子数之差为7
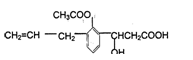 13、有机物的结构简式如右图:则此有机物可发生的反应类型有:
13、有机物的结构简式如右图:则此有机物可发生的反应类型有:
①取代②加成③消去④酯化⑤水解⑥氧化⑦中和 ( )
A.①②③⑤⑥ B.②③④⑤⑥
C.①②③④⑤⑥ D.①②③④⑤⑥⑦
14、对于可逆反应:2SO2+O2![]() 2SO3(气)+Q(Q>0),升高温度产生的影响为 ( )
2SO3(气)+Q(Q>0),升高温度产生的影响为 ( )
A.SO2的转化率提高 B.V正减小,V逆增大
C.V正和V逆不同程度的增大 D.V正和V逆同等程度的增大
15、下列离子方程式书写正确的是 ( )
A.向碳酸氢钠溶液中滴加少量氢氧化钡溶液
2HCO-3+Ba2++2OH-=BaCO3↓+CO2-3+2H2O
B.氢氧化钡溶液与稀硫酸混合:Ba2++SO2-4=BaSO4↓
C.氯气跟水反应:Cl2+H2O=2H++Cl-+ClO-
D.用氨水吸收少量二氧化碳:NH3·H2O+SO2=NH+4+HSO3-
16、向淀粉溶液中加少量稀硫酸,加热使淀粉水解,为测其水解程度,需要的试剂是 ( )
①NaOH溶液 ②银氨溶液 ③新制Cu(OH)2悬浊液 ④碘水
A.④ B.②④ C.①③④ D.③④
17、等物质的量的①Na②Na2O③Na2O2④NaOH,分别与足量水作用后并稀释成相同体积,所得溶液物质的量浓度的说法正确的是, ( )
A.①②③④都不相等 B.①④和②③分别相等
C.②③相等,①④不等 D.①④相等,②③不等
18、下列说法正确的是 ( )
A.0.2mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)
B.向NH4Cl溶液中加入少量氨水,当pH=7时,则混合液中:c(NH4+)=c(Cl-)
C.0.1mol·L-1的Na2S溶液中:c(Na+)=2c(S2-)
D.某溶液的pH为6,则该溶液一定显酸性。
19、用18O标记的CH3CH218OH与乙酸反应制取乙酸乙酯,下列说法不正确的是 ( )
A.18O存在于乙酸乙酯中
B.因为反应是可逆的所以18O有可能出现在乙酸中
C.反应中浓硫酸即是催化剂又是脱水剂
D.若与丙酸反应生成的酯的相对分子质量为102
20、镁橄榄石(MgO·2SiO2)中的阴离子是: ( )
A.SiO32- B.Si2O52- C.SiO44- D.Si4O104-
Ⅱ卷 主观题
二、填空题
21、(3分)由H2SO4、Al2O3、NaOH、Mg、Cl2两两之间可进行反应,可生成正盐。试回答:能生成正盐的化学式有(写六种)
22、(6分)铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。请完成下列各题:
(1)在化学反应中,铜元素可表现为0、+1、+2价。
①铜器表面有时会生成铜绿Cu(OH)2CO3,这层铜绿可用化学方法除去。试写出除去铜绿而不损伤器物的反应的化学方程式:
②新制的铜试剂Cu(OH)2与葡萄糖反应会生成红色沉淀,因此该试剂可用于检验糖尿病人尿液中葡萄糖的含量。葡萄糖的结构简式如下:
CH2OH(CHOH)4CHO(简写为GCHO)
试写出GCHO与Cu(OH)2反应的化学方程式:
(2)铜钱在历史上曾经是一种广泛流通的货币,试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(与铁比较,铜的熔点1183.4℃,铁的熔点1534.8℃)。
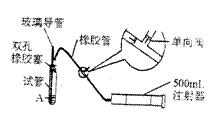 23、(6分)SO2是大气污染物之一,为粗略地
23、(6分)SO2是大气污染物之一,为粗略地
测定周围环境中SO2的含量,某学生课外活动
小组设计了如图所示的实验装置。检验该装置
的气密性,先在试管中装入适量的水(保证玻
璃导管的下端末在水中),然后(填操作方法)
将会看到(填现象) 。
则证明该装置气密性良好。
24、(4分)下列盛放试剂或操作方法,错误的是(填写标号) 。
A、将液溴贮存在带有橡胶塞的玻璃瓶中。
B、用稀硝酸酸化的Ba(N03)2溶液,检验Na2SO3溶液是否变质。
C、用金属锌与稀硝酸作用制氢气,并用向下排空气法收集气体。
D、用分液漏斗进行操作,将H2O和C6H6进行分离。
E、配置500ml的一定物质的量浓度的稀H2SO4溶液时,先往容量瓶中加入一定量的水,然后按计算结果将所需的浓H2SO4用玻璃棒引流注入容量瓶中,再加水至刻度线,摇匀即得。F、配制银氨溶液时,在试管内先取一定量2%的AgNO3溶液,再往试管中滴加2%的氨水,边加边震荡,直至产生的沉淀恰好溶解。
25、(10分)A、B、C、D、E几种常见物质之间有下列转化关系:
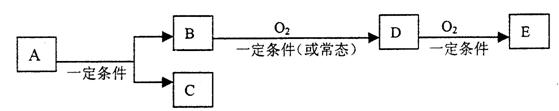
(1)若C是可以用来对自来水进行消毒的单质气体,E是一种易与CO2反应的淡黄色固体,则D的电子式 ,C的化学式 。
(2)若E是酸酐,且为易挥发的晶体,则B的化学式为 ,D是造成 (填一种环境污染的名称)的主要原因。
(3)若C是水,B是无氧有机化合物,其密度在标准状况下为1.25g·l-1,E能使紫色石蕊试液变红色。则A的结构简式是 。
A、B、D、E四种物质中易溶于C的物质有 。
26、(5分)在所给的条件下,推测下列各步化学反应,把所得有机物结构简式填在指定横线上。
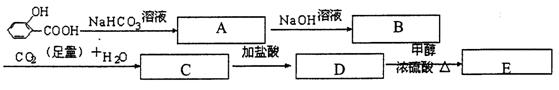
A B D 。
写出D→E的反应的化学方程式
三、计算(6分)
27、将7.5gNa2CO3·10H2O和Na2CO3配制成100ml混合溶液,测得C(Na+)=0.6mol·L-1。
(1)若将等质量的混合物加热到恒重时,残留物的质量是多少?
(2)Na2CO3·10H2O和Na2CO3物质的量各是多少?
高三第一次模拟考试化学科试卷答案
1、A 2、C 3、C 4、C 5、C 6、C 7、B 8、B 9、B 10、D 11、D
12、A 13、D 14、C 15、A 16、C 17、B 18、B 19、BD (选任何一个或二个都可) 20、B
21、(6分每个0.5分)Al2(SO4)3、Na2SO4、MgSO4、NaAlO2、MgCl2、NaCl、NaClO (答六种)
22、(6分)①②方程式略 答对即可给分,每个方程式2分
③铜的化学性质比较稳定,不易被腐蚀(1分);
铜的熔点比较低,容易冶炼铸造成型(1分)
23、(6分)向外轻轻拉动注射器的活塞(3分)
浸末在水中的玻璃管口处有气泡冒出(3分)
24、(4分)ABCE(各1分)
25、(10分)(1)Na+ ![]() 2-
Na+ (2分) Cl2(1分)
2-
Na+ (2分) Cl2(1分)
(2)S或H2S (1分) 酸雨 (1分)
(3)CH3CH2OH(2分)
(4)A D E(3分各1分)
26、(5分)
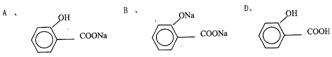
(3分各1分)
方程式略(2分)
27、(6分)(1)3.18g(2分)
(2)Na2CO3·10H2O的物质的量为0.024mol(2分)
Na2CO3的物质的量为0.006mol(2分)