高三化学测试卷6
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。共150分。考试时间120分钟。
说明: 1、请将选择题答案填写在答卷纸上
2、有关相对原子质量:H—1 C—12 O—16 Na—23 S—32 Cl—35.5 Fe—56 Cu—64 Zn—65 N—14 K—39 Ba—137 Ca—40 Mn—55
第I卷(选择题 共72分)
一、 选择题(本题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意)
1、若溶液中由水电离产生的c(H+)=1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A Al3+ Na+ NO3- Cl- B K+ Na+ Cl- NO3-
C K+ Na+ Cl- AlO2- D K+ NH4+ SO42- NO3-
2.实现下列变化时,需克服相同类型作用力的是( )
A 液溴和液汞的气化 B 无色透明的水晶熔化和氯化氢气体溶于水
C 碘升华和水的分解 D 食盐和蔗糖的熔化
3.有两短周期元素x和y,可组成化合物xy3,当y的原子序数为m时,x的原子序数为
(1)m-4 (2)m+4 (3)m+8 (4)m-2 (5)m+6其中正确的组合是( )
A.(1)(2)(4) B.(1)(2)(5)
C.(1)(2)(3)(5) D.(1)(2)(3)(4)(5)
4.氢氧电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。以下有数种说法,正确的组合是( )
(1)负极反应为O2+2H2O+4e-→4OH-
(2)负极反应为2H2+4OH--4e-→4H2O
(3)电池工作时正极区pH升高,负极区pH下降
(4)电池工作时溶液中的阴离子移向正极
A.(2)(3) B.(2)(4) C.(1)(3)(4) D.(1)(4)
5.现将等物质的量的CuSO4、FeCl3、Zn放入盛有水的烧杯中充分反应,所得溶液中除SO42-、Cl-外,还含有的金属阳离子是: ( )
A.Zn2+、Cu2+、Fe3+ B.Zn2+ 、Fe2+、Cu2+、Fe3+
C.Zn2+、Cu2+、Fe2+ D.Zn2+、Fe3+
6.接触法制硫酸的过程中,对废气、水、渣、热的处理正确的是①尾气用氨水处理②污水用石灰乳处理③废渣用来制水泥、炼铁④设置热锅炉产生蒸气、供热或发电( )
A.①②③④都正确 B.只有①②③正确
C.只有②③④正确 D.只有①②④正确
7.下列说法中不正确的是 ( )
①质子数相同的粒子一定属于同种元素
②同位素的性质几乎完全相同
③质子数相同、电子数也相同的粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥某种元素的相对原子质量取整数,就是其质量数
A ①②④⑤ B ③④⑤⑥ C ②③⑤⑥ D ①②⑤⑥
8. 若某池(电解池或原电池)的总反应离子方程式是:Cu+2H+=== Cu2+ +H2↑,关于此池的有关说法正确的是 ( )
A 该池可能是原电池,也可能是电解池
B 该池只能是原电池,且电解质溶液为硝酸
C 该池只能是电解池,且金属铜为该电解池的阳极
D 该池只能是电解池,电解质溶液可以是硝酸
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确的答案只包括一个选项,多选时,该题为0分;若正确的答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题为0分)
9、下列离子方程式中正确的是 ( )
A 二氧化硫气体通入到漂粉精溶液中
Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
B 硫氢化钠溶液中滴入几滴硫酸铜溶液
Cu2++HS-==CuS↓+H+
C 向氢氧化钡溶液中加入少量硫酸氢铵溶液
Ba2++OH-+H++SO42-==BaSO4↓+H2O
D足量的CO2通入饱和碳酸钠溶液中
CO2+CO32-+H2O=2HCO3-
10.设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,22.4LCO2与CO的混合气体中约含有碳原子数为NA
B.活泼金属与盐酸反应,每放出1molH2,其电子转移的数目为NA
C.在常温常压下,1mol氩气含有的原子数为2NA
D.常温常压下,22.4LN2所含有的分子数多于NA
11. 在理论上可用于设计原电池的化学反应是 ( )
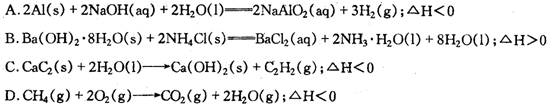
12.在一恒定的容器中充入2molA和1 mol B发生反应:2A(g)+B(g) x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:
0.6mol、 B:0.3mol 、 C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为( )
A.4 B.3 C.2 D.1
13.化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是( )
A. 定性检验SO32-,将BaCl2溶液用HNO3酸化
B. 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C. 检验溶液中是否含有Fe2+时,用硝酸酸化
D.检验溶液中是否含有SO42-时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液
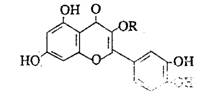 14.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是( )
14.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述错误的是( )
A. 可和溴水反应
B. 可用有机溶剂萃取
C. 分子中有三个苯环
D.1mol维生素P可和4molNaOH反应
15.常温下10mLpH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是( )
A.C(A-)=C(k+) B.C(H+)=C(OH-)<C(k+)<C(A-)
C.V总≥20mL D.V总≤20mL
16、K35ClO3晶体与H37Cl浓溶液反应,生成氯气、氯化钾和水,此反应生成的这种氯气的摩尔质量为 ( )
A 74g/mol B 73.3g/mol C 72 g/mol D 70.6g/mol
17. 某稀溶液中含有Fe(NO3)3 、Cu(NO3)2 、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为 ( )
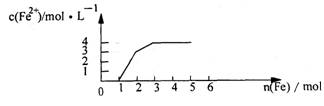 A 1:1:1
A 1:1:1
B 1:3:1
C 3:3:8
D 1:1:4
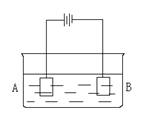
18 按如图装置进行电解实验:A极是铜锌合金,B极为
纯铜,电解质中含有足量的铜离子。通电一段时间后,
若A极恰好全部溶解,此时B极质量增加7.68g,溶
液质量增加0.03g,则合金中Cu、Zn原子个数比为( )
A 4:1 B 3:1 C 2:1 D 任意比
第II卷(非选择题 共78分)
三、(本题包括2小题,共16分)
19.(6分)某同学在实验室里进行下列实验操作,其中有错误的是(填写字母代号)_________
A.用食指顶住容量瓶瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动以使溶液混合均匀。
B.用玻璃棒把固体物质从蒸发皿中转移到滤纸上
C.用已用蒸馏水润湿的pH试纸测定盐酸的pH
D.用玻璃棒蘸取少量K2CO3溶液作焰色反应实验
E.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加浓硫酸
|
![]() 20.(14分)实验室中根据2SO2+O2
2SO3 △H=-196.6kJ,设计如图所示的实验装置来制备SO3固体
20.(14分)实验室中根据2SO2+O2
2SO3 △H=-196.6kJ,设计如图所示的实验装置来制备SO3固体
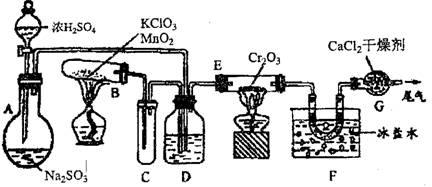
请回答下列问题:
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)______________________
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用________________________________________________________________________。
(3)小试管C的作用是_________________________________________________________
(4)广口瓶D内盛的试剂是_______________装置D的三个作用是:
①_________________________________________________________________________
②________________________________________________________________________
③________________________________________________________________________
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防止温度过高,这样做的原因是___________________________________________________________________
(6)装置F中U形管内收集到的物质的颜色、状态是___________________________
(7)装置G的作用是________________________________________________________
(8)从G装置导出的尾气的处理方法是用________________________________________
四、(本题包括3小题,共16分)
21、配平下列离子方程式,并回答问题:
(1) Fe(OH)3 + ClO- + OH- —— FeO4n- + Cl- + H2O
(2)若有3.21gFe(OH)3参加反应,共转移了5.42×1022个电子,则n= ,FeO4n-中铁的化合价为 。
(3)试推测FeO4n-能与下列哪些物质反应(填序号) 。
A Cl2 B SO2 C H2S D O2
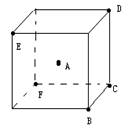 22.如图所示的正立方体中有A~F六个点,其中点A处于立方体的中心,点B~F均处于立方体的顶点,请从A~F六个位置中选择合适的位置,放置相应的原子模型来表示CO2和CH4的分子空间构型。
22.如图所示的正立方体中有A~F六个点,其中点A处于立方体的中心,点B~F均处于立方体的顶点,请从A~F六个位置中选择合适的位置,放置相应的原子模型来表示CO2和CH4的分子空间构型。
(1) 点放置碳原子, 点放置氧原子,可表示CO2的分子空间构型。
(2) 点放置碳原子, 点放置氢原子,可表示CH4的分子空间构型。
(3)写出CO2和CH4的电子式 、 。
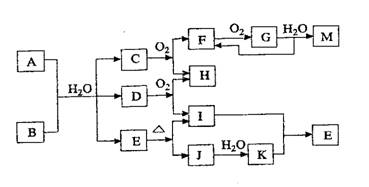 23.(12分)已知A为酸式盐,B为某二价主族金属的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量水充分混合能恰好完全反应。图中反应条件均已略去。
23.(12分)已知A为酸式盐,B为某二价主族金属的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量水充分混合能恰好完全反应。图中反应条件均已略去。
(1)写出B电子式____________________________D的结构简式______________________
(2)写出A与B反应的化学方程式_________________________________________________
(3)如对气体G进行降温加压操作,产生的现象是_________________________________
发生反应的化学方程式是_________________________________________________________
(4)写出A溶液分别与M、NaOH溶液反应的离子方程式:
①在A溶液中加入M___________________________________________________________
②向A溶液中加入过量NaOH浓溶液,并加热____________________________________
五、(本题包括2小题,共20分)
24.(8分)有机物A和B无论以何种比例混合,其组成的混合物中所含的原子的核外电子总数均不变。
(1)若A是分子中含有8个氢原子的烃,B是分子中含有3个碳原子的烃的含氧衍生物。写出两组符合上述要求的有机物的分子式:
①相对分子质量之差为2:A:__________________B:_______________________
②相对分子质量相等: A:___________________B:_____________________
(2) 若A是分子中含有4个碳原子的烃,B是饱和链烃的一元含氮衍生物,则A分子式为______________________,B分子式为_______________________;符合B分子式的同分异构体有_____________________种。
25.(12分)已知:
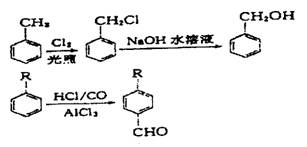
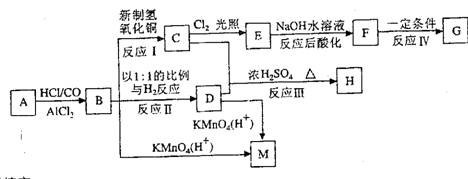 从A出发可发生下图所示的一系列反应,其中G为高分子化合物,化合物B的分子式为C8H8O,当以铁为催化剂进行氯化时一元取代物只有两种。
从A出发可发生下图所示的一系列反应,其中G为高分子化合物,化合物B的分子式为C8H8O,当以铁为催化剂进行氯化时一元取代物只有两种。
请填空:
(1)结构简式:A__________________________ M_________________________
(2)反应类型:I____________________________ IV___________________________
(3)写出下列反应的化学方程式:
B→C_________________________________________________________________
C+D→H_______________________________________________________________
(4)与C互为同分异构体且均属于酯类的芳香族的化合物共有_______________ 种
六、(本题包括2小题,共18分)
26.为了测定血液中钙离子的含量,取5mL血液样品,稀释成50mL,从中取出10mL,加入过量草酸钾(K2C2O4)溶液,使钙离子完全转化成草酸钙沉淀。滤出并洗净所得草酸钙沉淀,用过量稀硫酸溶解,生成草酸和硫酸钙稀溶液。往溶液中加入10mL
0.0020mol/L的KMnO4溶液,使草酸完全被氧化,再用FeSO4溶液滴定过量的KMnO4溶液,当KMnO4溶液的紫红色刚好褪去时,消耗0.010mol/L的FeSO4溶液8.9mL。已知KMnO4溶液和草酸、FeSO4溶液的反应可表示为(未配平): MnO![]() +H2C2O4+H+®CO2+Mn2++H2O
+H2C2O4+H+®CO2+Mn2++H2O
MnO![]() +Fe2++H+®Fe3++Mn2++H2O
+Fe2++H+®Fe3++Mn2++H2O
求血样中钙离子的含量(以100mL血液中含钙离子多少克表示)。
27.(10分)现有等物质的量的NaHCO3和KHCO3的混合物a g 与100mL盐酸反应,题中涉及的气体体积均以标准状况计,填空时可以用带字母的分式表示
(1)该混合物中NaHCO3和KHCO3的质量比是___________________________
(2)如碳酸氢盐和盐酸恰好完全反应,则盐酸的物质的量浓度为________________________
(3)如盐酸过量,生成CO2体积为______________________________________________
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道______________________________________________________________________________
(5)若NaHCO3和KHCO3不是以等物质的量的混合,则a g 混合物与足量的盐酸完全反应时生成CO2的体积范围是____________________________________________________