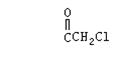高考第一次科目教学质量检测化学试题
可能用到的相对原子质量:H 1 C 12 I 127 O 16 K 39
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.2003年2月1日美国哥伦比亚号航天飞机在空中解体失事,有专家分析认为,飞机空中解体的最大可能原因是航天飞机机壳底部的石墨瓦在空中脱落,击中机翼。航天飞机表面覆盖石墨瓦,主要是利用石墨 ( )
A.具有导电性、防辐射 B.密度小,减轻机身重量
C.熔点高、化学性质稳定 D.硬度小,有润滑作用
2.生活中碰到的某些问题常常涉及到化学知识,下列叙述不正确的是 ( )
A.变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应
B.家用消毒发生器其原理是用石墨作电极电解饱和氯化钠溶液,制得有较强杀菌能力的消毒液
C.血液是由血球在血浆中形成的胶体,因而肾功能衰竭的病人血液中的毒素可以通过透析的方法除去
D.蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打溶液或氨水
3.以下关于碳族元素的性质叙述错误的是 ( )
A.碳单质(金刚石)和硅单质(晶体硅)的结构相似
B.碳的氧化物(CO2)和硅的氧化物(SiO2)的结构相似
C.碳的含氧酸(H2CO3)和硅的含氧酸(H2SiO3)结构相似
D.碳的氢化物(甲烷)和硅的氢化物(硅烷)结构相似
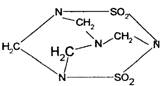
4.2002年9月14日南京汤山发生了一起震惊全国的特大投毒案,犯罪分子在食品中投入了毒鼠剂—毒鼠强,导致多人中毒死亡;已知毒鼠强的结构简式如右图,有关毒鼠强(化学名:四亚甲基二砜四胺)的下列相关说法正确的是 ( )
|
B.毒鼠强属于烃
C.毒鼠强分子内含SO2分子因而具有毒性
D.毒鼠强的分子式为C4H8N4S2O4
5.科学界拟合成一种“双重结构”的球形分子,即把足球烯C60分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列有关叙述正确的是 ( )
A.该反应属于置换反应 B.该晶体属于原子晶体
C.该物质具有极高的熔沸点 D.该物质是一种新型化合物
6.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是( )
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数一定是m±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
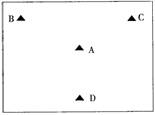
7.A、B、C、D四地的地理位置如右图所示,交通均较为便利,其它的地理条件如下:
|
B地是硫酸消费中心
C地有较为丰富黄铁矿资源
D地有少量的硫酸消费
根据以上信息,在硫酸厂厂址的选择时应选择( )
A.A地 B.B地 C.C地 D.D地
8.加氟牙膏是含有微量氟化物的添加剂,可防止龋齿,长期使用加氟牙膏在牙齿表面生成了一层质地坚硬、溶解度小的氟磷酸钙。其化学式为CaxFy(PO4)z,已知x、y、z都是奇数,其中x等于5。1 mol CaxFy(PO4)z中含有氟离子的物质的量为 ( )
A.4mol B.3mol C.5mol D.1mol
二、选择题(每小题只有一个选项符合题意,每小题3分,共24分)
电子工业使用的印刷线路板,是在敷有铜膜的塑料板上以涂料保护所需的线路,然后
用FeCl3的溶液与未受保护的铜膜反应去掉铜,腐蚀后的废液中含有大量的Cu2+。为了回收这一部分Cu2+并制成硫酸铜晶体(CuSO4·5H2O),常用如下步骤:
①向废液中加过量的铁屑,搅拌,静置; ②滤出固体物质;
③将滤出的固体物质加热煅烧; ④把煅烧后的物质放在硫酸中溶解;
⑤调节溶液的pH值到3.4—4,使Fe(OH)3沉淀完全、过滤;
⑥浓缩滤液,析出晶体; ⑦将过滤得到的晶体溶解,再结晶。
9.上述③步操作所得煅烧产物成分是 ( )
A.CuO B.CuO和FeO
C.Fe2O3 D.CuO和Fe2O3
10.上述第⑤步操作中,调节溶液的pH宜加入的物质是 ( )
A.氧化铜粉末 B.NaOH溶液 C.稀氨水 D.Na2CO3
11.上述⑥步操作中,用浓缩滤液而不用蒸干溶液的主要原因是 ( )
A.蒸干所得到的物质可能含有无水硫酸铜
B.温度升高CuSO4溶解度增大
C.温度升高,Cu2+水解完全,得到Cu(OH)2
D.温度升高CuSO4分解
12.燃烧lg乙炔(C2H2)生成二氧化碳和液态水,放出热量50kJ,则这一反应的热化学反应方程式为 ( )
A.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=+50kJ/mol
B.C2H2(g)+5/202(g) 2CO2(g)+H2O(l);△H=-1300kJ
C.2C2H2+5O2 4CO2+2H2O;△H=-2600kJ
D.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2600kJ/mol
13.下列反应的离子方程不正确的是 ( )
A.Ca(ClO)2溶液中通过量的CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.FeSO4溶液中加H2O2:4Fe2++2H2O2+4H+=4Fe3++4H2O
C.用氨水吸收过量的SO2:NH3·H2O+SO2=NH+4+HSO-3
D.Fe(NO3)3溶液中加过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH+4
14.在相同条件下(T=500K),相同体积的甲、乙两容器中,甲充入1gSO2、1gO2,乙充入2gSO2、2gO2,下列叙述中错误的是 ( )
A.化学反应速率:乙>甲 B.SO2转化率:乙>甲
C.平衡后O2浓度:乙>甲 D.平衡后SO2的体积分数:乙>甲
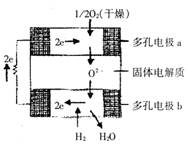
15.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。
它以固体氧化锆—氧化钇为电解质,这种固体电解
|
池的工作原理如右图所示,其中多孔电极a、b均
不参与电极反应。下列判断正确的是 ( )
A.有O2进入发生反应的a极为电池的负极
B.有H2进入发生反应的b极为电池的正极
|
D.该电池的总反应方程式为:2H2+O2 2H2O
16.向Cr2(SO4)3的水溶液中,加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO-2)。其平衡关系如下:
![]()
![]() Cr3++3OH-
Cr(OH)3
CrO-2+H++H2O
Cr3++3OH-
Cr(OH)3
CrO-2+H++H2O
(紫色) (灰绿色) (亮绿色)
向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入1.0mol·L-1的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为 ( )
A.溶液为紫色 B.溶液中有灰绿色沉淀
C.溶液为亮绿色 D.无法判断
三、(本题包括3小题,共20分)
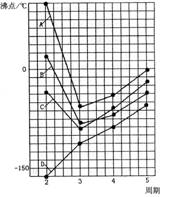
|
曲线 ;表示ⅣA族元素气态氢化物沸点的
是曲线 ;同一族中第3、4、5周期元素的
气态氢化物沸点依次升高,其原因是 ;A、
B、C曲线中第2周期元素的气态氢化物的沸点显著高
于第3周期元素气态氢化物的沸点其原因是 。
18.(5分)已知某溶液中只存在OH-、H+、CH3COO-、
Na+四种离子,某同学推测其离子浓度大小顺序有如下
四种关系:
①c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
②c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
④c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填编号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则
混合前两溶液的物质的量浓度大小关系为c(NaOH) c(CH3COOH)
(填大于、小于或等于,下同),混合前酸中c(H+)和碱中c(OH-)的关系是
c(H+) c(OH-)。
19.(7分)据下列信息完成所需回答的问题:
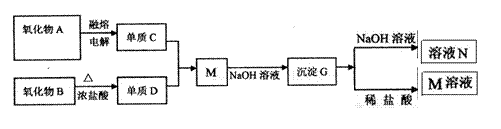 |
其中氧化物A是白色固体;氧化物B是黑色固体;单质C不溶于冷、浓硝酸。
(1)D是 ;G是 (填化学式)
(2)元素C位于周期表中第 周期 族。
(3)写出下列反应的离子方程式
B+浓盐酸
G+NaOH溶液
(4)单质C不与冷、浓硝酸的反应的原因是
四、(本题包括2小题,共16分)
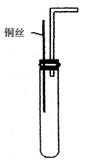
20.(8分)铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同。
某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置。实验步骤如下:
|
②向试管中加入一定量碳酸钙固体;
③向试管中倒入过量的稀硝酸,并迅速盖上带铜丝和导管的橡皮塞
④待反应完全后,将导管插入试管内接近液面
⑤将铜丝插入到溶液中
⑥用注射器向试管内推入氧气(或空气)
请回答下列问题:
(1)实验中辊入CaCO3的作用是 。
(2)实验中推入氧气或空气的目的是 。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异的结果,你同意这种看法吗? (填“同意”或“不同意”),原因是 ;另一同学提出溶液呈“绿色”是Cu2+与NO2混合的结果,请你设计一个实验证明之(简述实验方案和实验现象) 。
21.(8分)乙二酸(HOOC—COOH)俗称草酸,其主要物理常数如下:
| 名称 | 分子式 | 颜色、状态 | 溶解性(g) | 熔点(℃) | 密度 (g/cm3) |
| 乙二酸 | H2C2O4 | —— | 8.6(20℃) | 189.5 | 1.900 |
| 二水合乙二酸 | H2C2O4·2H2O | 无色晶体 | —— | 101.5 | 1.650 |
注:表中“——”是尚未有具体数据。
回答下列问题:
(1)向盛有Na2CO3粉末的试管里加入约3mL乙二酸溶液,观察到的现象为 ;
说明乙二酸的酸性比碳酸 。
(2)向盛有5mL乙二酸饱和溶液的试管中滴入3滴硫酸酸化的0.5%(质量分数)的KMnO4溶液,振荡,观察到现象为 ;说明乙二酸有 。
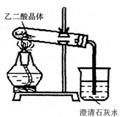
|
|
+CO↑。为了验证草酸受热分解及其产物,用右图装置进行
实验,加热草酸晶体,有人认为该装置不合理。请你根据草
酸晶体的某些物理常数和实验目的,指出用该装置进行实验
可能存在的四个不合理的主要原因。
答:① ②
③ ④
五、(本题包括2小题,共12分)
22.(6分)2000年10月10日,诺贝尔化学奖授予美国科学家艾伦·黑格、艾伦·马克迪尔米德和日本科学家白川英树,以表彰他们有关导电聚合物的发现。他们研究发现:经过改造后的塑料能够像金属一样表现导电性能。以聚乙炔为例,要使其能够导电,必须用I2或Na等做掺杂处理,他们用碘做的掺杂实验通式如下:
[CH]n+![]() I2→[CH]
I2→[CH]![]() +xI
+xI![]()
回答下列问题:
(1)聚乙炔的碳链结构片段可表示为 ( )
A.—C≡C—C≡C—C≡C— B.—C=C—C=C—C=C—
C.=C=C=C=C=C=C= D.—C=C—C≡C—C=C—C≡C—
(2)下列叙述正确的是 ( )
A.这种可导电的塑料是一种纯净物,有固定的熔、沸点
B.掺杂后的聚乙炔所以可导电,是因为它具有类似盐的结构
C.聚乙炔和碘的掺杂反应中,聚乙炔被还原
D.聚乙炔经掺杂反应后,分子内碳链结构未发生变化
(3)试写出用钠做掺杂实验的通式
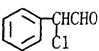
|
|
(1)苯氯乙酮不可能具有的化学性质是: (填序号)。
A.加成反应 B.取代反应 C.消去反应 D.水解反应 E.银镜反应
(2)与苯氯乙酮互为同分异构体,且能发生银镜反应,分子有苯环但不含—CH3的化合
物有多种,请举出两例,写出它们的结构简式:(这两例分子内必须含有不同的基
因)
六、(每题包括2小题,共12分)
24.(6分)为了预防碘缺乏病,国家规定每千克食盐中应含有40—50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的Na2S2O3溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:IO3-+5I-+6H+=3I2+3H2O;I2+2S2O32-=2I-+S4O62-
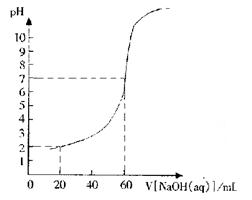
25.(6分)20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如右图所示。
|
(2)求盐酸的物质的量浓度。
参考答案
一、选择题(每小题只有一个选项符合题意,每小题2分,共16分)
1.C 2.A 3.B 4.D 5.D 6.C 7.B 8.D
二、选择题(每小题只有一个选项符合题意,每小题3分,共24分)
9.D 10.A 11.A 12.D 13.A 14.D 15.D 16.C
三、(本题包括3小题,共20分)
17.(8分)A;D; 同族元素的氢化物分子量越大,分子间作用力越大,沸点越高;H2O、
HF、NH3分子间存在氢键,使分子间用作力显著增大,因而沸点显著升高(每空2分)
18.(5分)(1)醋酸钠 (2)醋酸和醋酸钠 (3)小于,小于(每空1分)
19.(7分)(1)Cl2;Al(OH)3 (2分) (2)三,ⅢA(2分)
(3)MnO2+4H++2HCl-——Mn2++Cl2↑+2H2O(1分)
Al(OH)3+OH-=AlO2-+2H2O(1分)
(4)铝遇到冷浓硝酸钝化(1分)
四、(本题包括2小题,共16分)
20.(8分)
(1)和硝酸反应产生的CO2气体可将试管内的空气排出(2分)
(2)检验生成的NO气体(2分)
(3)不同意(1分);铜片质量相同,溶液体积相同,生成的Cu2+离子浓度相同(1分)
加热绿色溶液,有红棕色气体产生,溶液变成蓝色(2分)。(其它合理的方法如向
溶液中通入CO2↑将溶液的NO2气体驱走,溶液变蓝色等均可参照给分)
21.(8分)
(1)有无色气体放出(1分);强(1分)
(2)溶液乃呈无色或溶液紫红色褪去(1分);还原(1分)
(3)(每答出一个正确的原因给1分,答到4个就给满分)
①草酸晶体的熔点低,未分解之前就已熔化并流到试管中,不能完成分解实验。
②该装置只能检验一种水解产物(CO2),不能检验是否有其它分解产物。
③在未洗气的情况下通入石灰水,还可能因草酸蒸气与石灰水反应生成了草酸钙沉淀,对实验有干扰。
④生成的CO未能除去,会污染空气
⑤乙二酸晶体含有结晶水,因而加热后无法证明草酸的分解产物中含水
五、(本题包括2小题,共12分)
22.(6分)(1)B (2)D (3)[CH]n+xNa→[CH]![]() +xNa+(每空2分)
+xNa+(每空2分)
23.(6分)(1)C、E (2分)
(2)结构简式如下,写出邻、间、对位异构体均可,但必须有不同基团的两种,每写对一个给2分,只要写出其中两个就给满分。
| ||||
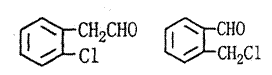 | ||||
六、(每题包括2小题,共12分)
24.(6分)
解:I2+2S2O![]() →2I-+S4O
→2I-+S4O![]()
![]() (1分)
(1分)
![]()
![]() (2分)
(2分)
每千克食盐中含KIO3
(214×0.09×10-3/428)×1000=45×10-3(g)=45(mg)(2分)
∴该加碘食盐是合格的 (1分)
25.(6分)
解:(1)![]()
![]() (3分)
(3分)
(2)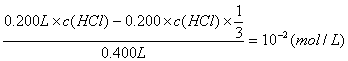
![]() (3分)
(3分)