高考化学备考统测题
高考化学备考统测题
注意事项:
可能用到的原子量:H 1 C 12 N 14 O 16 S 32 Cu 64 Ca 40
第I卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意。)
1.维生素C(C4H8O6)主要存在于蔬菜和水果之中,它能促进人体生长发育,增强人体对疾病的抵抗力。下列关于维生素C的说法正确的是
A.维生素C是氧化物
B.维生素C由4个碳元素﹑8个氢元素﹑6个氧元素组成
C.维生素C中C﹑H﹑O三种元素的质量比为9:1:12
D.青少年应该多吃水果,切忌偏食
2.有的科学家提出硅是“21世纪的能源”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不正确的是
A.自然界硅的贮量丰富
B.自然界中存在大量单质硅
C.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
D.硅燃烧产物对环境污染程度低,容易有效控制
3.最近意大利科学家使用普通氧分子和带正电的氧离子制造出了含四个氧原子的新型氧分子。若该氧分子具有空间对称结构,你认为该氧分子是
A.臭氧的同素异形体 B.元素的一种同位素
C.一种新的氧化物 D.可能是由极性键构成的分子
4.下列关于实验室制取气体所用试剂的组合不合理的是
A.制H2:H2SO4(稀)、Zn B.制CO2:H2SO4(稀)、CaCO3
C.制O2:MnO2、H2O2 D.制C2H2:CaC2、H2O
5.下列各项叙述中一定能说明元素X的非金属性比元素Y的非金属性强的是
A.X的最高正价比Y的最高正价大
B.气态氢化物溶于水后的酸性,X大于Y
C.X的单质能与Y的氢化物反应生成Y单质
D.在反应中,X原子比Y原子得到的电子数少
6.下列反应,其产物的颜色按红、黄、蓝、紫色的顺序排列的是
①硝酸银溶液中滴入碘化钾溶液 ②硫酸铁溶液中滴入苯酚溶液
③FeCl3溶液中滴入KSCN溶液 ④无水硫酸铜粉末放入医用酒精中
A.③②①④ B.②③①④ C.③①④② D.①②③④
7.氢氧化铯是一种可溶性碱,其化学式为CsOH,则下列叙述正确的是
A.CsOH溶液的pH小于7 B.CsOH溶液能使酚酞溶液变红
C.CsOH加热可得到Cs2O+H2O D.CsOH与硫酸反应生成CSSO4
8.下列说法中不正确的是
①质子数相同的粒子一定属于同种元素; ②电子数相同的粒子不一定是同一种元素;
③一种元素只能有一种质量数; ④某种元素的相对原子质量取整数,就是其质量数。
⑤质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;
⑥同位素的性质几乎完全相同;
A.①③④⑥ B.①②④⑤ C.②③⑤⑥ D. ②⑤
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.可以用来判断醋酸属于弱电解质的实验事实是
A.醋酸属于共价化合物 B.醋酸能与水以任意比混溶
C.醋酸钠溶液呈碱性 D.常温下pH=3醋酸溶液稀释100倍后pH<5
10.以NA表示阿伏加德罗常数,下列说法正确的是
A.22.4L氖气中所含原子数为NA
B.1L 0.1mol / L的醋酸溶液中含离子和分子总数是0.1NA
C.1.6g NH2-离子中所含电子数为NA
D.1 mol硫与足量钠完全反应转移的电子数为NA
11.下列各组微粒氧化性由强到弱的排列正确的是
A.Cl 、Br 、I B.P 、S 、Cl
C.Al3+ 、Cu2+ 、Ag+ D.Fe3+ 、Fe2+、 Zn2+
12.在一定温度下,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.A的生成速率与C的生成速率相等 B.A、B、C的浓度不再变化
C.单位时间内生成A,同时生成3B D.A、B、C的分子数之比为1:2:3
13.下列离子方程式书写正确的是
A.氯化铵溶液中加入氢氧化钠稀溶液 NH4++OH-====NH3·H2O
|
C.二氧化锰与浓盐酸混合加热 MnO2+4HCl===== Mn2++2Cl-+Cl2↑+2H2O
D.过量的碳酸氢钠溶液与氢氧化钡溶液混合 HCO3-+Ba2++OH-===H2O+BaCO3↓
14. L—多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
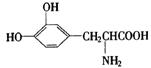
下列关于L—多巴性质的推测正确的是
A.不易被氧化 B.能与溴发生取代反应
C.有酸性,也有碱性 D.不可能形成高分子化合物
15.增大压强,对已达到平衡的反应
3X(g)+Y(g)![]() 2Z(g)+2Q(g) 产生的影响是
2Z(g)+2Q(g) 产生的影响是
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都没有变化,平衡不发生移动
D.正、逆反应速率都增大,平衡不发生移动
16.制取硝酸铜现有三种设计方案可供选用:
①Cu与稀硝酸反应 3Cu+8HNO3=3Cu(NO) 2+2NO↑+4H2O
②Cu与浓硝酸反应 Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中 2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
下列说法正确的是
A.制取相同量的硝酸铜时,③需硝酸的量最少
B.制取相同量的硝酸铜时,①产生的有毒气体比②少
C.三种方案中硝酸的利用率③>②>①
D.三种方案的反应都可以在铁制容器中进行
17.科学家成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法正确的是
A.CO2原子晶体和分子晶体互为同素异形体
B.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
C.CO2原子晶体和CO2分子晶体具有相同的物理性质
D.在CO2原子晶体中,每一个碳原子周围结合4个氧原子,每一个氧原子跟两个碳原子相结合
18.足量的铝分别与等物质的量浓度的氢氧化钠溶液、稀硫酸反应,放出的气体体积在标准状况下相等,则所取氢氧化钠溶液和稀硫酸的体积比为
A.1:1 B.1:2 C.1:3 D.2:3
第II卷(非选择题,共78分)
三、(本题包括2小题,共22分)
19.(9分)下列实验操作正确的是(选错扣分) 。
A.实验室制取乙烯时,必须将温度计的水银球插入反应液中。
B.分离苯和苯酚的混合液,可加入适量浓溴水,过滤、分液,即可实现。
C.取2mL 2mol/L CuSO4溶液于试管中,加入几滴 4mol/L NaOH溶液,再加入某种有机试剂,加热,可根据是否产生大量的红色沉淀判断该有机物中是否含有醛基。
D.向一支洁净的试管中加入2mL 2%硝酸银溶液,再向试管中滴加稀氨水至产生的沉淀恰好溶解为止,加入几滴乙醛溶液,水浴加热。片刻后,在试管内壁形成银镜。
E.取20mL蒸馏水于50mL烧杯中,加热至沸腾,加入数滴饱和FeCl3溶液,持续加热片刻,即可制得Fe(OH)3胶体。
F.用浓硫酸作催化剂将纤维素水解后,加入新制的氢氧化铜悬浊液,加热,可根据是否产生红色沉淀判断该水解液是否含有醛基。
20.(13分)下图是某同学设计的NH3催化氧化并检验反应生成的酸性物质的简易装置(图中必要的铁架台、铁夹、酒精灯等均已略去)。已知:NO2+NO+2NaOH=2NaNO2+H2O。
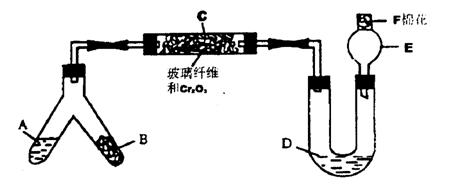 实验中所选用的试剂不超出下列范围,且不得重复使用。
实验中所选用的试剂不超出下列范围,且不得重复使用。
①NH4Cl和Ca(OH)2的混合物;②浓氨水;③NaOH固体;④KClO3和MnO2的混合物;⑤6mol/LNaOH溶液;⑥0.5mol/LNaOH溶液;⑦酚酞试液;⑧碱石灰;⑨浓H2SO4;⑩CuO。
试回答下列问题:
(1)图中液态物质A是(填代号) ,固体物质B是(填代号) ;
(2)C处发生的NH3催化氧化的化学方程式是
_____________________________________________________________;
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是(填代号)________________,实验过程中的现象是______________________________________;
(4)E处球形玻璃管的作用是____________________________________________________;
F处的棉花应蘸取的物质是(填代号)______________,其作用是____________________
四、(本题包括2小题,共18分)
21.(6分) 为了在铝制品表面形成一层较厚的氧化膜,可将铝制品与另一种材料作电极,以某溶液作电解液进行电解,通电后在铝制品与电解液的接触面上逐渐形成一层Al(OH)3薄膜,薄膜的某些部位存在着小孔,电流从小孔通过并产生热量使Al(OH)3分解即可。某研究性学习小组根据上述原理,以铝制品和铁棒为电极,某浓度的NaHCO3溶液为电解液进行实验。
⑴铝制品应该与电源的 极相连接。
⑵电解过程中,必须使电解液的pH保持相对稳定(不能太大,也不能太小)的原因是
。
⑶使用NaHCO3溶液为电解液,会减缓阴极区溶液pH值的增大,能说明该反应的离子方程式为________________________________________________________。
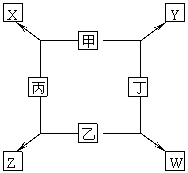 22. (12分)甲、乙、丙、丁四种单质在点燃条件下反应生成 X、Y、Z、W四种化合物,转化关系如右图所示,又知:
22. (12分)甲、乙、丙、丁四种单质在点燃条件下反应生成 X、Y、Z、W四种化合物,转化关系如右图所示,又知:
① 甲、乙、丙在常温下为气态单质,丁是目前
用量最大的金属单质。
② 常温下,X是无色液体,Y是黑色固体。
③ 丙在乙中燃烧发出苍白色火焰,丁在乙中
燃烧生成棕黄色的烟, W的水溶液呈黄色。
请填空:
(1) 丁在甲和X同时存在的条件下,可以被腐蚀,写出电极反应方程式
负极___________________________________________________,
正极___________________________________________________。
(2)丁与X在高温下反应时,氧化剂为(写化学式)___________________,其化学方程式为
______________________________________________________。
(3) 足量的丁与稀硝酸反应的离子方程式为
__________________________________________________________。
(4) 将Y看成碱性氧化物,Y与Z的溶液发生反应的离子方程式是__________ 。
五、(本题包括2小题,共18分)
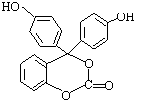 23.(8分)右下图为某有机物的结构简式,每个节点处代表有一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。又知酯类在铜铬氧化物催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在
23.(8分)右下图为某有机物的结构简式,每个节点处代表有一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。又知酯类在铜铬氧化物催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在
![]() 催化加氢过程中不变,其反应原理如下:
催化加氢过程中不变,其反应原理如下:
RCOOR’+2H2 RCH2OH+HO-R’
试填空:
⑴该有机物的的化学式为 。
⑵该有机物分子中的三个苯环________________共平面(选填“能”或“不能”)。
⑶1mol该有机物在铜铬氧化物催化下能与 mol氢气充分反应。
⑷该有机物与足量氢氧化钠溶液充分反应后的产物中,相对分子质量最小的钠盐的化
学式为 。
24.(10分)卤代烃R—C1在一定条件下可发生如下反应:
| |||
![]() R—C1 + H2O
ROH+HCl R—C1 +
KCN
R—CN +
KCl
R—C1 + H2O
ROH+HCl R—C1 +
KCN
R—CN +
KCl
R—CN + 2H2O
+ H+![]() R—COOH + NH
R—COOH + NH![]()
以乙烯为原料经过下图所示的反应可制取有机物W(A、B、C、D、E均为烃的衍生物) 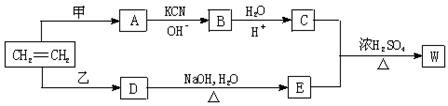
⑴若甲为Cl2 ,乙为HCl ,生成物W的分子式为C8H14O4 ,则W的结构简式为
____________________________________________________________。
⑵若甲、乙均为C12,生成的W为最小环状分子,写出C + E![]() W的化学方程式
W的化学方程式
。
⑶若甲、乙均为C12,生成的W为高分子,则W的结构简式为
。
⑷若W的分子式为C5H10O3则甲为________________,乙为__________。
六、(本题包括2小题,共20分)
25.(8分)6.4gCu与过量硝酸(a mol / L,30mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1mol。
⑴此时溶液中所含NO3-为 mol。
⑵求生成的气体中NO2和NO的物质的量(用含有a的式子表示)。
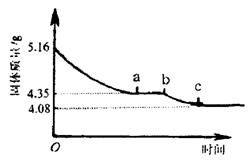
26.(12分)某化学研究性学习小组在研究某结晶水合物(MSO4·2H2O)的过程中,做了如下实验:将含结晶水合物放在坩埚中加热,加热前和加热后都进行称量。随着实验次数的增加,加热的时间不断延长,他们在实验中将数据整理如下表。
| 实验顺序(按延长加热时间) | 固体质量/g | |
| 加热前(g) |
| |
| 1 | 5.16 | 4.89 |
| 2 | 4.68 | |
| 3 | 4.35 | |
| 4 | 4.35 | |
| 5 | 4.20 | |
| 6 | 4.17 | |
| 7 | 4.08 | |
| 8 | 4.08 | |
(注:在上述实验温度下,MSO4不分解)
利用数据可绘制成如右图所示的图像:
(1) 利用实验数据,通过计算确定M元素的相对原子质量,并写出其元素符号。
⑵ 求ab段坩埚中固体物质的化学式。
高考备考统测题
化学模拟题答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| D | B | A | B | C | C | B | A | CD |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| C | AD | B | A | BC | D | AB | D | D |
19 A、D、E(共9分,每个3分,写错1个倒扣3分,扣完为止)
20.⑴ ②(1分); ④(1分)。
⑵ 4NH3+5O2![]() 4NO+6H2O;(2分,条件缺少扣1分,不配平0分)
4NO+6H2O;(2分,条件缺少扣1分,不配平0分)
⑶ ⑥⑦(2分,少1个扣1分,错1个0分),红色褪去(2分);
⑷作安全瓶(或防止液态物质冲出)(2分);⑤(1分),吸收氮的氧化物(2分)。
21.⑴正(2分)
⑵Al(OH)3和Al2O3都是两性物质,当电解液呈酸性或强碱性时,刚形成的Al2O3薄膜会被溶解。(2分)
⑶HCO3-+OH-=====CO32-+H2O(2分)
22.(1) 2Fe-4e =2Fe2+(2分) O2+2H2O+4e = 4OH-(2分)
|
(2) H2O (2分) 3Fe+4H2O ====== Fe3O4十4H2 (2分)
(3) 3Fe+8H++2NO3-===3Fe2++2NO↑+4H2O(2分)
(4) Fe3O4+8H+=Fe2++2Fe3++4H2O(2分)
23.⑴C20H14O5(2分) ⑵不能(2分) ⑶3(2分) ⑷Na2CO3 (2分)
24.⑴CH3CH2OOCCH2CH2COOCH2CH3(2分)
⑵HOOCCH2CH2COOH+HOCH2CH2OH![]()
![]()
![]() ⑶ [OCCH2CH2COOCH2CH2O
] n (2分)
⑶ [OCCH2CH2COOCH2CH2O
] n (2分)
⑷ HCl (2分) Cl2(2分)
25.⑴0.3(2分)
⑵设生成气体中NO2、NO的物质的量分别为X mol、Y mol
由得失电子守恒:X+3Y=0.2mol (2分)
由“N”元素守恒:X+Y=(0.03a-0.3)mol (2分)
X=(0.045a-0.55)mol;(1分)
Y=(0.25-0.015a)mol。(1分)
(其他合理解法也给分)
26.解:根据表格和图中所示,提取有用数据:
⑴MSO4·2H2O![]() MSO4+2H2O
MSO4+2H2O
M+96+56 36
5.16g 1.08g
M=40 该元素的相对原子质量为40,元素符号为Ca.
(其他合理解法也给分,如差量法、关系式法等均可,列式正确得2分,结果正确3分,写出元素符号1分)
⑵CaSO4·2H2O![]() CaSO4·yH2O+(2-y)H2O
CaSO4·yH2O+(2-y)H2O
172 136+18y
5.16g 4.35g
y=![]() (列式正确给3分)
(列式正确给3分)
该化合物为2CaSO4·H2O(或CaSO4·![]() H2O)。(结果正确3分)。
H2O)。(结果正确3分)。
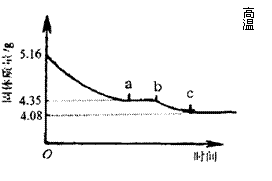 加热后(g)
加热后(g)