高考化学第一轮总复习试卷(七)
硫和硫的化合物 环境保护
第Ⅰ卷(选择题 共60分)
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.某气体在近地面空气中浓度稍大时是一种污染物,而在高空却对人类有保护作用,该气体是( )
A.NO
B.![]() C.CO
D.
C.CO
D.![]()
2.市场上销售的某消毒液,其商品标识上有如下叙述:①本产品为无色液体,呈碱性;②使用时,加水稀释;③可对餐具、衣服进行消毒,也可漂白浅色衣物。据此,可推断该产品的有效成份可能是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
3.下列容器中,最不宜于制造储存浓![]() 的容器是( )
的容器是( )
A.铁 B.铝 C.铜 D.陶瓷
4.如图7-1所示,在硫酸工业生产中,为了有利于![]() 的转化,且能够充分利用热能,采用了中间有交换器的接触室。按此密闭体系中气体的流向,则在A处流出的气体为 ( )
的转化,且能够充分利用热能,采用了中间有交换器的接触室。按此密闭体系中气体的流向,则在A处流出的气体为 ( )
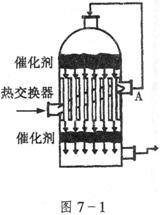
A.![]() B.
B.![]() ,
,![]() C.
C.![]() ,
,![]() D.
D.![]() ,
,![]()
5.下列事实能用同一原理解释的是 ( )
A.![]() ,
,![]() 均能使品红溶液褪色
均能使品红溶液褪色
B.![]() 晶体、固体
晶体、固体![]() 受热均能变成气体
受热均能变成气体
C.S与Fe、Cu反应均生成低价硫化物
D.![]() 与
与![]() 、
、![]() 均不能生存
均不能生存
二、选择题(本题包括10小题,每小题4分,共40分。每小题有![]() 选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分)
选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分)
6.向![]() 和
和![]() 的酸性混合物溶液中通入
的酸性混合物溶液中通入![]() 气体,有白色沉淀生成,此沉淀是( )
气体,有白色沉淀生成,此沉淀是( )
A.![]() B.
B.![]() C.
C.![]() D.S
D.S
7.下列物质中硫元素既能被氧化,又能被还原的是( )
A.![]() B.S
C.
B.S
C.![]() D.
D.![]()
8.在无色透明的酸性溶液中,下列离子能大量共存的是 ( )
A.![]() 、
、![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]() 、
、![]()
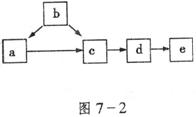
9.图7-2为含同一元素的a、b、c、d、e五种物质的转化关系。其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a不可能是下列中的 ( )
①![]() ②
②![]() ③C ④S
③C ④S
A.①和③ B.只有① C.②和④ D.③和④
10.下列离子方程式书写正确的是( )
A.向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至刚好沉淀完全
溶液至刚好沉淀完全
![]()
B.用石墨作电极电解饱和食盐水 ![]()
C.向NaOH溶液中滴加同浓度的少量![]() 溶液
溶液
![]()
D.![]() 溶液中加
溶液中加![]() 溶液
溶液 ![]()
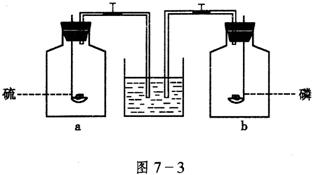
11.将红磷和硫分别在图7-3所示的两个盛满![]() 的集气瓶内燃烧,待燃烧完毕后,同时打开两个止水夹,这时观察到的现象是( )
的集气瓶内燃烧,待燃烧完毕后,同时打开两个止水夹,这时观察到的现象是( )
A.水先进入a瓶
B.水先进入b瓶
C.水同时进入两瓶
D.水不进入任何一瓶
12.有一瓶无色气体,可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种,将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的
中的一种或几种,将其通入氯水中,得无色透明溶液,将这种溶液分为两份,向一份中加入用盐酸酸化的![]() 溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的
溶液,出现了白色沉淀;向另一份中加入用硝酸酸化的![]() 溶液,也产生了白色沉淀,与此有关的下列结论中,正确的是( )
溶液,也产生了白色沉淀,与此有关的下列结论中,正确的是( )
A.肯定有![]() 、
、![]() B.可能含有
B.可能含有![]() 、
、![]()
C.肯定没有![]() 、
、![]() 、
、![]() D.以上结论均不正确
D.以上结论均不正确
13.常温下,向20L真空容器中通入![]() 和
和![]() (a和b都是正整数,
(a和b都是正整数,![]() ,
,![]() ),反应完全后,容器内气体可能达到的最大密度约是( )
),反应完全后,容器内气体可能达到的最大密度约是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
14.下列说法不正确的是 ( )
A.硫是一种淡黄色的能溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫与氧属于同一主族
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
15.工业上制取![]() 不是直接用铜与浓
不是直接用铜与浓![]() 反应,而是将
反应,而是将![]() 和少量的Ag的混合物浸在稀硫酸中并不断从容器下部吹入细小的空气泡,这样的优点是( )
和少量的Ag的混合物浸在稀硫酸中并不断从容器下部吹入细小的空气泡,这样的优点是( )
①不产生污染大气的![]() ②提高
②提高![]() 的利用率 ③节约能源,提高铜的利用率
的利用率 ③节约能源,提高铜的利用率
A.①② B.②③ C.①④ D.①②③
第II卷(非选择题 共90分)
三、(本题包括2小题,共20分)
16.(7分)某同学进行如下实验:在试管中加入铜片,再加入适量浓硫酸,然后在酒精灯火焰上均匀加热一会儿,观察到的现象是铜片先变黑,随后溶液变蓝,而且还发现在蓝色溶液的底部有白色固体,据此回答:
(1)浓硫酸在此反应中表现了什么性质?______________;试管底部的白色固体是________(填化学式)。
(2)写出铜片变黑的化学方程式__________________________。
17.(13分)某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图7-4所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去)。
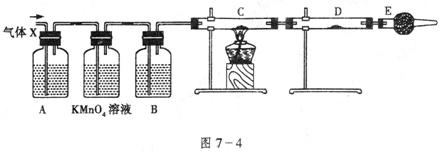
试回答:
(1)上述反应中生成二氧化硫的化学方程式为:____________________。
(2)乙同学认为还可能产生氢气的理由是:_________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是:______________。
(4)A中加入的试剂可能是____________,作用是_______________;
B中加入的试剂可能是____________,作用是_______________;
E中加入的试剂可能是____________,作用是_______________。
(5)可以证明气体X中含有氢气的实验现象是:
C中:_________________,D中:__________________;
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?____________(填“能”或“不能”)。原因是:___________________。
四、(本题包括3小题,共25分)
18.(8分)根据下列化学反应和事实,说明反应利用了硫酸的什么性质,将表示性质的选项的字母填在各小题的横线上。
A.不挥化性 B.酸性 C.吸水性 D.脱水性 E.强氧化性 F.强酸性
(1)浓硫酸可作气体干燥剂_______________;
(2)![]() ____________;
____________;
(3)![]() _______________;
_______________;
(4)![]() ________________;
________________;
(5)![]() __________________;
__________________;
(6)![]() _______________;
_______________;
(7)![]() ______________;
______________;
(8)![]() ________________。
________________。
19.(6分)酸性氧化物和碱性氧化物相互作用可生成含氧酸盐,而硫代酸盐也可由酸性的非金属硫化物与碱性的金属硫化物作用制得。如:
![]() (硫代亚砷酸钠)
(硫代亚砷酸钠)
试写出下列反应的化学方程式:
(1)![]() 和
和![]() 反应:_____________________ ;
反应:_____________________ ;
(2)![]() 和
和![]() 反应:_____________________;
反应:_____________________;
(3)![]() 和
和![]() 相似,均具有还原性;
相似,均具有还原性;![]() 和
和![]() 相似,均具有氧化性。则
相似,均具有氧化性。则![]() 和
和![]() 作用的化学方程式为_______________________。
作用的化学方程式为_______________________。
20.(11分)我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学方程式表示)________________________;
②如果将刚取样的上述雨水与自来水相混合,pH将变_____________,原因是(用化学方程式表示)_______________________。
(2)为防治酸雨,降低煤燃烧时向大气排放的![]() ,工业上将生石灰和含硫煤混合后使用,请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式_____________,_________________。
,工业上将生石灰和含硫煤混合后使用,请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式_____________,_________________。
五.(本题包括2小题,共25分)
21.(12分)化合物X、Y、Z是由短周期的三种元素两两结合而成,X、Y、Z之间的转化关系如图7-5所示(无被省略的物质):
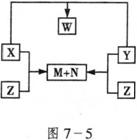
又知:X、N、W均为液态物质,且X与N的组成元素相同。试回答:
(1)上述转化关系图中涉及到的基本反应类型是__________________。
(2)X、Y、Z、W的化学式依次是:X__________________、Y_____________、Z_____________、W_______________。
(3)写出X与Y、X与Z反应的化学方程式:
X+Y:_________________________________;
X+Z:_________________________________。
22.(13分)某无色溶液,其中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 取该溶液进行有关实验,实验结果如图7-6:
取该溶液进行有关实验,实验结果如图7-6:
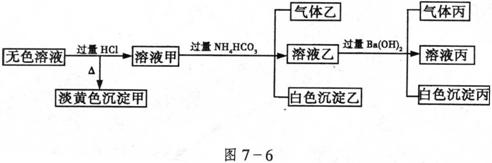
请回答下列问题:
(1)沉淀甲的化学式:______________________;
(2)由溶液甲生成沉淀乙的离子方程式:______________________;
(3)沉淀丙中一定含有________________________;
(4)综合以上所述信息,该溶液中肯定存在的离子有_______________________。
六、(本题包括2小题,共18分)
23.(8分)将8.8gFeS固体置于200mL 2.0mol/L的盐酸中,以制备![]() 气体,反应完全后,若溶液中
气体,反应完全后,若溶液中![]() 的浓度为0.10mol/L,假定溶液体积不变,试计算:
的浓度为0.10mol/L,假定溶液体积不变,试计算:
(1)收集到![]() 气体的体积(标准状况);
气体的体积(标准状况);
(2)溶液中![]() 和
和![]() 的物质的量浓度。
的物质的量浓度。
24.(12分)接触法制硫酸,最后的产品是质量分数为98%的硫酸或20%的发烟硫酸(![]() 和
和![]() 的混合物,其中含20%的
的混合物,其中含20%的![]() )。
)。
(1)若98%的硫到可表示为![]() ,20%的发烟硫酸可表示为
,20%的发烟硫酸可表示为![]() ,则a,b的值(a、b可用分数表示)分别是:a=____________________,b=________________________;
,则a,b的值(a、b可用分数表示)分别是:a=____________________,b=________________________;
(2)用![]() 分别表示
分别表示![]() 转化成上述两种硫酸时,用水的质量与
转化成上述两种硫酸时,用水的质量与![]() 物质的量的关系式分别是:
物质的量的关系式分别是:
![]() =_____________________
=_____________________![]() ,
,![]() =____________
=____________![]() ;
;
(3)若工厂同时生产上述两种硫酸,则两种产品的质量比x(![]() ,
,![]() 的硫酸的质量,
的硫酸的质量,![]() 的发烟硫酸的质量)与
的发烟硫酸的质量)与![]() 用量之比的关系是:
用量之比的关系是:![]() ___________x;
___________x;
(4)实际生产时,总![]() 的物质的量一定,x随市场需求而有改变,则用水总量
的物质的量一定,x随市场需求而有改变,则用水总量![]() 、x、
、x、![]() 的关系式是_________________。
的关系式是_________________。
参考答案
1.B ![]() 在近地面空气中浓度稍大时会对人体、动植物造成伤害。而在高空中臭氧层能吸收太阳中大部分紫外线,使人类免遭伤害。
在近地面空气中浓度稍大时会对人体、动植物造成伤害。而在高空中臭氧层能吸收太阳中大部分紫外线,使人类免遭伤害。
2.C ![]() 水,
水,![]() 溶液有色;
溶液有色;![]() 的水溶液显酸性。
的水溶液显酸性。
3.C ![]() 、
、![]() 遇浓
遇浓![]() 钝化,而铜与浓
钝化,而铜与浓![]() 反应。
反应。
4.C 进入热交换器的气体为![]() 、
、![]() ,预热后从A口流出的仍为
,预热后从A口流出的仍为![]() 、
、![]() 。
。
5.C A项![]() 与品红结合,
与品红结合,![]() 使品红氧化;B项
使品红氧化;B项![]() 受热分解,
受热分解,![]() 受热升华;D项
受热升华;D项![]() 氧化
氧化![]() ,
,![]() 与
与![]() 结合成
结合成![]() 。
。
6.A ![]() 可将
可将![]() 氧化为
氧化为![]() ,从而生成
,从而生成![]() 沉淀。
沉淀。
7.BC 元素处于中间价态时,既能失电子被氧化,也能得电子被还原。
8.C A项中![]() 显蓝色,B项中
显蓝色,B项中![]() 与
与![]() 不共存,D项
不共存,D项![]() 与
与![]() 不共存。
不共存。
9.B 将物质代入推测,注意![]()
![]()
10.B 对于A项,![]() 与
与![]() 也发生反应,故A不对;C项由于加入的
也发生反应,故A不对;C项由于加入的![]() 的量少,故应为
的量少,故应为![]() ;D项电荷不守恒。
;D项电荷不守恒。
11.B 红磷和硫燃烧分别生成![]() 和
和![]() ,前者使瓶内气体压强减少,后者基本不变。
,前者使瓶内气体压强减少,后者基本不变。
12.D 通入氯水得无色透明溶液,原气体不含![]() (有S
(有S![]() )、
)、![]() (有
(有![]() 生成),加入
生成),加入![]() 有沉淀即有
有沉淀即有![]() 生成,但加
生成,但加![]() 有沉淀(有
有沉淀(有![]() )不能断定原气体是否含
)不能断定原气体是否含![]() (氯水中含
(氯水中含![]() )。
)。
13.D 当![]() 最少
最少![]() 、
、![]() 最多(b=5)时气体密度最大,反应的
最多(b=5)时气体密度最大,反应的![]() 为0.5mol,则
为0.5mol,则![]() 。
。
14.AD 硫是难溶于水的固体,不论在空气中还是在纯氧中燃烧皆产生![]() 。
。
15.D 与![]() 相比,
相比,![]() 反应不需加热,无
反应不需加热,无![]() 生成,消耗的
生成,消耗的![]() 少。
少。
16.(1)氧化性,酸性;![]()
(2)![]()
17.(1)![]()
(2)当Zn与浓![]() 反应时,浓
反应时,浓![]() 浓度逐渐变稀,Zn与稀
浓度逐渐变稀,Zn与稀![]() 反应可产生
反应可产生![]()
(3)检查装置的气密性
(4)品红溶液;
检验![]() ;
;
浓![]() ; 吸收水蒸气;
; 吸收水蒸气;
碱石灰; 防上空气中水蒸气进入D中
(5)C中黑色(![]() )变成红色
)变成红色![]() ;D中白色粉末变成蓝色;不能;因为混合气体中可能含
;D中白色粉末变成蓝色;不能;因为混合气体中可能含![]() ,会干扰
,会干扰![]() 的检验(其它合理答案也给分)
的检验(其它合理答案也给分)
18.(1)C (2)D (3)A (4)F (5)B
(6)F (7)B、E (8)E
19.(1)![]() ;
;
(2)![]() ;
;
(3)![]()
20.(1)①![]()
②小;![]() (或
(或![]() )
)
(2)![]() ;
;![]()
21.(1)化合反应:(2)![]() ;
;![]() ;
;![]() ;
;![]()
(3)![]()
22.(1)S (2)![]()
(3)![]() 、
、![]() (4)
(4)![]() 、
、![]() 、
、![]()
23.(1)由![]() 可知
可知![]() 过量,应用
过量,应用![]() 计算。
计算。
![]() ,共生成
,共生成![]() 。其中溶解在溶液中的为
。其中溶解在溶液中的为![]() ,
,
则收集到的硫化氢体积为:![]()
(2)生成![]() 为
为![]() ,浓度为
,浓度为![]() ,消耗
,消耗![]() ,反应前
,反应前![]() ,
,
故![]()
24.(1)![]()
(2)![]() ;
;![]()
解析:由(1)的结果知,98%![]() 可表示为
可表示为![]() ,即此
,即此![]() 中每含
中每含![]() ,必含
,必含![]() 水,其质量为
水,其质量为![]() ,同理,
,同理,![]()
(3)0.938
解析:由两种![]() 组成得下列关系:
组成得下列关系:
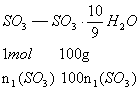
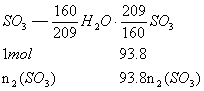
依![]() ,得
,得![]()
(4)![]()
解析:由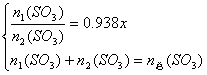
得: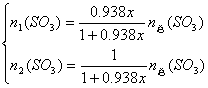
由(2)得: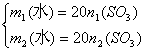
由此,![]()