碳、硅及新型无机非金属材料
教学内容
1.构建碳、硅元素的知识网络
2.掌握两种元素对应的单质,氧化物、酸及其盐的重要性质
3.了解硅酸盐工业和新型无机非金属材料
二、学习指导
(一)构建知识网络
一方面抓住典型物质作为核心,尽可能向外发散和向内收效,甚至可扩展到相关的有机知识,另方面要区分条件的不同(如温度、用量、酸碱性等),尽量分类整理,做到有序存档。
1.碳元素及其化合物的转化
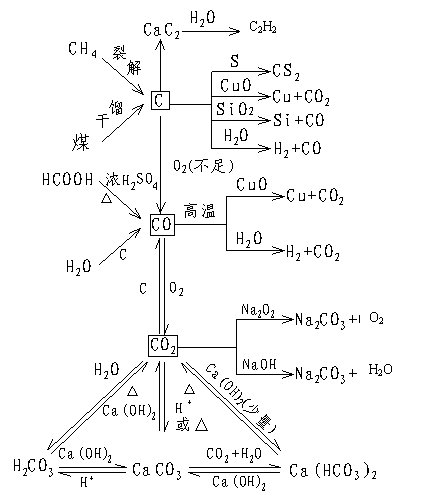 |
2.硅元素及其化合物的转化
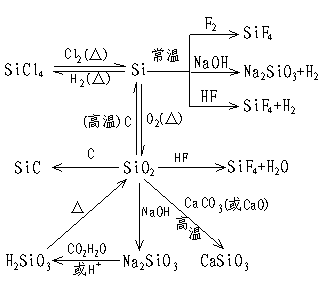 |
(二)典型构质的性质
![]() 1.单质碳
C原子间结合方式
1.单质碳
C原子间结合方式![]()
(1)同素异形体的多样性
分子中所含C原子数不同![]()
金刚石——原子晶体
![]()
![]() 原子晶体
原子晶体
石墨——混合晶体
分子晶体
(2)活性炭的重要性质和作用
↓
多孔疏松结构→吸附力强→吸附气体或溶液里的某些有色物质。
↓实例
①去臭气——吸附水中有臭味物质(净化水)
②漂白——吸附某些食物和工业产品中的色素
③去毒——吸附有毒气体(如NO2、Cl2等)(用于防毒面具)
(3)碳的化学性质
常温:稳定
加热、高温或点燃:常表现还原性,作还原剂
一般加热时,C → CO2
![]() 高温时,C → CO
高温时,C → CO
![]() 如: C+H2O CO+H2
如: C+H2O CO+H2
![]()
![]() 2C+SiO2 2CO+Si
2C+SiO2 2CO+Si
![]() C+2CuO 2Cu + CO2
C+2CuO 2Cu + CO2
![]()
C+4HNO3(浓) CO2↑+4NO2↑+2H2O
想一想:为什么木炭燃烧时无火焰?
2.碳的氧化物
CO、CO2尽管用为碳的氧化物,但是两者的物理性质,化学性质均有较大区别,可列表比较如下:
| CO | CO2 | |
| 物理性质 | 无色无气味气体难溶于水 | 无色略带酸味气体能溶于水(1 :1) |
| 毒性 | 有毒(与血红蛋白结合) | 无毒(大量排放会导致温室效应) |
| 化学性质 | ①可燃性 ②还原性 ③不与碱液反应 | ①一般不可燃烧,也不支持燃烧但Mg、Li能在CO2中燃烧
C+CO2 2CO ③与碱液反应 |
| 类别 | 不成盐氧化物 | 酸性氧化物 |
| 检验 | 点燃后在火焰 上方罩上干燥的 烧杯和用清石
| 能使清石灰水变浊但不能使品红褪色(有别于SO2) |
| 实验室制法 | HCOOH CO↑+H2O | CaCO3+2HCl==CaCl2+CO2↑+H2O |
| 工业制法 |
C+H2O CO+H2 |
CaCO3 CaO+CO2↑ |
思考下列小问题:
①如何除去CO中少量CO2?
②如何除去CO2中少量CO?
③如何分离CO和CO2?
3.比较CO2和SiO2
CO2和SiO2是同主族元素形成的高价氧化物。化学性质有一定的相似性,但物理性质和某些化学性质方面却有很大差异。
|
| CO2 SiO2 | |||
| 与碱性氧化物反应 | 酸 性 氧 化 性 | |||
| CaO+CO2=CaCO3 |
CaO+SiO2 CaSiO3 | |||
| 与碱液反应 |
| SiO2+2NaOH = Na2SiO3+H2O | ||
| 与盐反应 | C6H5Ona+CO2+H2O→ +NaHO3 Na2SiO3+CO2+H2O=Na2CO3 +H2SiO3↓ NaAlO2+CO2+2H2O=Al(OH)3↓ +NaHCO3 |
CaCO3+SiO2 CaSiO3+CO2↑ (难挥发酸酐→易挥发酸酐) | ||
| 与碳反应 |
C+CO2 2CO |
2C+SiO2 Si+2CO | ||
| 与H2O作用 |
|
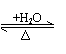 SiO2 H2SiO3 —H2O | ||
| 与酸反应 | 不反应 | 只与HF反应 SiO2+4HF=SiF4↑+H2O | ||
| 晶体类型 | 分子晶体 | 原子晶体 | ||
| 熔点 | 低(易升华) | 高 | ||
4.Si的非寻常性
(1)硅不活泼、但自然界无游离态,通常以硅酸盐形式存在
(2)硅不与一般的强酸、强氧化性酸反应,但常温却下HF反应,且能置换出其中的H。
Si+4HF==SiF4+2H2↑
(3)碳不与碱液反应,但硅常温即可与碱液反应并放出H2,表现出与Al有相似性。
Si+2NaOH+2H2O==Na2SiO3+2H2↑
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
其它固体非金属即使与碱液反应,一般也无H2产生。如
3S+6NaOH==2Na2S+Na2SO3+3H2O
5.碳酸正盐和酸式盐
(1)溶解性:
①大多正盐难溶于水(除K+、Na+、NH4+)
而一般酸式碳酸盐均可溶于水
②同一种阳离子的盐
一般:酸式盐>正盐
如 Ca(HCO3)2>CaCO3
KHCO3>K2CO3
但 NaHCO3<Na2CO3
想一想:为什么在饱和Na2CO3溶液中通入足量的CO2有晶体析出?
提示:Na2CO3+CO2+H2O==2NaHCO3
106g 18g 168g
①溶剂水量减少
②生成NaHCO3质量比消耗的Na2CO3质量大
③同温下溶解性 NaHCO3<Na2CO3
(2)与酸反应的过程及速度(同条件)
H++CO32—==HCO3—
HCO3—+H+==H2O+CO2↑
放出气体速度:HCO3—>CO32—
(3)与碱液反应
![]() Na2CO3+NaOH→不反应
Na2CO3+NaOH→不反应
NaHCO3+NaOH==Na2CO3+H2O
![]() Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
2NaHCO3+Ca(OH)2![]() ==CaCO3↓+Na2CO3+H2O
==CaCO3↓+Na2CO3+H2O
(4)热稳定性:
正盐>相应酸式盐
![]()
![]() 如: CaCO3 CaO+CO2↑
如: CaCO3 CaO+CO2↑
![]()
Ca(HCO3)2 CaCO3↓+H2O+CO2↑
![]()
![]() Na2CO3 不分解
Na2CO3 不分解
![]()
2NaHCO3 Na2CO3+CO2↑+H2O
 (5)相互转化:
(5)相互转化:
正盐(CO32—) 酸式盐(HCO3—)
(三)硅酸盐工业简介
| 水泥 | 玻璃(普通) | |
| 原料 | 石灰石、粘土 | 纯碱、石灰石、石英 |
| 设备 | 迴转窑 |
|
| 反应 | 复杂的物理化学变化 |
CaCO3+SiO2 CaSiO3+CO2↑ |
| 主要成分 | 3CaO·SiO2 2CaO· SiO2 3CaO·Al2O3 | Na2O·CaO· 6SiO2 |
| 特性 | 水硬性 (加石膏调节硬化速度) | 玻璃态物质 (在一定温度范围内软化) 非晶体 |
陶瓷:
(1)主要原料:粘土
(2)生产过程:混合→成型→干燥→烧结→冷却→陶器
(3)陶与瓷的制取区别: ①原料粘土的纯度不同
②烧制温度不同。
(四)新型无机非金属材料
特性:(1)耐高温,高强度
(2)有电学、光学、生物学特性或功能
三、典型解析
例1.把26g含有SiO2和CaCO3固体在高温下加热至质量不再改变,冷却后称重为17.2g。
(1)写出有关的化学反应方程式
(2)求生成CO2的体积(标况)
![]() (3)求原混合物中所含SiO2的质量。
(3)求原混合物中所含SiO2的质量。
![]() 解析:(1)SiO2+CaCO3 CaSiO3+CO2↑
解析:(1)SiO2+CaCO3 CaSiO3+CO2↑
CaCO3 CaO+CO2↑
从上述反应也可比较出两种盐的热稳定性:CaSiO3>CaCO3
在此高温条件下,CaCO3不会过剩,故前后固体质量减少值即为CO2质量。
m(CO2)==26g-17.2g=8.8g
n(CO2)=0.2mol,V(CO2)= 4.48L
CaCO3 ~ CO2
100g 1mol
20g 0.2mol
m(SiO2)=26g-20g=6g
例2.矿泉水一般是由岩石风化后被地下水溶解其中可溶部分生成的,此处所措的风化作用是指矿物与水和CO2同时作用的过程。
例如钾长石(KalSi3O8)风化生成高岭土[Al2Si2O5(OH)4],此后反应的离子方程式为:
2KalSi3O8+2H2CO3+9H2O==2K++2HCO3—+4H4SiO4+Al2Si2O5(OH)4.
(1)将上述复杂硅酸盐改写成氧化物形成
①KalSi3O8______________ ②Al2Si2O5(OH)4
(2)上述反应能够发生的原因是______________
解:(1)将复杂硅酸盐化学式改写成氧化物时,只需将除O以外所有的元素写出其常见氧化物,并用“·”将它们合起来,但需注意各种原子个数比符合原来的组成。在某种(或几种)氧化物前加合适系数。
![]() ①KalSi3O8 K2O·Al2O3·6SiO2
①KalSi3O8 K2O·Al2O3·6SiO2
![]() ②Al2Si2O5(OH4) Al2O3·2SiO2·2H2O
②Al2Si2O5(OH4) Al2O3·2SiO2·2H2O
(2)分析反应前后物质的种类,可知属于酸与盐发生的复分解反应,是由于酸H2CO3>H4SiO4.发生了较强的酸制较弱的酸反应。
例3.现有Na2CO3溶液2mol/L、500mL和HCl溶液2mol/L750mL.若①向HCl溶液中逐滴加Na2CO3溶液 ②向Na2CO3溶液中逐滴加HCl溶液分别产生CO2多少?
解析n(Na2CO3)=1mol,n(HCl)=1.5mol,由于相互滴入的环境不同,发生反应不同。
①中HCl过量,发生反应产生的CO2不断逸出。设共产生xmolCO2
Na2CO3+2HCl==2NaCl+H2O+CO2↑
1 2
x 1.5
x=0.75mol
②中HCl不足,Na2CO3先转变为NaHCO3,后又部分转变成CO2,设生成CO2ymol,可由总守恒方程求解
Na2CO3+1.5HCl=Y
CO2+(1-y)NaHCO3+1.5NaCl+![]() H2O
H2O
由Na+守恒得:1-y+1.5=2×1
y=0.5(mol).
由此可见,先后滴入的次序不同,所得气体量不同,故可用相互滴入法来鉴别Na2CO3和HCl两种无色溶液。
想一想:如维持两种溶液浓度不变,Na2CO3溶液和HCl溶液均为1L,结果又如何呢?
巩固练习
一、选择题(每小题有1~2个选项符合题意)
1.下列物质中不能用化合的方法制得的得( )
①SiO2 ②H2SiO3 ③Na2O2 ④FeCl2 ⑤FeCl3 ⑥CaSiO3
A.①③⑤ B.②④⑥ C.② D.②和④
2.近年来,科学家们研究得到一种新分子C60,有关C60的说法正确的是( )
A.是一种新型的化合物 B.和石墨都是碳的同素异形体
C.在纯氧中燃烧只生成惟一的产物CO2 D.其摩尔质量720g
3.下列各组物质前者为后者的酸酐的是( )
①Cl2O7、HClO ②SO2、H2SO4 ③NO2、HNO3 ④ SiO2、H4SiO4 ⑤Mn2O7、HMnO4
A.②③ B.③④ C.④⑤ D.①③④
4.已知反应C(石墨)===C(金刚石)为吸热反应,下列说法正确的是( )
A.石墨比金刚石稳定 B.金刚石比石墨稳定
C.石墨与金刚石一样稳定 D.以上说法都不对
5.将过量的CO2气体通入下列溶液中,最终溶液不变浑浊的是( )
A.CaCl2与NaOH的混合溶液 B.Ca(OH)2溶液
C.Na2CO3饱和溶液 D.Na2SiO3溶液
6.下列各组物质间,不能发生反应的是( )
A.二氧化硅与氧化钙(高温) B.二氧化硅与氢氧化钠(常温)
C.二氧化硅与碳(高温) D.二氧化硅与浓HNO3(常温)
7.去味剂可以除去冰箱里的一股特殊气味,下列物质可作去味剂的是( )
A.干冰 B.活性炭 C.氯气 D.二氧化碳
8.大气中CO2增多引起“温室效应”,你认为目前大气中的CO2主要来源于( )
A.植物的呼吸与腐烂放出CO2 B.人口增长,呼出的CO2增多
C.工业上大量燃烧含碳燃料 D.建筑工业的发展使大量碳酸盐分解
9.下列关于硅的说法不正确的是( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C.硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氧气等非金属反应
10.可以肯定溶液中大量存在CO32—的理由是( )
A.加入AgNO3溶液中产生大量白色沉淀 B.加入酸有无色无味气体产生
C.加入BaCl2溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,产生可以使澄清石灰水变浑浊的无色无味的气体
D.加入Ba(OH)2溶液有白色沉淀产生,再加稀盐酸,反应现象如C所述
11.下列离子方程式不正确的是( )
A.少量Na2CO3溶液滴入到硝酸中: H++CO32—===HCO3—
B.过量CO2通入到澄清的石灰水中:CO2+Ca2++2OH—===CaCO3↓+H2O
C.烧碱溶液与碳酸氢钙溶液混合:2OH—+Ca2++2HCO3—===CaCO3↓+CO32—+2H2O
D.小苏打溶液与氢氧化钡溶液反应:HCO3—+Ba2++OH—===BaCO3↓+H2O
12.在标准状况下,将CO2和CO的混合气体,密为![]() g·L—1,充满一盛有足够Na2O2的密闭容器中(容积为22.4L),用间断的电火花引发至充分反应,反应完成后,对容器里存在的物质的叙述正确的是( )
g·L—1,充满一盛有足够Na2O2的密闭容器中(容积为22.4L),用间断的电火花引发至充分反应,反应完成后,对容器里存在的物质的叙述正确的是( )
A.存在0.5molCO B.存在0.125molO2
C.存在0.25molNa2CO3 D.存在0.5molNa2CO3
13.某二价金属碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H+和产生CO2的物质的量之比为6 :5 ,该混合物中碳酸盐和碳酸氢盐的物质的量之比为( )
A.1 :1 B. 1 :2 C.1 :3 D.1 :4
14.下列材料的特征及用途说法不正确的是( )
A.氧化铝陶瓷具有两性,可用来制造人造牙齿
B.氧化硅陶瓷耐高温且不易传热,可用来制造柴油机
C.光导纤维导光的能力很强,是非常好的通讯材料
D.人造刚玉硬度高,可用来制造刚玉球磨机
15.石英砂和焦碳在高温电炉中,可以合成金刚砂,金刚砂硬度很大,工业上用来作磨料,以下说法不正确的是( )
![]() A.金刚砂的化学成分是SiO2
A.金刚砂的化学成分是SiO2
![]() B.反应方程式是SiO2+2C
SiC+CO2
B.反应方程式是SiO2+2C
SiC+CO2
C.反应方程式是SiO2+3C SiC+CO
D.金刚砂的结构类似金刚石
16.把CO2通入NaOH溶液中,当CO2与NaOH完全反应时,其质量之比为11 :15,刚下列说法不正确的是( )
A.溶液中除OH—外,只存在一种阴离子
B.溶液中溶质的物质的量之比为1 :1
C.反应后有CO2气体逸出
D.溶液中还可以吸收部分CO2
阅读下文,完成11~13题
硅晶体结构类似于类金刚石,低温下单质硅不活泼,与空气、水、酸均无作用,但可以与强碱和强氧化剂在适当湿度下作用,如硅能与卤素在加热或高温下生成四卤化硅,高价态硅的化合物可在高温下被碳、镁、氢气等还原剂单质硅;工业上也可用硅石与焦炭在高温下制金刚砂(SiC),某高纯硅炼制厂利用食盐、石英、水、焦炭为原料制取用作半导体材料的高纯硅。
17.假设根据每步反应建立一个生产车间,该高纯硅厂家需要几个车间( )
A.3个 B.4个 C.5个 D.6个
18.生产原理中没有涉及到的反应是( )
A.置换反应 B.复分解反应 C.化合反应 D.电解反应
19.该厂家不采用石英与焦炭直接制高纯硅的主要原因是( )
A.产量太低 B.产品中含SiC
C.产品中含有过量的硅石和焦炭 D.耗能太大
20.对于碳酸氢钠与碳酸钠的性质,下列叙述错误的是( )
A.质量相同时,跟足量的盐酸反应相同条件下碳酸钠的产生的CO2体积多
B.物质的量相同时,跟盐酸完全反应碳酸钠消耗的盐酸是碳酸氢钠的2倍(盐酸浓度相同)
C.物质的量相同时,跟足量盐酸反应,在相同状况下,得到等体积的CO2
D.将它们分别加入澄清石灰水中都会产生白色沉淀
21.将一小块焦炭和mg氧气,同时放入装有压力表的密闭容器中,压力为P0,当在一定条件下充分反应后恢复到原湿度,压力为P1,且P0<P1<2P0,则加入的焦炭的质量W为( )
A.W≤![]() B.W≤
B.W≤![]()
C.W>![]() D.W=
D.W=![]()
22.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种。现将13.8g样品中加放足量水,样品全部溶解。再加入过量的CaCl2溶液,得到9g沉淀。对样品所含杂质的正确判断是( )
A.肯定有KNO3,肯定没有Na2CO3
B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2,一定有KNO3和Na2CO3
D.肯定没有Na2CO3和Ba(NO3)2
23.把7.4gNa2CO3·10H2O和NaHCO3组成的混合物溶于水,配成100mL溶液,其中[Na+]=0.6mol·L—1,若把等质量的混合物加热至恒重时,残留物质的质量是( )
A.5.28g B.4.22g C.3.18g D.2.12g
24.根据硅在元素周期表中的位置推测,下列不可能具有的性质是( )
A.单质在通常状况下是固体
B.硅具有导电性 C.SiH4(硅烷)比CH4稳定
D.硅的常见化合价是+4
25.把xmolCO2通入含ymolCa(OH)2的石灰水中,充分反应后,下列叙述不正确的是( )
A.当x≤y时,生成100xg沉淀 B.当x≥y时,生成100yg沉淀
C.当y<x<2y时,生成100(2y-x)g沉淀
D.当2y≤x时,无沉淀生成
26.某无色混合气体可能含有CO2COH2O(气)H2中的一种或几种,依次进行下列处理(假设每次处理的反应完全):①通过碱石灰、气体体积变小。②通过赤热的氧化铜时,固体全部变为红色。③通过白色硫酸铜粉末时,粉末变为蓝色。④通过澄清石灰水,溶液变浑浊。由此可以确定混合气体中( )
A.一定含有CO、H2O,可能含有H2、CO中的一种或两种
B.一定含有CO、H2O,可能含有CO2、H2中的一种或两种。
C.一定含有CO和H2,可能含有H2O、CO2中的一种或两种
D.一定含有CO,可能含有H2O、H2中的一种或两种
二、填空题或简答题
27.称取mgNa2CO3,恰好与20mL盐酸全部反应生成CO2、H2O和NaCl。
(1)这种盐酸的物质的量浓度为_________________________________。
(2)如果上述mgNa2CO3中混有K2CO3,那么这种盐酸的实际浓度比(1)测得的值_________(填“偏大”、“偏小”、“相同”,下同);
(3)如果上述mgNa2CO3中混有NaOH,那么这种盐酸的实际浓度比(1)测得的值_______;
(4)如果上述mgNa2CO3中混有NaHCO3,那么这种盐酸的实际浓度比(1)测得的值________。
28.工业生产的纯碱中常含有少量的NaCl等杂质,图所示实验装置是用来测定纯碱 中Na2CO3质量分数的实验方法示意力。其操作步骤如下:
①检验装置的气密性;
②在球形干燥管内填入颗粒状碱石灰,共总质量为W1;
③称取一定量的纯碱样品,其质量为W2,将其放入装置(B)中;
④将分液漏斗中的稀H2SO4缓缓注入B中,直至不再产生气体为止;
⑤打开开关a,缓缓鼓入空气约5min后,又称得干燥管的总质为W3。
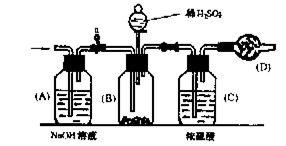 |
请回答下列问题:
(1)实验中鼓入空气的目的是_________________________________________________;
(2)装置(A)的作用是______________________________________________________;装置(C)的作用是________________________________________________________;
(3)Na2CO3的质量分数为_______________________。
29.工业上用生石灰与碳在2700℃高温作用下制电石和CO.现从理论上分析以Mg和石灰石为原料,按下图制取乙炔。
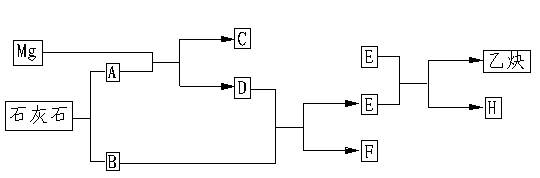 |
请填写:
(1)C的分子式是_________
(2)G与E反应的化学方程式___________________
(3)B与D反应的化学方程式___________________
该反应中氧化剂与还原剂的质量比是____________。
参考答案
一、1.C 2.B 3.C 4.A 5.B 6.D 7.B 8.C 9.C 10.C
11.A、B 12.B 13.B 14.A 15.A、B 16.B、D 17.B 18.B
19.C 20.A 21.D 22.C 23.C 24.C 25.B 26. C
二、(1)![]() m mol/L (2)偏小 (3)偏大 (4)偏大
m mol/L (2)偏小 (3)偏大 (4)偏大
28.(1)把反应生成的CO2全部驱赶到D中吸收
(2)除去空气中少量的CO2;除去CO2中的H2O.
(3)![]() ×100%
×100%
 灰水润洗过的烧杯
灰水润洗过的烧杯