元素及其化合物(B)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分,考试时间为120分钟。
第 Ⅰ 卷(选择题 共83分)
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 23 S 32 Cl 35.5 Fe 56 Zn 65
一. 选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意。)
1.迄今为止,以下各族元素中生成化合物的种类最多的是 ( )
A.IIA族 B.IIIA族 C.IVA族 D.VA族(MCE01春)
2.由于“智力工程”的推行,“碘盐”已开始进入千家万户。下列关于“碘盐”的叙述,正确的是 ( )
A. “碘盐”宜密封保存 B. “碘盐”就是“I2+NaCl”
B. “碘盐”就是NaI D. 使用“碘盐”时宜高温煎炒
3.下列工业生产中,一般不涉及氧化还原反应的是 ( )
A. 氯碱工业 B. 硫酸工业 C. 硝酸工业 D. 硅酸盐工业
4.欲除去CO2中混有的少量氯化氢,最好采用的溶液是 ( )
A. 浓硫酸 B. 石灰水 C. 饱和小苏打 D. 饱和碳酸钠
5.下列四种物质,只能与NaOH溶液作用,不能与盐酸作用的是 ( )
A. NaHS B. NaAlO2 C. KHSO4 D. CH3COONH4
二. 选择题(本题包括12小题,每小题3分,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为 0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
6.下列情况能通过置换反应得到铁的是 ( )
A. 铜与氯化亚铁溶液常温下混合 B. 一氧化碳通过灼热的三氧化二铁
C. 氢气通入硫酸亚铁溶液 D. 铝和四氧化三铁混合加热至高温
7.当下列物质:① 大理石 ② 钟乳石 ③ 锅垢 ④ 贝壳 ⑤ 蛋壳,分别滴加醋酸时,会产生相同气体的 (MCE01) ( )
A. 只有①② B. 只有④⑤ C. 只有①②③ D. 是①②③④⑤
8.下列物质中,既可与氨气反应,又可与二氧化硫反应的是 ( )
A. 硫化氢 B. 氯化氢 C. 水 D. 氢氧化钠
9. 然界“酸雨”形成的主要原因是 ( )
A. 未经处理的工业废水的任意排放
B. 大气中二氧化碳的含量增多
C. 工业上大量含硫燃料的燃烧和金属矿石的冶炼
D. 汽车排放的尾气和燃料不完全燃烧产生的气体
10.下列各组溶液,不用任何试剂就可以将它们区别开来的是 ( )
A. 硫酸钾、氢氧化钠、氯化铝、氯化钠
B. 硫酸铝、氢氧化钾、碳酸氢钠、氯化钡
C. 氢溴酸、硝酸钙、氯化钠、碳酸氢钾
D. 硫酸镁、氢氧化钠、碳酸钾、硫酸氢钾
11.以下根据实验现象的推断,正确的是 ( )
A. 能使润湿的碘化钾淀粉试纸变蓝的气体一定是氯气
B. 能使石蕊试纸呈紫色的溶液一定呈中性
C. 在潮湿空气中能形成白雾的气态氢化物一定是氯化氢
D. 溶于水能形成无色溶液的棕色气体一定是二氧化氮
12.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属于离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是 ( )
A. ZnC2水解生成乙烷(C2H6) B. Al3C4水解生成乙炔(C3H4)
C. Mg2C3水解生成丙烷(C3H4) D. Li2C2水解生成乙炔(C2H2)
13.下列叙述不正确的是 ( )
A. 两种盐溶液反应不一定能生成两种新盐
B. 白磷(P4)、晶体硅的分子构型均为正四面体
C. 同种分子的性质不一定相同,同种元素的原子的性质也不一定完全相同
D. 碱性氧化物全是金属氧化物,酸性氧化物不一定是非金属氧化物
14.有许多单质或化合物易溶于含同一元素的盐(或酸)溶液中,也可溶于其熔融体(或液体)中,如I2易溶于KI溶液,硫易溶于K2S溶液,KF易溶于液态HF中,下列工业生产应用了上述溶解原理的是 ( )
A. 炼铝 B. 高炉炼铁 C. 工业上制硫酸 D. 工业上制硝酸
15.m g铁屑与含有n g HNO3的硝酸溶液恰好完全反应,若m∶n = 1∶3,则起氧化作用的HNO3的质量为 ( )
A.
m g
B. ![]() g C.
g C.
![]() g D.
g D.
![]() g
g
16.下列各组离子,在水溶液中不能大量共存的是 ( )
A.
H+、K+、Cl-、![]() B. K+、Al3+、Cl-、
B. K+、Al3+、Cl-、![]()
B.
Na+、K+、![]() 、
、![]() D. Al3+、Cu2+、
D. Al3+、Cu2+、![]() 、Cl-
、Cl-
17.NH3和H2O,![]() 和H3O+,NH2-和OH-,N3-和O2-,从某些性质来看,每组中的物质两两相似,据此判断,下列反应中正确的是
( )
和H3O+,NH2-和OH-,N3-和O2-,从某些性质来看,每组中的物质两两相似,据此判断,下列反应中正确的是
( )
A. Cu+2NH3 = Cu(NH2)2+H2↑
B. CaO+2NH4Cl = CaCl2+2NH3↑+H2O
C.
3Mg(NH2)2
![]() Mg3N2+4NH3↑
Mg3N2+4NH3↑
D. NaCl+2NH3 = NH4Cl+NaNH2
三. 选择题:(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
18.氟气是氧化性最强的非金属单质,在加热条件下,相同物质的量的氟气与烧碱相互完全反应,生成NaF、H2O和另一种气体,该气体可能是 ( )
A. H2 B. HF C. O2 D. OF2
19.从经济效益和环境保护考虑,大量制取硝酸铜最宜采用的方法是 ( )
A. Cu+HNO3(浓) →Cu(NO3)2
B. Cu+HNO3(稀) →Cu(NO3)2
C.
![]()
D. Cu+AgNO3 →Cu(NO3)2
20.把前一种溶液逐滴滴入后一种溶液与把后一种溶液逐滴滴入前一种溶液所产生的现象相同的是 ( )
A. BaCl2和H2SO4 B. HCl和NaAlO2
C. Na2CO3和HCl D. AgNO3和NH3·H2O
21.用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是 ( )
A. FeO B. Fe2O3 C. CuO D. Cu2O(MCE02)
22.将5.1 g镁铝合金,投入到500 mL 2 mol / L的盐酸中,金属完全溶解,再加入4 mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是 ( )
A. 200 mL B. 250 mL C. 425 mL D. 560 mL
23.已知:H2SeO3+2SO2+H2O = Se+2H2SO4,结合所学知识判断下列强弱关系中正确的是 ( )
A. 还原性:TeO2>SeO2>SO2 B. 氧化性:TeO2>SeO2>SO2
C. 还原性:H2Te<H2Se<H2S D. 酸性:H2SeO3>H2SO4
24.已知:Cu+2Fe3+ = 2Fe2++Cu2+,Zn+2Fe3+ = 2Fe2++Zn2+,现把相同物质的量的CuSO4、FeCl3和Zn置于水中充分反应,反应器中所得混合物除SO42-和Cl-外,还含有
( )
A. Zn2+、Cu、Fe3+ B. Zn、Cu2+、Fe3+
C. Zn2+、Cu2+、Fe、Fe2+ D. Zn2+、Cu、Cu2+、Fe2+
25.有甲、乙、丙三种试液。在氢氧化钡溶液中加入甲,有白色沉淀生成;在沉淀中加入乙,沉淀溶解并产生气泡;最后加入丙,又产生白色沉淀。则试液甲、乙、丙依次是( )
A. Na2CO3、HNO3、MgSO4 B. Na2CO3、HCl、CaCl2
C. H2SO4、(NH4)2CO3、AgNO3 D. Na2SO3、Na2CO3、MgSO4
第 Ⅱ 卷(选择题 共67分)
四.(本题包括2小题,共16分)
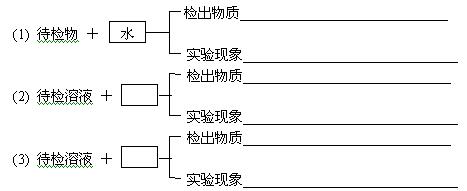
26.(7分)有六瓶白色固体,它们是Al2O3、NaNO3、Ba(OH)2、MgCl2、(NH4)2SO4、无水CuSO4。现仅用蒸馏水及已被检验出的物质对它们作出鉴别。根据以下实验步骤,在空格内填入须加入的试剂。填写检验物质时须与实验现象上下对应。
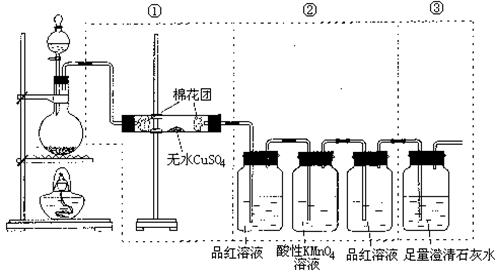 |
27.(9分)下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。(MCE01春)
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是__________;不能检出的物质是________________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是________;不能检出的物质是_______________。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是________;不能检出的物质是________________。
五.(本题包括3小题,共17分)
28.(4分)某一反应体系中共有As2S3、HNO3、H2SO4、NO、H3AsO4、H2O六种物质。已知As2S3是反应物之一,试写出并配平这个反应方程式。
(1) 化学方程式:________________________________________________________;
(2) 氧化产物:______________。
29.(7分)今有H2和Cl2混合气100 mL(标准状态下),其中一种气体体积为45 mL,另一种气体体积为55 mL。光照两种气体发生反应后恢复到标准状态下,气体的体积为_________mL,为证明反应后气体中有H2或Cl2剩余,使气体通过100 mL水,并使剩余气体干燥后,恢复到标准状态。
(1) 若剩余气体为___________mL,证明有__________________剩余;
(2) 若溶液有__________性,证明有__________________剩余;
(3) 由于气态的HCl极易溶于水,可用测定溶液的pH值并和计算值核对,即可知有H2或Cl2剩余,这方法是否正确?___________,其理由是______________________________
___________________________________________________________。
30.(6分)120℃、101.3 kPa条件下,有2 L H2O、2 L CO、1 L CO2、0.5 L O2和1 L H2组成的混合气体。将混合气体通过分别装有足量Cu粉、C粉和CuO粉的三个灼热的反应管。假设气体通过每个反应管都能充分反应,且不论三个反应管以何种顺序排列,问:
(1) 尾气是否有可能是单一气体?___________(填“可能”或“不可能”)。若可能,该气体是_________。
(2) 原气体是否有几种或一种不可能再存在于尾气之中?__________(填“有”或“没有”)。若有,它们(或它)是______________。
(3) 原气体中是否有一种或几种肯定存在于尾气之中?___________(填“有”或“没有”)。若有,它们(或它)是______________。
六.(本题包括3小题,共18分)
31.(6分)黑色固体物质A有以下转化关系。每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温为无色气体,D、E有共同的阳离子。
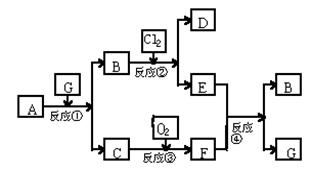
(1) 写出B和C的化学式:B__________;C__________。
(2) 写出反应④的离子方程式:_____________________________________________。
32.(7分)工业上从海水中提出取溴常采用如下方法:
(1) 向海水中通入Cl2,将海水中的溴化物氧化,这一过程所发生的反应属于非金属间的___________反应;
(2) 向上述混合溶液中吹入热空气,将生成的溴吹出,用纯碱液吸收,生成NaBr、NaBrO3,这一过程可用离子方程式表示为:________________________________;
(3) 将(2)所得混合液用H2SO4酸化,使NaBr和NaBrO3中的溴转化为单质溴。这一过程可用化学方程式表示为____________________________________________;
(4) 这样得到的液溴中还混有少量Cl2,除去Cl2的方法是___________________。
33.(5分)把NH4HCO3、CuSO4、MgCl2、Al2(SO4)3固体混合物溶于水中,加入过量盐酸后,再加入过量氢氧化钠溶液,过滤,把滤液加热煮沸后,溶液中大量存在的离子是_____________________________。
七.(本题包括2小题,共16分)
34.(6分)往100 mL溴化亚铁溶液中缓慢通入2.24 L(标准状况)氯气,反应完成后溶液中有![]() 的溴离子被氧化成溴单质。求原溴化亚铁溶液的物质的量浓度。
的溴离子被氧化成溴单质。求原溴化亚铁溶液的物质的量浓度。
(提示:2Fe2++Br2 = 2Fe3++2Br-,不考虑氯气与水的反应)
35.(10分)向8 g某一价或二价金属的氧化物固体中加入适量10%的稀H2SO4(密度为1.07 g/cm3),使其完全溶解,已知所耗的硫酸体积为92 mL。在所得溶液中插入铂电极进行电解,通电一定时间后,在一个电极上收集到224 mL(标准状况)氧气,在另一个电极上析出该金属1.28 g。
(1) 根据计算确定金属氧化物的名称;
(2) 计算通电完毕后硫酸溶液的物质的量浓度。(溶液体积以消耗的硫酸体积92 mL为准)
答 案
1.C 2.A 3.D 4.C 5.C 6.D 7.D 8.AC 9.C 10.BD 11.D 12.CD 13.B 14.AC 15.BC 16.B 17.BC 18.D 19.C 20.A 21.B 22.B 23.B 24.D 25.A
26.(1) CuSO4 ;蓝色溶液(2分) (2) CuSO4溶液;Ba(OH)2 ;蓝色沉淀(或蓝色和白色沉淀并存)(2分) (3) Ba(OH)2溶液;MgCl2、(NH4)2SO4、NaNO3 ;白色沉淀,剌激气味,无明显现象(3分)
27.(每个物质1分)(1)SO2,CO2; H2O
(2)H2O; SO2,CO2
(3)SO2,CO2; H2O
28.(1) 3As2S3+28HNO3+4H2O = 6H3AsO4+9H2SO4+28NO↑(2分) (2) H3AsO4和H2SO4(2分)
29.(每空1分)100 (1) 10; H2 (2) 氧化; Cl2 (3) 不正确; 因为Cl2溶于水时对HCl的pH值影响极小
30. (1) 不可能;(2分) (2) (每空1分)有;O2 (3) 没有 ( 2分)
31. (1) FeSO4(2分) H2S(2分) (2) 2Fe3++SO2+2H2O = 2Fe2++![]() +4H+ (2分)
+4H+ (2分)
32. (1) 置换(1分) (2) 3Br2+3![]() = 5Br-+
= 5Br-+![]() +3CO2↑(2分) (3) 5NaBr+NaBrO3+3H2SO4 = 3Br2+3Na2SO4+3H2O(2分) (4) 加NaBr(2分)
+3CO2↑(2分) (3) 5NaBr+NaBrO3+3H2SO4 = 3Br2+3Na2SO4+3H2O(2分) (4) 加NaBr(2分)
33.(每个离子1分)Na+、![]() 、OH-、
、OH-、![]() 、Cl-
、Cl-
34.由提示知,还原性:Fe2+>Br-,Br-已部分被氧化,故Fe2+已全部被氧化。(2分)
设原FeBr2的物质的量浓度为x,根据氧化还原反应中,得电子总数等于失电子总数,(1分)可得:
(x+2x×![]() )×0.1 L×1 = 2×
)×0.1 L×1 = 2×![]() (2分)
(2分)
x = 1.2 mol·L-1 (1分)
35.设金属的化合价为+n,相对原子质量为M,
n (O2) = ![]() = 0.01 mol (1分)
= 0.01 mol (1分)
由4OH--4e = O2+2H2O,根据电子转移守恒原理可得:
0.01 mol×4 =1.28 g×![]() ,M = 32n
(2分)
,M = 32n
(2分)
讨论:当n = 1,M = 32,查相对原子质量表,无此金属元素,舍去; (1分)
当n = 2,M = 64,为铜, (1分)
该金属的氧化物为氧化铜。 (1分)
(2) 2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
n (H2SO4) = 2 n (O2) = 2×0.01 mol = 0.02 mol (2分)
c (H2SO4)
= ![]() = 0.22 mol / L (2分)
= 0.22 mol / L (2分)