氧族元素(三)
选择题,每题有1个选项符合题意
1、下列酸中酸性最强的是
A氢硫酸 B亚硫酸 C硒酸 D硫酸
3、下列各组酸和碱反应,离子方程式为H++OH- =H2O的是
A、盐酸和烧碱溶液 B氢硫酸和石灰水 C硝酸和氨水 D硫酸和氢氧化钡溶液
10、下列物质既不能与浓硫酸共存又不能与烧碱共存的是
A 、 SO2 B、 H2S C、 CO2 D 、 Cl2
11、将含有7.65g铁粉和1g硫粉的混合物隔绝空气加热,充分反应后再冷却至室温,然后使其与足量盐酸作用,则生成气体的体积(STP)
A、3.024L B、2.8L C、2.34L D、5.6L
14、下列酸保存时不一定要密封的是
A、氢硫酸B、浓硫酸 C、浓盐酸D、稀硫酸
15、鉴别纯碱,石灰石,芒硝,石膏四种固体物质,下列试剂中应选
(A) NaOH溶液 (B) 水、盐酸 (C) HNO3溶液 (D) BaCl2.HNO3混合液
16、向氢硫酸中加入下列溶液或气体后,溶液中S2-个数增加的是
(A)O2 (B)CuSO4 (C)KOH (D)Cl2
17、使物质的量浓度相同,体积比为3:2的Na2SO4和Al2(SO4)3溶液中的SO42-完全沉淀,用去同浓度的Ba(NO3)2溶液的体积比是
(A)1:1 (B)1:2 (C)1:3 (D)2:3
18、某结晶水合物的化学式为A.nH2O,若A的式量为M,加热a克结晶水合物,直至结晶水全部失去,剩余残渣质量为b克,则n值为
(A)![]() (B
(B![]() (C)
(C)![]() (D)
(D)![]()
21、选用一种试剂能把浓度为1 mol/l的Na2SO3. Na2SO4. Na2S. Na2CO3. BaCl2五种无色溶液加以区别,这种试剂为
(A)AgNO3溶液 (B)CaCl2溶液 (C)Ba(OH)2溶液 (D)H2SO4稀溶液
23、设NA表示阿伏加德罗常数,下列说法正确的是
(A)12gFeS2高温完全燃烧,将持失去电子4NA
(B)11.2L H2S气体含有的原子数为1.5 NA
(C)34gH2S气体所含电子数为18NA
(D)1mol/l.200ml Na2SO4溶液含有Na+数目为0.02 NA
24、下列溶液中含SO42-数目最多的是
(A)200ml 0.1mol/l Na2SO4 (B)200ml 0.05mol/l Al2(SO4)3
(C) 200ml 0.1mol/l KAl(SO4)2 (D)150ml 0.1mol/l MgSO4
25、将BaCl2.xH2O晶体2.44g溶于水配成100ml溶液,,取此溶液25ml跟50ml 0.1mol/l的AgNO3溶液作用,刚好把Cl-离子沉淀完全,由上述实验得出的下列结论中不正确的是
(A) BaCl2.xH2O的摩尔质量是244g.mol-
(B) x的值是2 (C)配成的100ml溶液中Cl-浓度为0.01mol/l
(D) 配成的100ml溶液中Ba2+浓度为0.01mol/l
27、下列实验用来证明SO2的存在,其中正确的是
①能使品红溶液褪色 ②能使湿润的蓝色石蕊试纸变红③能使澄清的石灰水变浊④通入足量的NaOH溶液中,再滴入BaCl2溶液,有白色沉淀生成,该沉淀溶于盐酸⑤通入溴水使其褪色,再滴入Ba(NO3)2溶液,有白色沉淀
(A)都能证明(B)都不能证明(C)①⑤能证明(D)只有⑤能证明
28、下列物质在一定条件下与KOH溶液反应,可生成两种盐。但非氧化还原反应的是
(A)Cl2(B)S(C)H2S(D)SO2
1、氧族元素按核电荷数递增排列为(写元素符号和名称)______________________________除氧以外正化合价为______________,若以R表示氧族元素,则气态氢化物通式为________
最高价氧化物的通式为_______,最高价氧化物对应的水化物通式为_____________.
2、硫原子的结构简图是______________,硫离子的结构简图是_________________,二者半径比较R(S)_______R (S2-)
3、氧族元素比较(钋除外)
(1)原子半径由小到大的顺序是(写符号)________________________
(2)离子半径由小到大的顺序是(写符号)__________________________
(3)单质跟H2化合时,由易到难的顺序是(写化学式)______________________
(4)气态氢伦物稳定性由强到弱的顺序是(写化学式)________________________
(5)最高价氧化物对应的水化物酸性由强到弱的顺序是(写化学式)_____________________
4、H2S与HCl比较(用“>”表示强于)
(1)稳定性______________ (2)溶解度________________
(3)还原性_________________ (4)水溶液的酸性_________________________
5、某元素R的气态氢化物为H2R,R在某最高价氧化物中的质量分数为40%,元素R是_______,R的最高价氧化物的水化物的摩 尔质量是____________________
6、氧族元素跟对应的卤族元素比较(O——F,S——Cl ……),核电荷数较______,最外层电子数较______,非金属性______,跟氢化合能力______,生成的气态氢化物较_______.
7、举例说明硫的非金属性没有氧、氯的非金属性强,并用原子结构观点加以解释。
答:
8、解释下列现象,写出有关反应方程式
(1)新配制的氢硫酸敞口放置会逐渐变浊
(2)用亚硫酸钠可清除水中少量氯气
(3)用稀硫酸可以除去铜缘[Cu2(OH)2CO3]
9、燃烧2.3克酒精(C2H5OH)生成液态水和二氧化碳,放出68.6千焦的热,则酒精燃烧的热化学方程式为_______________________________
10、在硫化钾溶液中分别加入下列物质,各有什么现象?写出离子方程式
| 加入物质 | 发生现象 | 离子方程式 |
| 稀盐酸 | ||
| 氯气 | ||
| 硝酸银溶液 | ||
| 氯化亚铁溶液 |
11、用一种试剂鉴别K2S KOH KNO3 BaCl2 四瓶无色溶液,这种试剂是____________,
离子方程式为(1)__________________________;(2)_____________________________;
(3)__________________________________________
12、下列物质能否反应,能反应的写出反应方程式
Cu+H2SO4( 稀)__________________________
Cu+H2SO4( 稀)+O2=_______________________ ( Ag Hg与之相同)
Cu+H2SO4( 浓)=____________________________
Fe+H2SO4( 稀)=______________________________ (Al与之相同)
Fe+H2SO4( 浓)=______________________________
Fe+H2SO4( 浓)=______________________________
NaCl+H2SO4( 稀)=______________________________ (KCl MgCl 2 与之相同)
NaCl+H2SO4( 浓)=______________________________
NaCl+H2SO4( 浓)=______________________________
NaCl+NaHSO4=______________________________
K2S+H2SO4( 稀)=______________________________ (Na2S MgS 与之相同)
K2S+H2SO4( 浓)=_______________________
KI+H2SO4( 稀)=______________________________ (NaBr 与之相同)
KI+H2SO4( 浓)=______________________________
C+H2SO4( 稀)=______________________________ (S P与之相同)
C+H2SO4( 浓)=______________________________
FeS+H2SO4( 稀)=______________________________
FeS+H2SO4( 浓)=______________________________
13、配平下列氧化还原方程式,标出电子转移方向和数目
(1)FeS2+ O2= Fe2O3+ SO2
(2) KNO3+ C+ S = K2S+ CO2↑+ N2↑
(3) Cu2S+ HNO3= Cu(NO3)2+ H2SO4+ NO↑+ H2O
(4) KI+ KMnO4+ H2SO4= K2SO4+ MnSO4+ H2O+ I2
14、Na2SO4既具有还原性,也有氧化性,现有试剂:溴水,Na2S溶液,Na2SO3溶液,稀硫酸,NaOH溶液,BaCl2溶液
(1)要证明Na2SO3具有还原性,应选用的试剂是________________________,观察到到的现象是________________,离子方程式是__________________________________
(2)要证明Na2SO3具有氧化性,应选用的试剂是_____________________观察到的现象是___________________,离子方程式是______________________________________
15、有由Ba(NO3)2 CaCO3 Na2S CuSO4 BaCl2中的一种或几种组成的固体混合物,(1)溶于水得蓝色溶液和白色溶液,再加盐酸沉淀不溶解,则混合物中一定含有____________,一定无______________,可能有__________________(2)将混合物溶于水后过滤,向蓝色溶液中滴加硝酸酸化后,再加入AgNO3溶液无明显现象 ,由此可判断该混合物的组成是________________________________
16、在C和CuO的混合物0.36g中加入适量浓硫酸,加热使固体全部溶解,再加水稀释至500ml向此溶液里加入过量的NaOH溶液,得蓝色沉淀0.539g。求:(1)原混合物Cu和CuO的质量比,(2)500ml溶液中CuSO4的物质的量浓度
氧族元素(二)
1、A和B 在常温下都是气体,在空气中都不能被点燃,A和分子量大于B,现作如下实验,在A溶液中通入适量B,溶液酸性明显增强,继续加入硝酸钡溶液,得到一种不溶于稀硝酸的白色沉淀,过滤,溶液显无色,再向溶液中加入硝酸银溶液,析出另一种不溶于稀硝酸的白色沉淀,则A为___________B为__________上述实验的各步反应方程式为(1)__________________________(2)_____________________________
(3)__________________________________
2、A、B、C、D四种可溶性盐,它们的阳离子是Ag+ Cu2+ Ba2+ Na+ 阴离子是SO42- NO3- Cl- SO32-(四种盐所含离子各不相同),现做如下实验,从而判断它们的化学式,(1)若把四种盐分别溶于四支试管中,只有C盐溶液显蓝色,(2)若向上述四支试管中分别加入盐酸,B盐酸溶液有沉淀,D盐溶液有刺激性气体逸出,A、C无明显现象
则A为_____________、B为_______________、C为___________、D为_____________
写出B与盐酸,D与盐酸反应的离子方程式
__________________________ __________________________________
3、有黑色和黄色两种固体物质M和N,它们都是由相同元素组成,M与稀H2SO4反应产生气体P,N在充足的空气中高温燃烧生成气体Q,P和Q的水溶液都显酸性,都能使溴水褪色,但P和Q混合后生成固体R,由此可判断M______,N_________,P_________,Q____
写出有关的反应方程式:
M+H2SO4(稀)→P__________________________
N+O2→Q__________________________________
P+溴水_________________________________
Q+溴水_______________________________
P+Q→R________________________________
4、根据下列实验事实判断物质A——F的化学式
(1)A和C混合后用强光照射迅速化合而爆炸,生成的无色气体通过AgNO3溶液时,产生不溶于稀HNO3的白色沉淀
(2)B的蒸气和C直接化合生成气体D,而D和E混合又生成B
(3)D有剧毒,通常情况下在水中溶解度1:2.6
(4)E和F的水溶液均置弱酸性,都能使澄清石灰水变浑浊,但E能使品红溶液褪色,F不能
A______B_______C_______D_________E__________F_________
5、某无色混合气体,可能含有CO.H2 SO2 Cl2 HCl气的一种或几种,把它通入Ca(OH)2溶液时无任何现象 ,再通过红热的CuO,黑色粉末变为红色,再通入AgNO3溶液未见沉淀,由此可推断混合气体中,一定有_______________一定没有_________________,可能有_________________
分析:
6、实验室用干燥无水Na2CO3配制100ml 1mol/l的Na2CO3溶液时,需要Na2CO3质量为______克,并从下面各项操作中排出正确的操作顺序(用①②…..填入各项前括号内)
( )用天平称取所需Na2CO3的质量
( )将溶液注入100ml容量瓶中
( )将称取的Na2CO3置于烧杯内,加约50ml蒸馏水溶解后,冷却
( )用蒸馏水洗涤烧杯2—3次,将洗涤液全部注入容量瓶中,摇匀
( )改用胶头滴管小心滴入蒸馏水至刻度
( )仔细用蒸馏水直接注入容量瓶中,直至液面接近刻度2-3cm处
( )塞上瓶塞反复摇匀
配制时,除上述已写出的仪器外,还应有仪器______________________________
7.
| SO42- CO32- S2- Cl- |
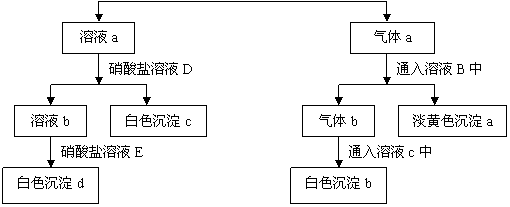 ↓
↓
(1)写出上述每一个步骤中试剂的化学式或名称
A________B_________C___________D____________E____________
(2)写出各生成物所含物的化学式或离子
气体a__________气体b___________溶液a__________溶液b___________
沉淀a__________沉淀b____________沉淀c_________沉淀d_____________
![]() 8、甲乙丙三位同学各设计了一个实验,结果各自都认为自己的试样中含有SO42- ,甲的实验为
:
8、甲乙丙三位同学各设计了一个实验,结果各自都认为自己的试样中含有SO42- ,甲的实验为
:
![]() ①乙认为甲的实验不严谨,因为试样A中若含___________离子(仅填一种),也会有此现象,乙的实验为:
①乙认为甲的实验不严谨,因为试样A中若含___________离子(仅填一种),也会有此现象,乙的实验为:
②丙认为乙的实验也为严谨,因为试样B中若含_______离子(仅填一种),也会有此现象,丙的实验为:
![]() 你认为丙的实验是否严谨?说出理由:
你认为丙的实验是否严谨?说出理由:
9、已知硫粉跟亚硫酸钠溶液共热可制得硫代硫酸钠,现以硫化亚铁为原料,按下面流程图制取硫代硫酸钠。
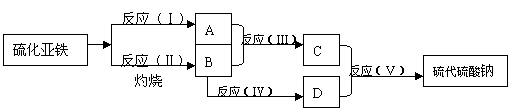 |
图中A、B、C、D为硫的单质或化合物,其它不含硫的生成物已被略去,各步反应可以添加必要的试剂。请填写下列空白
(1)写出反应(I)的化学方程式_________________________________
(2)写出反应(Ⅱ)的化学方程式_________________________________
(3) 写出反应(Ⅲ)的化学方程式__________________________________
D的化学式________________________
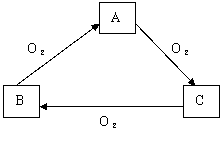 10、常温下某种淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有下图所示的转变关系,试回答:
10、常温下某种淡黄色固体单质A,与它的气态氢化物B和氧化物C之间,有下图所示的转变关系,试回答:
(1)A是_______B是_______C是_______
(2)若B的物质的量为x,O2的物质的量为y
![]()
①当B跟O2反应恰好完全转化为A时,x与
y的数值关系应为___________
②当B转化为C时,常温下只有一种气体,
x与y的数值关系应为_______________
(3)B与C发生反应时,无论B和C的物质的量如何,反应得到的氧化产物和还原产物的质量比为___________
11、30ml 0.1mol/l的Na2SO3溶液恰好将2х10-3mol XO4离子还原,此反应的离子方程式为________________________,元素X在还原产物中的化合价是_____________
一、填空题
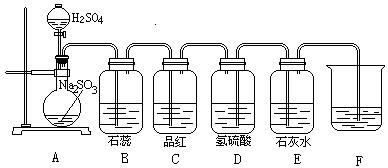
1、(6分)
下图为实验制取SO2及其性质实验,填出下列空白。
| 实验现象 | 有关化学方程式 |
| A | |
| B | |
| C | |
|
|
|
| E |
其中:仪器F的作用是________,F中加入的药品可以是________,发生的化学反应方程式为________________。
翰林汇
2、(6分)
在BaI2溶液中滴入氯水,观察到的现象是______;再通入SO2,观察到的现象是______;反应涉及的化学方程式为______、______、______。
翰林汇
3、(6分)
完成下列氧化-还原方程式(不得重复出现)
1.![]()
![]()
![]() 2.
2.![]()
![]()
![]()
3.![]()
![]()
![]() 4.
4.![]()
![]()
![]()
5.![]()
![]()
![]() 6.
6.![]()
![]()
![]()
翰林汇
4、(6分)
如何鉴别下列各组物质,填在表中:
| 溶液名称 | 所用试剂 | 化学方程式 |
| Na2SO3和Na2SO4 | ||
| Na2SO3和Na2CO3 | ||
| NaCl和Na2SO4 | ||
| Na2S和Na2SO3 |
翰林汇
5、(6分)
在三种钠盐溶液里分别加入一种相同的钡盐溶液,结果都生成了白色沉淀,向三种沉淀中分别加入盐酸后,一个无变化,一个生成使石灰水浑浊的无色无嗅气体,一个生成使品红褪色的气体,分别再向滤液中加入AgNO3溶液和稀硝酸,都有白色沉淀生成。则:
三种钠盐的化学式:____。加入钡盐的化学式____。有关离子方程式____。
翰林汇
6、(6分)
为验证木炭与浓硫酸反应生成的气体M含有CO2和SO2,可按下图进行实验。各装置中可供选择的试剂是:①澄清石灰水,②品红溶液,③酸性高锰酸钾溶液。判断各装置所盛试剂后,请回答:
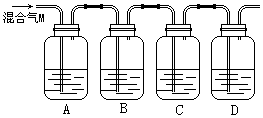
(1)A中所盛放的试剂是______(填写试剂序号)。
(2)B中的实验现象______。
(3)C中所盛剂的作用______。
翰林汇
7、(6分)
有A~F共6种气体,根据下面事实判断各是什么气体,写出有关化学方程式:
①D极易溶于水; ②C、D、E、F四气体的溶液,pH值均小于7
③A在C中燃烧生成D,火焰为苍白色;
④F在B中完全燃烧生成E,E有漂白性。
(1)六种气体的化学式:A____ B____ C____ D____ E____ F____。
(2)有关化学方程式:
A+C ![]() D:
F+B
D:
F+B ![]() E:
E:
翰林汇
8、(6分)
接触法制硫酸时在沸腾炉中发生反应的化学方程式为________,在此反应中发生氧化的铁元素与硫元素电子转移的物质的量之比为____,制得的炉气要净化的目的是________。
翰林汇
9、(6分)
现有五种溶液标号为甲、乙、丙、丁、戊,它们分别溶有AgNO3、BaCl2、HCl、K2CO3、K2SO3中的一种。实验得知,甲与其余4种相遇均有白色沉淀生成;丙、丁、戊相遇,丁、戊相遇也有白色沉淀生成;乙、丙混合有无嗅气体生成,则五种溶质的化学式分别是:甲____乙____丙____丁____戊____。
翰林汇
二、简答题
1、(13分)
只用BaCl2溶液和试管,鉴别Na2SO3溶液和稀H2SO4,简述鉴别步骤、现象和结论。(上述3种溶液只准取用一次)
翰林汇
2、(13分)
下面是A、B两种盐所进行的实验记录,其中H、G均为不溶于酸的白色沉淀:
由此推知A、B以及实验过程中产生的C、D、E、F、G、H各是什么物质(用化学式表示)。
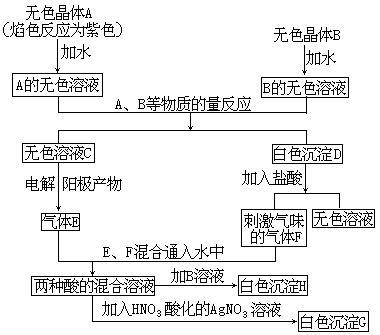
A 、B 、C 、D 、E 、F 、G
H 。
翰林汇
三、计算题
1、(20分)
将Na2SO3与Na2S的混合物若干克配制成50g溶液, 加入50g一定浓度足量的盐酸,放出气体0.448L(标准状况),混合液为96.9g。求混合物中Na2SO3与Na2S的物质的量各为多少?
翰林汇
练习 第六章 氧族元素
1、氧族元素包括: 。随着原子序数的递增,原子半径: 金属性 非金属性: 。H2S、HF、H2O、H2Se稳定性顺序是: 还原性顺序是: 。
2、用电子式表示下列物质的形成过程:
Na2O MgCL2 NH3 H2S
3、比较S和CL2的氧化性: 强,原因是: 。比较S和O2 的氧化性顺序:
强,原因是: 。
4、写出下列反应的方程式:
(1) F2和水的反应: (7) H2S和氯水的反应:
(2) Cu和S的反应:
(3) Fe和S的反应: (8)氢硫酸的电离:
(4) 铁CL2的反应:
(5) S和NaOH溶液的反应: (9)O2变成O3:
(6) 标况下H2S22·4L和含有氢氧化钠1mol的溶液 反应 :
(10): 标况下100L的H2S和100L的O2充分反应:
5、X、Y、Z和R分别代表四种元素. 如果![]() Xm+、
Xm+、![]() Yn+、
Yn+、![]() Zn-、
Zn-、![]() Rm- 四种离子的电子层结构相同(a、b、c、d为元素的原子序数), 则下列关系正确的是( )
Rm- 四种离子的电子层结构相同(a、b、c、d为元素的原子序数), 则下列关系正确的是( )
A. a – c = m + n B. a – b = n – m C. c – d = m + n D. a + d = c + b
6、若原子序数为 116 号元素, 其元素最外层电子数为 6, 则下列叙述正确的是( )
A. X 是金属元素 B. X的钠盐的化学式为: Na2X
C. X的最高价氧化物的化学式为: XO3 D. X的最高价氧化物的水化物为强酸
7、下列性质的递变规律正确的是( )A. Na、Mg、Al的还原性依次减弱 B. HCl、PH3、H2S的稳定性依次减弱C.S2-、Cl-、Ca2+ 的离子半径依次减小 D. C、N、O、F 的原子半径依次增大
8、下列关于物质性质变化的比较, 不正确的是( )A. 酸性强弱: HI > HBr > HCl > HF
B. 原子半径大小: Na > S > O C. 碱性强弱: KOH > NaOH > LiOH D.还原性强弱: F- > Cl- > I-
9、氢化锂(LiH)是一种离子化合物, LiH 与 H2O 反应可以放出氢气, 下列有关叙述正确的是( )
A:其水溶液呈酸性 B. H- 与 He 原子的核外电子排布相同
C. 微粒半径: r(H-) > r(Li+) D. H- 可以被还原成氢气
10、短周期元素X和Y能形成XY4型化合物,若X的原子序数为m,Y的原子序数为n,则m和n的关系不可能的是( )A. m—13 =n B. n+5 =m C. m+8 = n D. n—11=m
11、Rn- 离子核外有m个电子,其质量数为A,则Rn- 离子中所含的中子数为 ( )
(A)A-m-n (B)A-m+n (C)A+m-n (D)A+m+n
12、铊是超导材料的组成元素之一,铊位于第六周期ⅢA族,元素符号是Tl。以下对铊的性质推断中肯定不正确的是( )(A)铊是易导电的银白色金属 (B)能生成+3价的离子化合物
(C)能与H+反应生成H2 (D)Tl3+ 的氧化性比Al3+ 强
13、漂白原理不是使有机质氧化褪色的物质是( )
A 、SO2 B、 氯水 C、Na2O2 D、O3 E、活性炭
14、下列分子中,具有极性键的非极性分子是( )A、NH3 B、CH3Cl C、CO2 D 、H2O
15、NaHS、MgSO4、NaHO4三种物质组成的混合物中,已知硫元素的质量分数为a%,则其中氧元素的质量分数为( )A a% B 2 a% C 1—1·75 a% D 1—0·75a%
6、实验室用干燥无水Na2CO3配制100ml 1mol/l的Na2CO3溶液时,需要Na2CO3质量为______克,并从下面各项操作中排出正确的操作顺序(用①②…..填入各项前括号内)
( )用天平称取所需Na2CO3的质量
( )将溶液注入100ml容量瓶中
( )将称取的Na2CO3置于烧杯内,加约50ml蒸馏水溶解后,冷却
( )用蒸馏水洗涤烧杯2—3次,将洗涤液全部注入容量瓶中,摇匀
( )改用胶头滴管小心滴入蒸馏水至刻度
( )仔细用蒸馏水直接注入容量瓶中,直至液面接近刻度2-3cm处
( )塞上瓶塞反复摇匀
配制时,除上述已写出的仪器外,还应有仪器______________________________