高中毕业班第一次统一测试化学题
第一部分选择题(共72)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Si 28 S 32 Ca 40
一、选择题(本题共8小题,每小题4分,共32分。每小题只有一个正确选项)
1.“绿色化学”越来越受到人们的重视和欢迎,下列可以看作绿色氧化剂的是
A.氯水B.浓盐酸C.双氧水D.硝酸
2.将SiCl4与过量的液氨反应可生成化合物Si(NH2)4将该化合物在无氧条件下高温灼烧,可得到氮化硅(Si3N4)固体,氮化硅是一种新型的耐高温、耐磨材料,在工业上有广泛的应用。则氮化硅所属的晶体类型是
A.原子晶体B.分子晶体C.离子晶体D.金属晶体
3.新兴的大脑营养学研究发现,大脑的生长发育与不饱和脂肪酸有密切关系。被称为脑黄金的DHA就是一种不饱和程度很高的脂肪酸,它的分子中有6个C═C键,学名二十六碳六烯酸,它的分子组成是
A.C25H50COOH B.C25H39COOH C.C26H41COOH D.C26H47COOH
4.下列芳香烃的一氯取代物的同分异构体数目最多的是

5.下列除去括号内杂质的有关操作正确的是
A.苯(苯酚):加浓溴水振荡,分液
B.亚硫酸钠溶液(硫酸钠):加入过量的氯化钡溶液、过滤
C.肥皂液(甘油):加食盐颗粒,过滤
D.乙酸乙酯(乙酸):加氢氧化钠溶液,蒸馏
6.NaH是一种白色晶体,其中钠是+1价,NaH与水反应放出H2,则下列叙述正确的是
A.NaH在水中呈酸性 B.NaH中氢离子的电子层排布与氦原子的相同
C.NaH中氢离子可被还原成氢气 D.NaH中钠离子的半径比Li+离子半径大
7.某温度卜,在容积固定的密闭容器中发生可逆反应:
A(气)+2B(气)![]() 2Q(气)。
2Q(气)。
平衡时,各物质的浓度比为c (A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充入A、 B、Q,则下列叙述正确的是
A.刚充入时反应速率v正减少,v逆增大
B.充入气体后平衡不发生移动
C.达到新的平衡时c(A):c(B):c (Q)仍为1:1:2,
D.达到新的平衡过程中,体系压强先增大,后逐渐减小
8.己知:2H2(g)+02(g)=2H2O(1);△H=一571.6kJ/mol,CH4的燃烧热为890.3kJ/mol。某H2与CH4的混合气体完全燃烧时放热146.19 kJ,将生成的气体通入足量的石灰水生成10gCaCO3沉淀。则原混合气体中H2和CH4的物质的量之比是
A.1:1 B.2:1 C .1:2 D.3:1
二、选择题(本题包括10小题,每小题4分共40分。每小题有1-2个正确选项。若正确答案只包含一个选项,多选时该题为0分:若正确答案包括两个选项,只选一个且正确给2分,选两个且都正确给4分,但只要选错一个,该小题为0分)
9.人体血红蛋白中含有Fe2+,如果误食亚硝酸盐会使人中毒,因为亚硝酸盐会使Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与O2的结合能力。服用维生素C可以缓解亚硝酸盐的中毒,这说明维生素C具有
A.酸性B.碱性C.氧化性D.还原性
10. A、B都是短周期元素,原子半径B>A,它们可以形成化合物AB2,由此可得出的正确判断是
A.A、B可能在同一周期 B. A、B的单质都不可能是原子晶体
C. A肯定是金属元素 D. A可能在第二周期的II A或VI A
11.设NA为阿伏加德罗常数,则下列说法正确的是
A.1 molSiO2晶体中含有4NA个Si─O键
B.22.4 L乙烯中含有的分子数为NA
C.0.1 L 0.1 mol/L的CH3COOH溶液中含有的分子数为0.01 NA个
D.含0.1 mol H2O2的水溶液跟MnO2充分作用,反应过程中转移的电子总数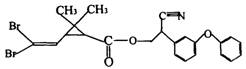 0.01NA个
0.01NA个
12.拟除虫菊酷是一类高效、低毒,对 昆虫有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构式如右图。下列说法错误的是
A.属于芳香类化合物 B.属于卤代烃
C.在酸性或碱性条件下可水解D.能与卤素发生加成或取代反应
13.可逆反应2SO2+O2![]() 2SO3正反应速率分别用v(SO2)、v(O2)、v(SO3)[mol/(L·min)]表示,逆反应速率分别用v'(SO2)、v'(O2)、 v'(SO3)[mol/(L·min) ]表示,当反应达到化学平衡时,正确的关系是
2SO3正反应速率分别用v(SO2)、v(O2)、v(SO3)[mol/(L·min)]表示,逆反应速率分别用v'(SO2)、v'(O2)、 v'(SO3)[mol/(L·min) ]表示,当反应达到化学平衡时,正确的关系是
A.v'(O2)= v'(SO3) B.v(SO3)= 1/2 v'(O2)
C.v'(O2)=1/2 v'(SO2) D.v(SO2)=v(O2)=v(SO3)
14.氢氧燃料电池是一种高性能电池,总反应为2H2+O2==2H2O,电解质溶液为KOH溶液,下列有关该电池的叙述中错误的是
A.H2为负极,O2为正极 B.工作时电解质溶液的pH不断增大
C.负极反应:2H2-4e一+4OH-=4H2O D.正极反应:O2 +4e-+2H2O=4OH-
15.三氯化氮分子中每个原子其最外层均达到8电子稳定结构,且氮与氯的共用电子对偏向于氮原子。则下列关于三氯化氮的叙述正确的是
A.NC13的电子式应表示为![]()
B.在NC13分子中N为+3价,跟水发生水解反应的产物是HNO2和HCI
C.NC13跟水反应的产物为NH3和HC1O
D.NCl3跟水反应生成NH4C1、O2和C12
16.下列反应的离子方程式一定正确的是
A.将氯气通入水中:C12+H2O==2H++Cl-+CIO-
B.向水玻璃中滴入盐酸:SiO32-+2H++2H2O=H4SiO4 ↓
C.过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+A1O2- =AI(OH)3 ↓+HCO3-
D.向碳酸氢钙溶液中加足量的氢氧化钠溶液:Ca2++ HCO3-+OH-==CaCO3↓ +H2O
17.某无色透明的溶液中,水电离出的c(OH-)=l0-13 mol/L。下列各组离子一定能在此溶液中能大量共存的是
A.Fe2+、K+、SO42-、NO3- B.Mg 2+、NH4+、SO42-、Cl-
 C.Na+、K+、SO42.、NO3- D.Ba2+、Na+MnO4-、SO32-
C.Na+、K+、SO42.、NO3- D.Ba2+、Na+MnO4-、SO32-
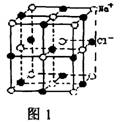
18.NaCl晶体中最小重复单元(晶胞)如右图所示。已知:氯化钠的摩尔质量为M g/mol,某一定条件一下NaCl晶体中最邻近的钠离子和氯离子中心间的距离为a cm,晶体的密度为b g/cm3。则下列叙述正确的是
A.每个Na+周围最近且等距离的Cl一所围成的空间构型为正六面体
B.每个Na+周围最近且等距离的Cl一所围成的空间构型为正八面体
C.阿伏加德罗常数NA可表示为M/2a3b
D.阿伏加德罗常数NA可表示为4M/a3b
第二部分非选择题(共78分)
 三、(本题共2小题,共22分)
三、(本题共2小题,共22分)
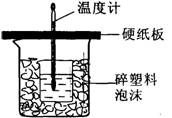
19.(10分)50mL0.5mol/L的盐酸与50mL0.55mol/L的
NaOH溶液在下图所示的装置中进行中和反应。通过测定
反应过程中所放出的热量可计算中和热。请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是__
;由图可知该装置有不妥之处,应如何改止?________。
(2)烧杯间填满碎塑料泡沫的作用是_________。
(3)大烧杯上如不盖硬纸板,则求得的中和热数值____(填“偏大”、“偏小’、“无影响”)。
(4)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”),理由是_________;所求中和热的数值会_______(填“相等”或“不相等”),理由是______。
 (5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会____(填“偏大,,、“偏小”、“无影响”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会____(填“偏大,,、“偏小”、“无影响”)。
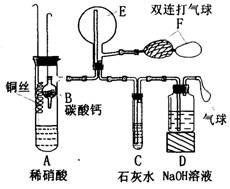
20.(12分)为了验证铜与稀硝酸反应产生的是一氧化氮,某校学生实验小组设计了一个实验,其装置如右图所示(加热装置和固定装置均己略去)。B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离.设计此步操作的目的是______。.
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为__________________。
(3)装置E中开始时出现浅红棕色气体,原因是________;用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,原因是_________。
(4)如果要用第(1)步操作产生的CO2将E中的空气排得更干净,在不增加其它仪器的情况下,应怎样改进E?_____________。
(5)一段时间后,C中白色沉淀溶解,其原因是____________。
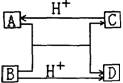 (6)装置D的作用是____________。
(6)装置D的作用是____________。
四、(本大题包括2小题,共18分)
21.(6分)已知A, B, C, D四种不同粒子。他们之间存在如右图关系:
(1)如果A、B、C、D均为10电子的粒子,则A的结构式为________;D的电子式为_______。
(2)如果A为一种金属阳离子,且A、B、D均为10电子粒子,C为30电子粒子。试写出:A和B在溶液中反应生成C和D的离子方程式。_______。
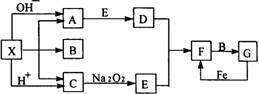 22.(12分)右图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据右图关系推断:
22.(12分)右图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据右图关系推断:
(1)化学式:X___,A___,B___。
(2)实验室收集气体D和F的方法依次是_____法、_____法。
(3)写出C→E的化学反应方程式___________________。
(4)请写出A与E反应生成D的化学方程式:__________。
 五、(本大题包括2小题,共18分)
五、(本大题包括2小题,共18分)
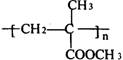
23.((8分)有机玻璃(结构简式如右图)是由有机物X 加聚制得的热塑性塑料。为透明如玻璃状的无色固体,可用以制造航空玻璃、仪表盘、外科照明灯、装饰品和生活用品等。请回答下列问题:
(1)写出X的结构简式_____________;
(2)在下列反应中,有机物X不能发生的反应有______(填写序号);
①和氢气加成;②使溴水褪色:③被酸性高锰酸钾溶液氧化;④水解反应;⑤酯化反应;⑥消去反应。
(3)有机物X有多种同分异构体,其中含有2个甲基、且属于不饱和梭酸类的有机物分子的结构简式为_______________。
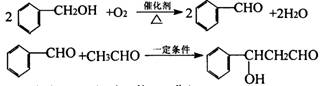
24.(10分)已知有以下两种类反应:
①羧酸的钠盐与碱石灰共热,可以发生脱去羧基的反应:
RCOONa+NaOH![]() RH+Na2CO3
RH+Na2CO3
②两个醛分子在一定条件下可以自身加成。下式中反应的中间产物(III)可看成是由(I)中的碳氧双键打开,分别跟(II)中的2一位碳原子和2一位氢原子相连而得。(III)不稳定,受热即脱水而生成不饱和醛(烯醛):’
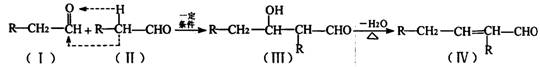
有机物A的分子式为C14H 12O2在一定条件下,按照下列框图进行反应。其中C完全燃烧生成CO2和水的物质的量比为2:1,且C不能使酸性高锰酸钾溶液褪色。

请回答下列问题:
(1)写出有机物A的结构简式____,其名称是_________。
(2)有机物A∽H中,属于芳香烃的是______。
(3)写出下列反应的化学方程式:B→C______;E→F___:F→G_______。
六、(本大题2小题,共20分)
25. (8分)某校研究性学习课外环保监测小组对采集气体样品中所含污染气CO的浓度进行测定,其方法与步骤如下:
a.首先使采集的气体样品2.00L缓缓通过I2O5的加热管,发生反应:
5CO+ I2O5==5C O2+I2 :
b.将产生的I2升华,并由浓度为0.005mol/L的Na2S2O3溶液30.0mL完全吸收,此时发生反应I2+2 Na2S2O3==2NaI+ Na2S4O6 ;
c.向b的溶液中加4滴淀粉溶液作指示剂,用浓度为0.01 mol/L的I2水滴定,耗去5.00mL的溶液恰好变色。
(1)操作c中,滴定终点时溶液由_____色变为_____色
(2)步骤a中由CO与I2O5反应生成I2的物质的量是多少?
③该气体样品中CO的浓度为多少mg/L?
26.(12分)为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的 S O2及(NH4)2SO4和NH4HSO4固体。
为测定上述(NH4)2SO4和NH4HSO4固体棍合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出【(NH4)2SO4和NH4HSO4的分解温度均高于200℃,测得有关数据如下(标准状况):
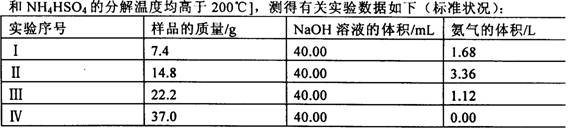
(1)测定过程中有关反应的离子方程式为__________。
(2)由I组数据直接推测:标准状况下3.7g样品进行同样实验时生成氨气的体积为_____。
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___。
(4)欲计算该NaOH溶液的物质的量浓度应选择第_____组数据,理由是_____。并由此计算NaOH溶液的物质的量浓度,写出计算过程。
高中毕业班第一次统一测试
化学题参考答案和评分标准
一、选择题:1.C,2.A,3.B,4.B,5.C,6.B,7.p,8.B。
二、选择题:9 .D,10.D,11.A D,12.B,13.C.14.B 15.AC,16.BC,17.C,18.BC (17.C提示:设阿伏加德罗常数为NA,则:![]() ,解得NA= M/2a3b)
,解得NA= M/2a3b)
三、(本题共2小题,共22分)
19.(10分)(1)(3分)环形玻璃搅拌棒(1分);在大小烧杯间填满碎塑料泡沫(或碎纸条)使小烧杯口与大烧杯口相平(2分)。(2)(1分)减少实验过程中的热最损失,(3)(1分)偏小。(4) (4分)不相等(1分);相等(1分)。因为酸、碱发生中和反应放出的热量与酸、碱的用量有关,而中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量,它与酸、碱的用量无关(2分)。(5) (1分)偏小。
20.(共12分)[方程式化学式1分,系数和条件各0.5分;无条件,系数1分。下同]
(1) (2分)用碳酸钙与稀硝酸反应产生的CO2.用CO2排出装置内的空气;
(2)(2分)3Cu+8HN O3====3Cu(NO3)2+2NO↑+4H2O:
(3) (4分)CO2比空气重,从长管进入E (1分),并没有把E中空气赶尽(1分),致使部分NO先与未赶尽的空气生成少量红棕色NO2(1分);当再从F鼓入空气时,E中有更多NO2生成,所以红棕色加深(1分);
(4)(2分)将烧瓶旋转,使烧瓶底位于下方(或将进气长导管与导出的短导管对换。其它合理回答也给分)。
(5)(1分)二氧化氮与水反应生成的硝酸使碳酸钙溶解;
(6) (1分)防止尾气污染空气(或贮存多余的NO,吸收NO2、CO2尾气)。
四、(本大题包括2小题,共18分)
21.(6分)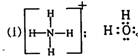
(2)A13++4 OH-=A1O2-+2 H2O(每空2分)
22.(12分) (1)(6分)NH4HCO3〔或(NH4)2CO3〕,NH3,H2O。
(2)(2分)排水、向上排空气
(3)(2分)2C O2+2Na2O2=Na2CO3+ O2↑
(4)(2分)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
五、(本大题包括2小题,共18分)
23.(共8分)(1)![]() (2分);(2)⑤⑥(2分)
(2分);(2)⑤⑥(2分)
![]()
24.(共l0分)
(1)(2分)![]()
(3)(6分,每个方程式2分)![]()
六.(本大题2小题,共20分)
25.(8分)解答:(1)无、蓝。.(2分)
(2)根据题给反应,计算的关系式为:5CO-I2-2Na2S2O3 (1分)
与升华的I2反应的Na2S2O3物质的量为:
![]() (2分)
(2分)
故生成的I2物质的量为:5× 10-5÷2=2.5 × 10-5(mol)(1分)
(3)CO的浓度为:2.5 ×10-5 ×5×28×10-3÷2=1.75(mg/L) (2分)
答:(略)。
26.(共12分)(1)(2分H++OH-=H2O NH4++OH-=NH3+H2O(答案合理均给分)
(2)(2分)0.84L[提示:由数据I和II,7.4g/1.68L=14.8g/3.36L。可知:当样品质量≤14.88时,NaOH足量,即样品质量与氨气体积之比为定值,则:
V(NH3)=3 .7gX 1.68L/7.4g=0.84L ]
(3)(2分)1:4。
{解法提示:设:7.4g样品中(NH4)2SO4的物质的量为x, NH4HSO4的物质的量为y则132g/molx+l 15g/moly=7.4g
2x+y=1.68L/22.4L/mol
解得:x=0.0125 mol,y =0.05 mol
n[(NH4)2SO4]:n(NH4HSO4)=0.0125mol:0.05mol=1:4}
(4) (6分)III(1分)。因为第I第II组的NaOH有可能过量(0.5分),第IV组碱不足,未放出氨气(0.5分);只有第III组的NaOH将H十全部中和后,剩余的NaOH还能与NH4十反应放出了一定量的NH3(0.5分)。
解:设22.2g合物中(NH4)2SO4为amol NH4HSO4为4amo1,则:
132a+115×4a=22.2(0.5分)
解得:a=0.0375(mol),则NH4HSO4为:4 × 0.0375=0.15(mol)(1分)
NaOH先中和NH4HSO4中的H十,再与铵盐产生1.12LNH3(0.5分)
故:n(NaOH)=0.15+1.12/22.4=0.2(mol) (0.5分)
c(NaOH)=0.2÷(4/1000)=5(mol/L)(1分)
答:(略)。