化学高考模拟试卷
第Ⅰ卷 (选择题 共74分)
可能用到的相对原子质量: H-1 O-16 C-12 N-14 S-32 Na-23 K-39 Ca-40
一.选择题(本题包括8小题,每小题只有一个选项符合题意。每小题3分,共24分)
1.某矿泉水标签上印有主要的矿物质成分如下(单位mg/L):Ca 20, K 39 , Mg 3.0 Zn 0.06 , F 0.02 等。这里的Ca、K、Mg、Zn、F是指( )
A.单质 B.元素 C.金属离子 D.分子
2.工矿企业必须严格执行关于“三废”排放标准,并且尽可能地把“三废”变成有用的副产品,否则将会严重地污染环境。下列有关工业生产中的“三废”因任意排放,可能导致“光化学污染”的是( )
A.硫酸工业废气 B.工业生产硝酸的尾气
C.工业电镀锌的废水 D.火力发电厂的废渣
3.明矾的主要成分是KAl(SO4)2·12H2O,关于明矾的下列说法不正确的是
![]() A.电离方程式为:KAl(SO4)2 K++Al3++2SO
A.电离方程式为:KAl(SO4)2 K++Al3++2SO![]()
B.可以做食品的膨化剂
C.能净化水,但不能使硬水软化
D.明矾中有Al3+,多食对人体健康不利
 4.在体积可变的密闭容器中建立氨气在水中的溶解平衡和电离平衡,在右图的容器中按图示操作,下列各项叙述正确的是( )
4.在体积可变的密闭容器中建立氨气在水中的溶解平衡和电离平衡,在右图的容器中按图示操作,下列各项叙述正确的是( )
A.氨水的浓度增大,pH减小
B.液面上氨气的压强增大,水溶液的pH不变
C.液面上氨气的压强不变,溶液的浓度增大,pH变大
D.液面上氨气的压强变大,溶液的浓度增大,NH3·H2O电离度变大
5.在容器中充入SO2和![]() 2,在一定条件下反应达到平衡时,SO2中的
2,在一定条件下反应达到平衡时,SO2中的![]() 含量与平衡前相比将( )
含量与平衡前相比将( )
A.下降 B.不变 C.增大 D.不能确定
 6.分析有机物的结构
6.分析有机物的结构
应具有的性质是:( )
① 缩聚反应 ②加成反应 ③取代反应 ④水解反应 ⑤中和反应 ⑥显色反应 ⑦氧化反应 ⑧还原反应 ⑨消去反应
A.只③⑤⑥⑦ B.只④⑤⑥⑦
C.全部 D.除①④外其余都有
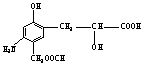
7. 1
mol有机物 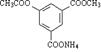 与足量NaOH 溶液充分反应,消耗NaOH 物质的量为( )
与足量NaOH 溶液充分反应,消耗NaOH 物质的量为( )
A.5 mol B.4 mol C.3 mol D.2 mol
8. 某种氯化镁晶体有24Mg2+、35Cl-、37Cl-、三种离子组成,在熔融状态下,使1mol这种氯化镁完全电解,测得产生的气体质量为同体积氧气质量的2.22倍。则这种氯化镁晶体中35Cl-与37Cl-与的物质的量之比为( )
A.1:2 B.2:3 C.1:3 D.3:1
二.选择题(本题包括10小题,每小题有一个或二个选项符合题意。每小题5分,共50分)
9.一种离子与多种酸根离子构成的盐称为“混盐”,如氯化硝酸钙[Ca(NO3)Cl];而复盐是指含有多种简单阳离子和一种酸根离子的盐,如KAl(SO4)2,据此,下列各化合物中属于混盐的是( )
A.(NH4)2Fe(SO4)2 B.CaOCl2
C. BiONO3 D.K3[Fe(CN)6]
10. 对于反应 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) (正反应为放热反应),下列有关叙述正确的是( )
4NO(g)+6H2O(g) (正反应为放热反应),下列有关叙述正确的是( )
A.若降低温度,达到新的化学平衡时,NO的体积分数将增大
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.对NH3与O2的反应来说,化学反应速率关系是2υ(NH3)=3υ(H2O)
11. 在天平的左右两边各放一个烧杯,加入足量盐酸并使天平保持平衡,向左边烧杯中加入14.4gMg,向右边烧杯中加入14.4gAl,此时天平不再平衡,下述操作可使天平恢复平衡的是( )
A. 右边加0.45g Al
B.左边加0.98g Mg
C. 左边加14.4gMg, 右边加15.3g Al
D. 左边加14.4gMg, 右边加14.85g Al
12. 用NA表示阿伏加德罗常数,则下列说法错误的是( )
A.1molCH5+所含的电子数为10NA
B.1molC20H42中含有61NA个共价键
C.25℃时1mL纯水中含有10-10NA个OH-离子
D.22.4L的NH3中含有4NA个原子
13. 用1kg溶剂中所含溶质的物质的量表示的溶液的浓度叫质量物质的量浓度,其单位是mol/kg。某物质的溶液的质量分数为1.96%,质量物质的量浓度为0.2mol/kg,则该物质可断为( )
A.NaHCO3 B.CaCO3 C.KHCO3 D.Na2CO3
14. 酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,下列说法正确的是( )
![]() A.HB-水解方程式:HB-+H2O H3O++B2-
A.HB-水解方程式:HB-+H2O H3O++B2-
B.溶液中离子浓度大小为:c (Na+)>c(HB-)>c(OH-)>c(H+)
C.NaHB的存在抑制了水的电离
D.相同物质的量浓度溶液的pH值:Na2B>NaHB
15. NCl3的电子式为 ![]() ,则NCl3和H2O反应时,最初的生成物一定有( )
,则NCl3和H2O反应时,最初的生成物一定有( )
A.NH3 B.HNO2 C.HClO D.NH4Cl
![]() 16. 可变的密闭容器中盛有适量的N2、H2混和气体,在一定条件下反应:N2+3H2 2NH3达到平衡时容器容积为VL,混合气体中NH3占体积20%,若压强、温度保持不变,下列推论不正确的是( )
16. 可变的密闭容器中盛有适量的N2、H2混和气体,在一定条件下反应:N2+3H2 2NH3达到平衡时容器容积为VL,混合气体中NH3占体积20%,若压强、温度保持不变,下列推论不正确的是( )
A. 原N2、H2混合气体为100VL
B.参加反应的N2为0.1VL
C.原N2、H2混合气体为1.2VL
D.原混合气体中N2、H2体积比为1∶3
17.某化工厂工业废水中含H2SO4的质量分数为1%,采用边排放边中和的方法将它处理使之基本呈中性,处理方法如图所示。若处理后废水pH=7,则1%NaOH溶液的流量为( )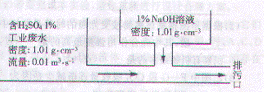
A.0.00816 m3·s-1 B. 0.01 m3·s-1
C.0.01632 m3·s-1 D.0.02 m3·s-1
18.质量分数不等的两种硫酸钠溶液等质量混合时,其质量分数为a %,而等体积混合后的质量分数为b %;质量分数不等的两种乙醇溶液等质量混合时,其质量分数为a %,,而等体积混合后的质量分数为c %。则a、b、c的大小关系正确的是( )
A.a>b>c B. b>a>c C. c>a>b D. c>a>b
第Ⅱ卷 (非选择题 共76分)
三. (本题包括2小题,共20分)
19.(9分)有失去标签的乙醇和乙醛两瓶液体,请根据下列提供的试剂用两种化学方法来鉴别它们。将选用试剂序号(a、b、c、d),实验条件(Ⅰ、Ⅱ)以及实验现象和化学方程式填入表格内。
选用试剂:
a. 质量分数为2%的AgNO3溶液和2%的氨水
b. 质量分数为10%的AgNO3溶液和10%的氨水
c. 质量分数为10%的NaOH溶液和2%的CuSO4溶液
d. 质量分数为2%的NaOH溶液和10%的CuSO4溶液
实验条件:
Ⅰ. 热水浴
Ⅱ. 加热至沸
| 选用试剂 | 实验现象 | 化学方程式 | |
| 1 | |||
| 2 |
20.(11分)用右图的实验装置可以进行钠与水的反应实验,并可收集、检验生成的气体。钠的密度为0.9 g·cm-3,煤油的密度为0.87 g·cm-3。请回答下列问题:
⑴液体物质添加完毕后,关闭活栓,打开右边胶塞,向煤油中加入一小块钠,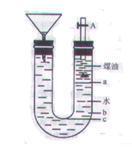 立即塞好胶塞。反应开始前钠的位置在 处(填a、b、c);
立即塞好胶塞。反应开始前钠的位置在 处(填a、b、c);
⑵反应后,钠在煤油层和水层界面之间上下跳动,反应平缓连续进行。试说明产生上述现象的原因 。 ⑶写出钠跟水反应的离子方程式 ;
⑷装置中的漏斗在反应过程中的主要作用是 ;⑸本实验除能使反应平缓连续进行、收集并检验气体外,还有一个优点是 。这是因为 。
四. (本题包括2小题,共26分)
21.(12分)碳的稳定氧化物除CO、CO2外,还有C3O2、C4O3 C12O9等低氧化物,其中C3O2是一种在常温下有恶臭的气体,其分子中的每个原子都满足最外层8电子结构。
⑴C3O2的电子式为 ,分子空间构型为 。⑵在上述碳的低氧化物中,若有分子构型与C3O2相同的,可能是 。⑶不考虑反应条件,根据你现有的化学知识判断,在O2、H2O、NH3、HCl中,哪些能与发生反应,请写出能够发生反应的化学方程式 。
22.(14分) 某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO![]() 、S2-、CO
、S2-、CO![]() 、SO
、SO![]() 、SO
、SO![]() ,现取该溶液进行有关实验,实验结果如下图所示:
,现取该溶液进行有关实验,实验结果如下图所示:
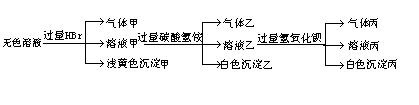
试回答下列问题:
(1) 沉淀甲是____________,
(2) 沉淀乙是__________,
(3) 由溶液甲生成沉淀乙的离子方程式为:_________________________。
(4) 气体甲成分可能有哪几种?(可以不填满也可以补充,多填要扣分)
| 1 | 2 | 3 | 4 | 5 | 6 |
(5)综合上述信息,可以肯定存在的离子:_____________________________。
五. (本题包括2小题,共14分)
23. (本题8分)
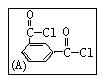
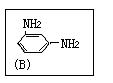
(1)用间苯二甲酰氯(A)与间苯二胺(B)经缩聚反应可制得HT纤维,写出HT纤维的结构简式:

(2)阿司匹林问世已有100多年,是驰名的治感冒、头痛、发烧、风湿和缓解、治疗其他疼痛的畅销药物。英国药学家约翰·文博士及其同事们由于发现其作用机理而获得1982年诺贝尔奖。现代医学证明,它在防治心脑血管疾病方面,特别是抑制手术后血栓、心肌梗塞和抑制血小板凝聚有效,成为医学界常用药物。
①写出用水杨酸 ( ![]() ) 与乙酸酐(
) 与乙酸酐(
![]() )合成
)合成
阿司匹林![]() 的化学方程式。
;
的化学方程式。
;
|
②已知A、B二种芳香族化合物均为阿司匹林的同分异构体,写出其结构简式。
A、水解后得到一种二元酸和一种醇 ;
B、水解后得到一种二元酚和两种酸 。
24.(8分)由磷酸形成的磷脂及其化合物(如酶)是细胞的重要组成部分,它们对调节生命活动起了积极作用。假如缺少了磷,氮就是再少也不会被植物吸收。磷酸吡醛素(结构式为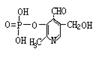 )能有效地促进植物对氮肥的吸收。 试回答:
)能有效地促进植物对氮肥的吸收。 试回答:
⑴磷酸吡醛素的分子式是 。
此物质具有的性质是(填序号) 。
A.能与金属钠反应 B能发生银镜反应
C.能与FeCl3溶液反应 D能使石蕊试液变红
⑵写出磷酸吡醛素与足量氢氧化钠溶液反应的化学方程式: 。
六. (本题包括2小题,共16分)
25. 将a g H2和b g Cl2充分混合后,点燃使其充分反应。然后将反应后的混合气用足量的氢氧化钠溶液吸收。
⑴写出可能发生的反应的化学方程式:。
⑵若H2和Cl2恰好充分反应,只生成HCl,则生成NaCl的物质的量为 ,或 。
⑶若H2过量,则剩余气体质量为 ,生成NaCl的物质的量为 。
⑷若Cl2过量,则生成NaCl的物质的量为 。
26. 3.2g Cu与过量硝酸(a mol·L-1,30mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol。
(2)求生成的气体中NO2和NO的物质的量(用含有a的式子表示)。
(3)用NaOH溶液吸收产生的气体,原理为:2NO2+2NaOH==NaNO3+NaNO2+H2O,
NO2+NO+2NaOH==2NaNO2+H2O。若生成的混合气体能被NaOH完全吸收,试讨论a的取值范围。
参考答案
1.B 2. B 3. 4.B 5.A 6. C 7. B 8. 9. B 10.A 11. AC 12.D 13. 14.BD 15. AC 16. AD 17. A 18.B
19.
20. ⑴a ⑵当钠跟水反映剧烈时,氢气将a托入煤油层,反应停止。随着氢气气流减少,钠沉到煤油层和水层的界面,反应又进行。⑶2Na+2H2O=2Na++2OH-+H2↑⑷防止水溢出⑸安全。此反应在隔绝空气下进行。
21.
22. (1)甲 S (2)乙![]() 、
、![]()
(3)丙![]() ,可能BaSO4
,可能BaSO4
(4)
| H2S | SO2 | CO2 | H2S、CO2 | SO2、CO2 |
(5)![]() 、
、![]() 、
、![]() 、
、![]()
23. ⑴
![]()
24.⑴C8H10O6NP ABD
⑵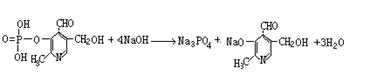
24.
25.⑴①H2+Cl2==2HCl;②HCl+NaOH==NaCl+H2O;③Cl2 +2NaOH==NaCl+ NaClO+H2O
(2)amol,(b/35.5)mol. (3)2(a/2 –b/71)g,(58.5b/35.5)g.⑷58.5(a/2 +b/71)g.
26. ⑴利用溶液中电荷守恒:n(NO3-)×1=n(Cu2+)×2+n(H+)×1,所以:n(NO3-)=0.2 (2分);(其他合理解法也给分)
(2)设生成气体中NO2、NO的物质的量分别为X、Y
由得失电子守恒: X+3Y=0.1mol
由“N”元素守恒: X+Y=(0.03a-0.2)mol
X=(0.045a-0.35) mol ; Y=(0.15-0.015a)mol 。(共2分,只要列1或2个式子就给1分)
(3)根据题给信息,完全吸收的条件是n(NO2)≥n(NO)时,才可能被完全吸收。
所以,首先是要保证产生NO、NO2,则列式为①②式:
X>0得:a> 7.8 ① (1分)
Y>0得:a<10 ② (1分)
再由必须完全吸收的条件列③式:
X≥Y得:a≥8.3 ③ (1分)
所以,三式联立解不等式组,得到a的取值范围为:8.3≤a<10 (1分)