化学平衡、电解质溶液测试题
温岭二中 吴建国
一、选择题(每小题有1-2个正确答案)
1、一般都能使反应速率加快的方法是( )
(1)升温 (2)改变生成物浓度 (3)增大反应物浓度 (4)减压
A、(1)(2)(3) B、(1)(3) C、(2)(3) D、(1)(2)(3)(4)
![]() 2、在一密闭烧瓶中注入NO2 ,在25℃时建立下列平衡2NO2 N2O4+Q,若把烧瓶置于100℃的沸水中,下列情况:(1)颜色 (2)平均摩尔质量 (3)质量 (4)压强 (5)Q (6)密度,其中不变的是( )
2、在一密闭烧瓶中注入NO2 ,在25℃时建立下列平衡2NO2 N2O4+Q,若把烧瓶置于100℃的沸水中,下列情况:(1)颜色 (2)平均摩尔质量 (3)质量 (4)压强 (5)Q (6)密度,其中不变的是( )
A、(3)(6) B、(3)(4)(5) C、(2)(4) D、(1)(3)
![]() 3、Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2+ +2H2O
Fe(OH)2+2H+,往该溶液中逐滴加入盐酸,发生的变化是( )
3、Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2+ +2H2O
Fe(OH)2+2H+,往该溶液中逐滴加入盐酸,发生的变化是( )
A、平衡向正方向移动 B、白色沉淀逐渐溶解
C、溶液颜色由浅绿色变为黄色 D、溶液颜色由浅绿变为深绿色
4、在空气中燃烧硫会有淡蓝色火焰和少量白烟,在氧气中燃烧硫有明亮的蓝紫色火焰,也有少量白烟,后者产生白烟的量(质量分数)比前者会( )
A、更多 B、更少 C、一样 D、无法判断
![]() 5、已建立化学平衡的可逆反应A+B C ,改变条件,使化学平衡向正反应方向移动,下列叙述正确的是( )
5、已建立化学平衡的可逆反应A+B C ,改变条件,使化学平衡向正反应方向移动,下列叙述正确的是( )
A、生成物的质量分数一定增大 B、生成物的产量增加
C、反应物的转化率都增大 D、反应物的质量分数都降低
6、在一定温度下将amol PCl5通入一个容积不变的反应器中,达到如下平衡:
![]() PCl5(g)
PCl3(g)+ Cl2(g),测得平衡后混合气的压强为P1,此时,再向反应器中通入amol PCl5,在不变的温度下再达到平衡,测得压强为P2,则P1和P2的关系是( )
PCl5(g)
PCl3(g)+ Cl2(g),测得平衡后混合气的压强为P1,此时,再向反应器中通入amol PCl5,在不变的温度下再达到平衡,测得压强为P2,则P1和P2的关系是( )
A、2P1>P2 B、2P1=P2 C、2P1<P2 D、P2>P1
![]() 7、下列叙述表示可逆反应N2+3H2
2NH3,一定处于化学平衡状态的是( )
7、下列叙述表示可逆反应N2+3H2
2NH3,一定处于化学平衡状态的是( )
A、N2、H2、NH3 的百分含量相等
B、单位时间内,消耗a mol N2的同时消耗3a mol H2
C、单位时间内,消耗a mol N2的同时生成3a mol H2
D、反应若在定容的密闭容器中进行,温度一定时,压强不随时间改变
![]() 8、已知一定温度时,有反应:2SO2(g)+O2(g)
2SO3(g)+197KJ,在相同温度下,向密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量Q1,向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时,放出热量Q2,则下列关系式正确的是( )
8、已知一定温度时,有反应:2SO2(g)+O2(g)
2SO3(g)+197KJ,在相同温度下,向密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量Q1,向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时,放出热量Q2,则下列关系式正确的是( )
A、Q2=Q1/2 B、Q2<Q1/2 C、Q2>Q1/2 D、Q1=Q2
9、亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是( )
A、0.1mol/L的亚硝酸溶液的pH值为2
B、100ml 1mol/L的亚硝酸恰好与100ml 1mol/L的 NaOH溶液完全反应
C、用HNO2溶液作导电实验,灯泡很暗
D、HNO2与NaCl不能发生反应
10、已知在100℃时水的离子积常数为10—12,在100℃下,将pH=3的硫酸溶液和pH=10
的NaOH溶液相混合,若要使混合后溶液的pH=7,那么硫酸溶液和氢氧化钠溶液的
体积比约为( )
A、1:10 B、10:1 C、999:101 D、9:1
11、在常温下某化合物的水溶液中,已知由水电离出来的C(H+)和C(OH— )分别为amol/L
和bmol/L且a·b=10—28,下列离子组在该溶液中一定能大量共存的是( )
A、Al3+、NH4+、SO42—、Cl— B、Na+、K+、SO42—、SO32—
C、K+、Fe2+、Cl—、MnO4— D、Ba2+、Na+、Cl—、NO3—
12、镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是氢氧化钾,放电时的电极
反应是:Cd+2OH—-2e=Cd(OH)2 ;2NiO(OH)+2H2O+2e=2Ni(OH)2+2OH—,下列说
法不正确的是( )
A、电池充电时,镉元素被还原 B、电池充电时,电池的正极和电源的正极连接
C、电池放电时,电池负极周围溶液的pH不断增大
D、电池的总反应是Cd+2NiO(OH)+2H2O=Cd(OH)2+2NiO(OH)2
![]() 13、已知在NaH2PO4溶液中存在着下列平衡体系:H2O H+ +OH—、H2PO4—+H2O
13、已知在NaH2PO4溶液中存在着下列平衡体系:H2O H+ +OH—、H2PO4—+H2O
![]()
![]()
![]() H3PO4+OH—、H2PO4— H+ +HPO42—、HPO42— H+ +PO43—……下列关系式正确的是( )
H3PO4+OH—、H2PO4— H+ +HPO42—、HPO42— H+ +PO43—……下列关系式正确的是( )
A、2[OH—] =[H+]
B、[H2PO4—] +[HPO42—]+[PO43— ]+[H3PO4] =[Na+]
C、[Na+] +[H+]=[OH— ]+[H2PO4—] +[HPO42—]+[PO43—]
D、[Na+] +[H+]=[H2PO4— ]+[OH—] +2[HPO42—]+3[PO43—]
14、25℃时CuSO4的溶解度是25g,如在该温度下将50gCuSO4放入100g水中,充分搅拌溶解后,所得溶液的质量是( )
A、125g B、115g C、105g D、84g
15、用石墨作电极电解3mol/L KCl和0.5mol/L Al2(SO4)3的混合溶液时,下列电解变化
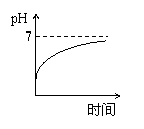
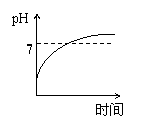

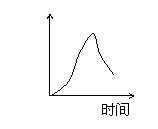

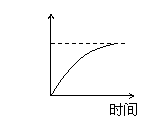 的曲线合理的是( )
的曲线合理的是( )
A、 B、 C、 D、
16、在盛有水的电解槽中加入等物质的量的Ag+、Pb2+、Na+、SO42—、NO3—、Cl— 摇匀后
用惰性电极进行电解,通电片刻后,氧化产物与还原产物的质量比为( )
A、8:1 B、16:207 C、35.5:108 D、435:648
二、填空题
17、电工操作中规定,不能把铜线和铝线拧在一起连接线路,这是因为 。
18、怎样用最简单的方法除去混在KNO3溶液中的少量Fe3+
![]()
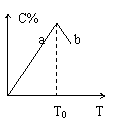 19、对于可逆反应2A+B 2C在反应过程中C的百分含量随温度变化如图则:
19、对于可逆反应2A+B 2C在反应过程中C的百分含量随温度变化如图则:
(1)T0对应的V(正)与V(逆)的关系是
(2)正反应为 热反应
(3)a、b两点正反应速率的大小关系是
(4)温度T<T0时,C%逐渐增大的原因是
![]() 20、在100℃和2×105Pa的条件下,反应aA(g) dD(g)+ eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变),下表列出了不同压强下反应建立平衡时物质D的浓度。
20、在100℃和2×105Pa的条件下,反应aA(g) dD(g)+ eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变),下表列出了不同压强下反应建立平衡时物质D的浓度。
| 压强/Pa | 2×105 | 5×105 | 1×106 |
| D的浓度/mol·L—1 | 0.085 | 0.20 | 0.44 |
根据表中数据,回答下列问题:
(1)压强从2×105Pa增加到5×105Pa时,平衡向 反应方向移动(填正,逆),
理由是 。
(2)压强从5×105Pa增加到1×106Pa时,平衡向 反应方向移动(填正,逆),
理由是 。平衡之所以向该方向移动,这是
由于 。
21、甲、乙两同学用一种标准盐酸去测定同一种未知浓度的NaOH溶液的浓度,但操作不同,甲把一定体积的NaOH溶液放入锥形瓶,把标准盐酸放入滴定管进行滴定,乙把一定体积的标准盐酸放入锥形瓶,把未知浓度NaOH溶液放入滴定管进行滴定。
(1)甲使用的是 滴定管,乙使用的是 滴定管。
(2)若甲同学使用的滴定管用蒸馏水洗净后未润洗,其余操作均正确,这样甲测定的结果
偏 。
(3)若乙同学在滴定至终点时,仰视滴定管读数,其余操作均正确,这样乙测定的结果偏
。
22、将氯化铵固体放入盛有少量氢氧化镁浊液的试管中进行振荡,发生的现象是 ,其原因(用离子方程式表示)为 。
 |
23、用下图所示装置进行Fe(OH)3胶体的电泳实验,问:
(1)我们可观察到的现象是 。
(2)能否将此装置理解为一个电解池
如能则写出电极反应式 。
如不能,请写出理由 。
(3)如果将两石墨电极直接插入Fe(OH)3胶体中进行
电泳实验,会有什么现象 为什么 。
(4)能否用5mol/L的KCl溶液代替上图中0.01mol/L
的KCl溶液,为什么 。
三.计算题
![]() 24.已知可逆反应 CO(g) + H2O(g) CO2(g) + H2(g) 达到平衡时生成物浓度的乘积除以反应物浓度的乘积是常数,称平衡常数(K), 且知:K只与温度有关,与浓度无关。
24.已知可逆反应 CO(g) + H2O(g) CO2(g) + H2(g) 达到平衡时生成物浓度的乘积除以反应物浓度的乘积是常数,称平衡常数(K), 且知:K只与温度有关,与浓度无关。
(1) 600℃时若起始浓度C(CO)为2mol/L C(H2O) 为3mol/L ,平衡时CO 的转化率为60% ,求水蒸气的转化率α(H2O)和平衡常数K的值。
(2) 600℃时,若将H2O 的起始浓度增加到6mol/L ,则α(H20)为 ,
α(CO)为 ,若将H2O的起始浓减小到1mol/L,则平衡时α(H20)为 ,α(CO)为 。
(3) 综合计算(1)(2)结果得出结论:一定条件达到平衡的可逆反应,若增加一种反应物的浓度,则本身的转化率(填升高,降低下同) ,而另一种反应物的转化率
;若减小一种反应物的浓度,则本身的转化率 ,而另一种反应物的转化率
。
25.在20℃时食盐的溶解度为36g ,取一定量该温度下的饱和食盐水用惰性电极进行电解,当阳极析出气体11.2 L(标况)时,食盐完全电解,所得溶液密度为1.2g/ml 试计算:
(1) 电解时所取饱和食盐水的质量
(2) 电解后溶液的物质的量浓度
(3) 要使溶液恢复原状态,需要加入多克什么物质。
化学平衡、电解质溶液测试题答案
一.选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| B | A | C | B | B | AD | CD | B | A | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | C | BD | C | AD | A |
二.填空题
17.容易形成铜-铝原电池,而加快铝的腐蚀
18.加热促使Fe3+的水解,使之形成沉淀后过滤除去
19.(1)V(正)=V(逆) (2)放热 (3)Va<Vb
(4) 反应未达到平衡 V(正)![]() >V(逆)
>V(逆)
20.(1)逆; 如果平衡不移动,当压强由2×105Pa增加到5×105Pa时,D的浓度应为
0.21mol/L 现为0.20 mol/L,故平衡朝逆方向移动
(2)正;如果平衡不移动,当压强由5×105Pa增加到1×106Pa时,D的浓度应为
0.40mol/L 现为0.44 mol/L,故平衡朝正方向移动; 可能由于压强增加,D、
E两物质至少有一物质已变为液态或固态
21.(1)酸式; 碱式 (2)大 (3) 小
![]() 22.沉淀逐渐溶解; Mg(OH)2(固) Mg2+
+ 2OH- NH4Cl = NH4+ + Cl-
22.沉淀逐渐溶解; Mg(OH)2(固) Mg2+
+ 2OH- NH4Cl = NH4+ + Cl-
![]() NH4+ + OH- NH3iH2O
NH4+ + OH- NH3iH2O
23.(1)左边电极上有黄绿色气体产生,右边电极上有无色气体产生,右边电极附近
U形管内胶体颜色加深
(2)阳极:2Cl--2e = Cl2 ↑ 阴极:2H+ + 2e = H2 ↑
(3)阴阳两极均有气体产生,并且在阴极附近胶体发生凝聚; Fe(OH)3胶粒带正电,吸附电子后,变为电中性胶粒,相互吸附而沉淀
(4)不能; 5mol/L KCl溶液密度太大,不能浮在Fe(OH)3胶体上面
24.(1)40% ;1 (2)25%;75%; 66.7%;33.3%
(3)降低 升高;升高 降低
25.(1)221g (2)6.5mol/L (3)36.5g HCl