化学学科高考模拟试卷
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分150分。考试时间120分钟。
第Ⅰ卷 (选择题 共72分)
可能用到的原子量:H –1 C –12 N –14 O –16 Na –23 S –32
Cl –35.5 Fe –56
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.下列关于某些社会热点问题的说法中,不正确的是( )
A.光化学烟雾的产生与人为排放碳氢化合物、氮氧化物有关
B.臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关
C.甲醛是某些劣质装饰板材释放的常见污染物之一
D.禁止使用含铅汽油是为了提高汽油的燃烧效率
2.下列过程中,只包含物理过程的是( )
A、 蛋白质溶液中加入饱和(NH4)2SO4溶液
B、 石灰粉刷的墙壁日久变硬
C、 自来水生产时的“沉降”过程
D、用“氧立得”制取氧气
3.化学研究中,只有了解物质的结构,才能深刻地认识它们的性质和变化规律。下列关于物质结构的说法正确的是( )
A、失电子难的原子获得电子的能力不一定强
B、冰是由氢原子和氧原子直接构成的
C、原子及其离子的核外电子层数等于该元素所在的周期数
 D、M层电子为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等
D、M层电子为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等
4.右图是制取、干燥和收集某气体的实验装置,可用于( )
A、用Zn与稀H2SO4反应制H2
B、用CaO与浓氨水反应制NH3
C、用Cu与稀HNO3反应制NO
D、用MnO2与浓HCl反应制C12
5.下列说法或表示法正确的是( )
A、若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B、由“C(石墨)—→C(金刚石);△H= +119 kJ/mol ”可知,金刚石比石墨稳定
C、在稀溶液中: H++OH-=H2O;△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
D、在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +285.8kJ/mol
6.一定温度下,向质量分数为a的乙腈(CH3CN)溶液中加入等体积的水,所得溶液中乙腈的质量分数为0.4a,,若乙腈的密度为![]() ,水的密度为
,水的密度为![]() ,则下列说法正确的是( )
,则下列说法正确的是( )
A、 ![]() >
>![]() B、
B、![]() <
<![]() C、
C、![]() =
=![]() D、无法确定
D、无法确定
7.将NaHCO3和部分风化的纯碱晶体组成的混合物样品mg配成250mL溶液,取25mL上述溶液,用1.0mol/L盐酸滴定,至终点时,用去盐酸30.0mL。若将上述样品mg加热至质量不变时, 可得到固体的质量为( )
A、10.6g B、12.6g C、15.9g D、数据不足,无法确定
8.20℃时,将某盐R的溶液蒸发掉10g水,恢复到20℃,需在剩余溶液中加入6gR(无水),溶液即达饱和;若将原盐溶液蒸发掉30g水,则只需加入1gR(无水)就可以在20℃达到饱和,20℃时R的溶解度为( )
A、20g B、25g C、30g D、35g
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.下列分子中所有原子都满足最外层8电子结构的是( )
A、次氯酸(HClO) B、白磷(P4)
C、三氟化硼(BF3) D、三氯化磷(PCl3)
10.下列除去括号内的杂质的有关操作,正确的是( )
A、乙酸乙酯(乙酸):加氢氧化钠溶液,分液
B、I2(NH4Cl) :加热,然后收集冷凝的I2
C、苯(苯酚) :加浓溴水,振荡,分液
D、肥皂液(甘油):加食盐盐析,过滤
11.在水溶液中能大量共存,且加入过量稀硫酸溶液时,既产生沉淀又有气体物质生成的离子组是( )
A、Na+,K+,S2O32—,Cl— B、K+,NH4+,AlO2—,Cl—
C、Ca2+,Mg2+,NO3—,Cl— D、Na+,K+,AlO2—,CO32—
12.按反应物与产物的结构关系,有机反应大致可分为:取代反应、消去反应、加成反应三种类型,下列反应中属于加成反应的是( )
A、 C6H5CH2Cl + NaCN —→ C6H5CH2CN + NaCl
B、 C6H5Li + CO2 —→ C6H5COOLi
C、 CH3CH2CHO + HCN —→ CH3CH2CH(CN)OH
D、CH3COOH +C2H5OH —→ CH3COO C2H5 + H2O
13.下列离子方程式书写正确的是: ( )
A、硫酸亚铁酸性溶液中加入双氧水 2Fe2++H2O2+2H+==2Fe3++2H2O
B、硫酸铝溶液跟偏铝酸钠溶液反应Al3++3AlO2-+6H2O=4Al(OH)3↓
C、碳酸钡中加入稀硫酸 BaCO3+2H+==Ba2++CO2↑+2H2O
D、向漂白粉溶液中通入二氧化硫气体Ca2++2ClO—+SO2+H2O==CaSO3↓+2HClO
14.设NA表示阿伏加德罗常数,下列说法正确的是( )
A、常温常压下,32g氧气和臭氧的混合气体所含原子数为2NA
B、1mol氯气参加氧化还原反应,转移的电子数目一定是2NA
C、1L1mol/LNa2S溶液中含有的S2—的个数为NA
D、标准状况下,22.4LSO3所含的分子数为NA
15.某温度下,在固定容积的密闭容器中,可逆反应A(g)+ B(g)![]() 3C(g)达到平衡时,各物质的物质的量之比n(A):
n(B): n(C)=2 : 2 : 1。保持温度不变,以2 : 2 : 1的物质的量之比向平衡系统中再充入A、B、C,则下列说法正确的是 ( )
3C(g)达到平衡时,各物质的物质的量之比n(A):
n(B): n(C)=2 : 2 : 1。保持温度不变,以2 : 2 : 1的物质的量之比向平衡系统中再充入A、B、C,则下列说法正确的是 ( )
A、 平衡不移动
B、 再达平衡时,n(A): n(B): n(C)仍为2 : 2 : 1
C、 再达平衡时,C的体积分数增大
D、 达平衡时,正反应速率比原平衡大
 16.银锌电池广泛用于各种电子仪器,电池反应为:
16.银锌电池广泛用于各种电子仪器,电池反应为:
2Ag+Zn(OH)2 Ag2O +Zn+H2O
下列说法正确的是( )
A.放电时,若外电路中有0.02mol电子通过,则消耗负极材料2.16g
B.充电时阳极发生的电极反应是:2Ag +2OH— —2e— = Ag2O + H2O
C.该电池可用酸作电解质溶液
D.充电时电流从Zn电极经电解质溶液流向外接电源的正极
17.有五支编号的试管里分别装有K2CO3、 KNO3、 K2SO4 、KOH 和Ba(OH)2溶液,现需用最少种类的试剂将它们一一区别开来,则所需试剂的种类是( )
A、不用任何试剂 B、用一种试剂 C、用两种试剂 D、用三种试剂
18.工业上用氨和二氧化碳反应合成尿素:2NH3 +CO2 = CO(NH2)2 +H2O,已知下列物质在一定条件下均能与水反应产生H2和CO(CO能与水蒸汽继续反应生成CO2),H2是合成氨的原料,CO2供合成尿素用。若从充分利用原料的角度考虑,最好选用 ( )
A、石脑油(C5H12、C6H14) B、CH4
C、CO D、碳
第Ⅱ卷(非选择题,共78分)
三、(本题包括2小题,共22分)
19.(9分)在实验室利用胆矾晶体和烧碱溶液制备氧化铜固体,其实验操作可分解为如下几步:①混合 ②过滤 ③加热分解 ④溶解 ⑤洗涤。就此实验完成下列填空:
⑴正确操作步骤的顺序是(填序号) ;
⑵步骤②中所用到的玻璃仪器有 ;
⑶在实验中多次用到玻璃棒,其作用有三个,分别是 、 、 。
20.(13分)
工业产品碳酸钠中,常混有氯化钠,测定碳酸钠质量分数的仪器装置图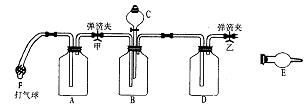 如下:
如下:
供选用的试剂有:NaOH溶液、饱和石灰水、蒸馏水、浓硫酸、稀硫酸、浓盐酸、稀盐酸、硝酸、碱石灰、无水氯化钙、无水硫酸铜、试样(含有少量氯化钠的碳酸钠)
请回答:⑴各有关仪器中使用的药品是:
A. B. C. D. E.
⑵实验步骤(到得到实验数据为止):
①称量:称试样质量及装有干燥剂的球形干燥管的质量,并记录数据;
②如图连接除E外的装置;
③ ;
④有关仪器中装上药品待用;
⑤ ;
⑥关闭甲弹簧夹, ;
⑦ ;
⑧称量干燥管质量并记录数据。
四、(本题包括2小题,共18分)
21.(8分)⑴取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液中由水电离出的c(OH¯) 0.2mol/LHX溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②写出下列算式的精确计算结果(填具体数字):
c(Na+)— c(X¯)= mol/L;c(OH¯)— c(HX)= mol/L。
⑵如果取0.2mol/LHX溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液的pH>7,则说明HX的电离程度 NaX的水解程度。(填“>”、“<”、或“=”)
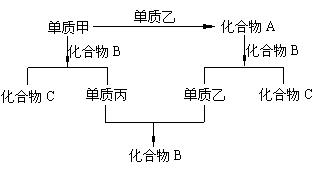
22.(10分)A、B、C是由周期表中的短周期元素组成的三种化合物,A、B均由两种元素组成,甲、乙、丙是三种单质,这些单质和化合物之间存在如下关系:
 |
请填写下列空白:
⑴已知甲是金属单质,其化学式为 ;
⑵化合物B的结构式 , 化合物A的电子式 ,化合物C的化学式 ;
⑶化合物A与化合物B反应的方程式(若为离子反应书写离子方程式)
。
五、(本题包括2小题,共18分)
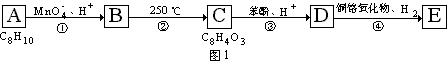
23.(8分)有机物A的化学式为C6H8O4Cl2,与有机物B、C、D、E的变化关系如下图:
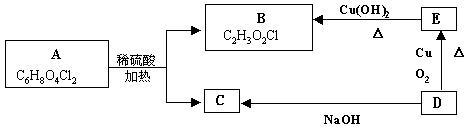
1molA经水解生成2molB和1molC,根据上述变化关系填空:
(1)写出物质的结构简式:A 、 B 、 C 、
D 、 E 。
(2)写出E转变为B的化学方程式: 。
24.(10分)①烷基苯在高锰酸钾的作用下,侧链被氧化成羧基,例如
![]()
②酯类在铜铬氧化物(CuO••CuCrO4)催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在催化氢解过程中不变,其反应原理如下:
RCOOR′+ 2H2
![]() RCH2OH
+ HOR′
RCH2OH
+ HOR′
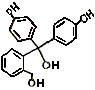
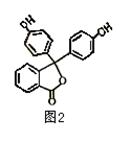 化合物A—E的转化关系如图1所示,已知:A是芳香化合物,只能生成3种一溴化合物,B有酸性,C是有机合成的重要中间体和常用化学试剂(C也可由其他原料催化氧化得到),D是一种常用的指示剂酚酞,结构如图2。
化合物A—E的转化关系如图1所示,已知:A是芳香化合物,只能生成3种一溴化合物,B有酸性,C是有机合成的重要中间体和常用化学试剂(C也可由其他原料催化氧化得到),D是一种常用的指示剂酚酞,结构如图2。
⑴D分子中的三个苯环 共平面(选填“能”或“不能”)。
⑵写出A、B、E的结构简式:
A. 、 B. 、 E. 。
⑶C与足量氢氧化钠溶液充分反应的化学方程式为 。
六、(本题包括2小题,共20分)
25.(10分)CO和CO2都可以合成甲醇:CO + 2H2 —→ CH3OH ①
CO2 +3H2 —→ CH3OH +H2O ② CO、CO2和H2可通过下列反应制备:
Ⅰ.CH4 + H2O(g)—→ CO + 3H2 Ⅱ. CO + H2O(g)—→ CO2 + H2
反应Ⅰ的产物合成甲醇时H2过量,反应Ⅱ的产物合成甲醇时H2不足。为了充分利用原料可将两个反应的产物混合使用。
(1)反应I和反应Ⅱ的产物气体混合的最佳比例(用同温同压下气体体积比表示)
(2)若反应Ⅱ的CO由反应I提供,试通过计算说明,两个反应的产物气体无论怎样混合,都达不到最佳比例的要求。
26.(10分)氯气和二氧化氮气体在室温下可以化合生成一种新的气态化合物A,为了测定A的组成进行以下实验,取Cl2、NO2混合气总体积5L,测定反应后所得气体体积随Cl2在原混合气体中所占体积分数x的变化而变化的规律。实验测知当Cl2所占体积分数为0.2或0.6 时,反应后的总体积均为4L。
(1)通过分析和计算求得化合物A的化学式为________,发生反应的化学方程式为________________
(2)试讨论当x(0<x<1) 的取值范围不同时,反应后总体积V随x变化的函数关系。将结果填入下表:
| x值 | V(反应后混合气体体积) |
参考答案
一、(本题包括8小题,每小题4分,共32分)
1、D 2、A 3、A 4、A 5、C 6、B 7、C 8、B
二、(本题包括10小题,每小题4分,共40分)
9、BD 10、D 11、A 12、BC 13、AB 14、A 15、D 16、B 17、B 18、A
三、(本题包括2小题,共22分)
19. ⑴ ④、①、③、②、⑤ (3分) ⑵ 玻璃棒、漏斗、烧杯 (3分)
⑶ 搅拌、引流、转移(3分)
20. ⑴ A. 饱和石灰水或NaOH溶液 B.试样 C.稀H2SO4(若答盐酸,不给分) D.浓H2SO4 E. 碱石灰(过量) (每空1分)
⑵ ③在接球形干燥管前,先检查装置的气密性 ⑤打开甲、乙弹簧夹,用气球鼓气,以赶尽装置中的CO2,然后接上已称量过装有吸收剂的球形干燥管 ⑥将分液漏斗中的稀H2SO4加到装有试样的平底烧瓶上 ⑦反应完全后,打开弹簧夹甲,用气球鼓气,直至装置中的CO2全部赶出为止 (每空2分)
四、(本题包括2小题,共18分)
21. ⑴ ① > ② 9.9×10−7 1.0×10−8 ⑵ < (每空2分)
![]()
22. ⑴ Na (1分) ⑵H−O−H NaOH (6分)
⑶ 2Na2O2 + 2H2O = 4Na+ + 4OH¯+O2↑(3分)。
五、(本题包括2小题,共18分)
23.⑴A.ClCH2COOCH2CH2OOCCH2Cl B.ClCH2COOH
C.HOCH2CH2OH D.ClCH2CH2OH E.ClCH2CHO (各1分)
⑵ ClCH2CHO
+ 2Cu(OH)2![]() Cu2O↓+ ClCH2COOH + 2H2O (3分)
Cu2O↓+ ClCH2COOH + 2H2O (3分)
24.(1)不能 (2)![]()
![]()
(3) (每空2分)
(每空2分)
六、(本题包括2小题,共20分)
25.(1)设反应Ⅱ的产物气体的物质的量共x,反应Ⅰ的产物气体的物质的量共y,则
Ⅱ.CO + H2O(g)—→ CO2 + H2
![]()
![]()
I.![]() +
+![]() (g)—→CO+3
(g)—→CO+3![]()
![]()
![]() (2分)
(2分)
产物中氢气总共为![]() +
+![]() ,二氧化碳为
,二氧化碳为![]() ,一氧化碳为
,一氧化碳为![]()
由反应CO+![]() —→
—→![]()
1 2
![]()
![]()
![]() +
+![]() —→
—→![]() +
+![]()
1 3
![]()
![]() (2分)
(2分)
最佳比例应为氢气相等:![]() +
+![]() =
=![]() +
+![]() x=
x=![]()
Ⅰ与Ⅱ的产物最佳比例为y∶x=4∶1(2分)
(2)若反应Ⅱ的CO由Ⅰ提供,
题设(1)产物中氢气总共为![]() +
+![]() ,二氧化碳为
,二氧化碳为![]() ,一氧化碳为
,一氧化碳为![]()
由Ⅱ.CO+![]() (g)—→
(g)—→![]() +
+![]() (2分)
(2分)
1 1 1
![]()
![]()
![]()
![]()
![]() (2分)
(2分)
y∶x=2∶1达不到最佳比例。
(计算题其它合理解答均可得分)
26. (1)NClO2
(元素符号顺序可颠倒) (2分)
Cl2+2NO2![]() 2NClO2 (2分)
2NClO2 (2分)
(2)
| x值 | V(反应后混合气体体积) |
| x < | V=5(1-x) |
| x = | V=5(1-x) |
| x > | V=2.5(x+1) |
(每空1分)
试 题 分 析 表
| 题号 | 难度 | 命 题 意 图 | 学生的典型错误 |
| 1 | 0.90 | 考查学生对环境污染知识和化学常识的了解, | 少数同学错选B |
| 2 | 0.65 | 考查学生从本质上来判断物理变化和化学变化的能力 | 不知道蛋白质的盐析是物理变化 |
| 3 | 0.90 | 主要考查对原子结构、原子核外电子以及元素周期表的认识和理解运用 | 极少数同学未能克服思维定势 |
| 4 | 0.85 | 考查学生识图的观察、分析能力,以及运用实验操作和知识解决具体问题的能力 | 误选C或D,未能全面准确接受题图所给的信息 |
| 5 | 0.70 | 考查学生对热化学方程式意义的理解,热化学方程式的书写以及中和热的概念 | 主要错选B,将硬度等物理性质和物质的稳定性混为一谈 |
| 6 | 0.65 | 考查学生对溶液等体积混合与等质量混合时浓度的比较计算和理解 | 溶质的质量分数与物质的量浓度的关系不熟悉 |
| 7 | 0.75 | 主要考查元素化合物的基本计算中守恒法的应用 | 少数同学不能综合运用电荷守恒和质量守恒而瞎猜 |
| 8 | 0.80 | 主要考查学生对溶解度的概念和溶液组成的理解 | 少数学生对溶质、溶剂之间的量的关系认识不清晰,不能建立等式关系列式求解 |
| 9 | 0.65 | 考查学生对成键原子最外层8电子结构的辨证认识和思维能力 | 部分同学漏选B或误选C |
| 10 | 0.70 | 考查学生对除杂问题的了解,包括原理和操作 | 误选A或C |
| 题号 | 难度 | 命 题 意 图 | 学生的典型错误 |
| 11 | 0.75 | 主要考查离子共存问题,以复分解反应为主 | 主要是误选D,原因是未考虑稀硫酸过量使氢氧化铝溶解 |
| 12 | 0.55 | 考查学生对有机反应类型的本质的理解 | 未能抓住CO2中存在双键这一特征而漏选B |
| 13 | 0.65 | 考查学生对离子方程式的理解以及书写的正误判断 | 主要错误是忘记配合反应而漏选B,未能抓住亚硫酸盐具有还原性、次氯酸具有氧化性发生氧化还原反应而错选D |
| 14 | 0.50 | 主要考查阿伏加德罗常数的概念,以及氧化还原电子转移情况和盐离子的水解等知识 | 各种错误都有,其中错选C的学生较多,原因是未考虑盐离子的水解 |
| 15 | 0.75 | 考查学生对平衡移动原理的本质的理解 | 对勒夏特列原理理解不清,不能掌握其本质 |
| 16 | 0.65 | 以可充电电池为载体,考查学生对电化学知识的理解情况 | 主要是误选A或D |
| 17 | 0.55 | 通过物质的鉴别,考查学生对元素及其化合物的理解掌握情况 | 对部分化合物的性质掌握不透彻,不熟悉“用一种试剂鉴别一组物质”的实验的思维思路 |
| 18 | 0.45 | 主要考查学生根据化学方程式进行定量和半定量计算的能力 | 部分同学未能从元素守恒的角度去分析讨论计算 |
| 19 | 0.65 | 主要考查制备实验方案的设计原则和化学实验的基本操作 | 错误原因是学生对该实验过程不熟悉,凭感觉答题 |
| 20 | 0.45 | 综合考查学生实验设计的能力,同时考查学生根据实验装置图理清实验原理,叙述实验步骤的能力 | 部分学生语言表达能力较差,有些学生实验操作顺序有误,少数学生出现实验原理理不清的现象 |