高三化学复习镁、铝
教学内容
1.掌握镁、铝的重要物理性质和化学性质及重要用途
2.掌握Mg、Al重要化合物的性质及相互转化
二、学习指导
(一)Mg、Al性质的相似性和差异性
Mg和Al属于同周期相邻的两种金属元素,是第ⅡA、ⅢA族析重要代表元素。它们具有强的还原性,但Al正处在周期表中金属与非金属分界线旁,因而Al具有特殊性质。
关于Mg、Al的物理学性质差异可从金属键的强弱分析入手。镁铝合金的特点是质轻而更度和强度都较大,且Mg、Al在常温下即可被空气中O2氧化,生成致密氧化物保护膜,具有一定的抗腐蚀性,因而它们具有广泛的用途。
比较镁和铝
| 物 理 性 质 | 光泽 密度 | Mg | Al |
| 银白色 轻金属 | |||
| 原子或离半径 金属键能 溶、沸点 硬度 | > < < < | ||
| 化 学 性 质 | 露置于空气 |
| 常温很快被氧化形成致密保护膜,抗蚀性能强于镁 |
| 燃烧 (与O2反应条件及现象) | 2Mg+O2 2MgO
| 4Al+3O2=2Al2O3
| |
| 与氧化物反应 (置换) |
| 2Al+Fe2O3 Al2O3+2Fe +Q
| |
| 与其它非金属反应 |
| 2Al+3S Al2S3
| |
| 与H2O反应 | Mg+2H2O(沸) Mg(OH)2+ H2↑ | 2Al+6H2O(沸) 2Al(OH)3 +3H2↑ | |
| 与非氧化性酸反应 | Mg+2H+=Mg2++H2↑ | 2Al+6H+=2Al3++3H2↑ | |
| 与强氧化性酸反应 | 能反应,无H2放出 | 常温 被浓H2SO4、浓HNO3钝化 | |
| 与强碱液反应 | 不反应 | 2Al+2NaOH+2H2O=2NaAlO3 +3H2↑ | |
| 存 在 |
|
Al2O3 Al | |
| 冶 炼 |
MgCl2 Mg | 制合金、飞机、汽车、轮船部件、导线、日用品 | |
| 用 途 | 制合金、飞机、汽车部件、烟火、照明弹等 | ||
注意:
 1.镁在空气中燃烧所得产物质种类
1.镁在空气中燃烧所得产物质种类
![]() MgO
MgO
Mg Mg3N2
MgO+e
想一想:为什么镁在空气中燃烧产生主要为MgO?
2.比较Mg分别在O2、N2、CO2中燃烧所得产物质量的大小
(1)等物质的量的Mg分别在足量的气体中燃烧
①
![]() Mg ~
Mg ~ ![]() O2 ~ MgO
O2 ~ MgO
1mol 40g
②Mg ~![]() N2 ~
N2 ~ ![]() Mg3N2
产物质量大小顺序:
Mg3N2
产物质量大小顺序:
1mol
![]() g
③>①>②
g
③>①>②
③Mg~![]() CO2 ~ MgO+
CO2 ~ MgO+![]() C
C
1mol 46g
(2)等物质的量的气体与足量Mg反应
![]() ①O2 ~ 2MgO
①O2 ~ 2MgO
1mol 80g 产物质量大小顺序
②N2 ~ Mg3N2 ②>③>①
1mol 100g
③CO2 ~ 2MgO+C
3.Al与NaOH溶液反应的电子转移情况。
常见的错误有:
![]()
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
其实该反应的氧化剂只有水。为什么?
从Al与NaOH溶液反应本质分析:
2Al+6H2O == 2Al(OH)3+3H2↑ ……①
2Al(OH)3+2NaOH==2NaAlO2+4H2O ……②
![]() ①+②得
①+②得
2Al+2NaOH+6H2O==2NaAlO2+3H2↑+4H2O
其中NaOH所起的作用:
上述反应①通常条件是微弱的,但NaOH溶液能溶解Al(OH)3促使反应①程度增大。故NaOH仅表现碱性。
4.铝热反应
 |
(1)定义:Al+MxOy M+Al2O3 + 放出大量热
铝热剂 引发反应发生 特点
使高熔点金属熔化
(2)原因: ①Al的强还原性
②Al的亲氧性强
(3)应用: ①冶炼高熔点金属(如Fe、Cr、V、Mn等)
②焊接金属。
(二)铝、硅的相似性
铝、硅虽然不属于同主族,但因们于阶梯玫的两侧,故Al和Si及其人经合物的化学性质有许多相似之外,被称为“孪生兄妹”
现对其单质、氧化物及其水化物比较如下:
| 单质 |
|
|
| 与O2反应 |
|
|
| 与Cl2反应 |
|
|
| 与氧化物反应 | 2Al+Fe2O3 Al2O3+2Fe | Si+2FeO 2Fe+SiO2 |
| 与酸反应 | 2Al+6HF=2AlF3+3H2↑ | Si+4HF=SiF4+H2↑ |
| 与碱液反应 | 2Al+2H2+2NaOH=2NaAlO2+3H2↑ | Si+2H2O+2NaOH=Na2SiO3+2H2↑ |
| 氧化物 | Al2O3 | SiO2 |
| 与碱液反应 | Al2O3+2OH—=2AlO2—+H2O | SiO2+2OH—=SiO32—+H2O |
| 与酸液反应 |
|
|
| 与碱性氧化物反应 | Al2O3+CaO Ca(AlO2)2 | SiO2+CaO CaSiO3 |
| 氧化物对应水化物 |
|
|
| 受热分解 | 2Al(OH)3 Al2O3+3H2O | H2SiO3 SiO2+H2O |
| 与酸反应 | Al(OH)3+3H+=Al3++3H2O | 不反应 |
| 与碱反应 | Al(OH)3+OH—=AlO2—+2H2O | H2SiO3+2OH—=SiO32—+2H2O |
| 含氧酸盐 | NaAlO2 | Na2SiO3 |
| 与强酸反应 | AlO2—+H++H2O==Al(OH)3↓ | SiO32—+2H+=H2SiO3↓ |
| 与弱酸反应 | AlO2—+CO2+2H2O==Al(OH)33↓+HCO3— 2AlO2—+CO2+3H2O=2Al(OH)33↓+CO32— | SiO32—+2CO2+H2O=H2SiO3+2HCO3— SIo32—+CO2+2H2O=H2SiO3+CO32— |
| 水解呈碱性 |
|
|
| 双水解反应 | AlO2—+NH4++H2O==Al(OH)3↓+NH3↑ | SiO32—+2NH4+=H2SiO3↓+2NH3↑ |
(三)Mg、Al及其化合物间的转化
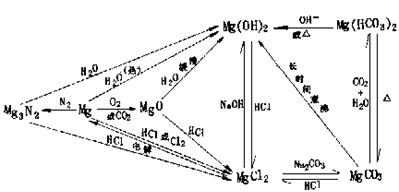 1.Mg元素
1.Mg元素
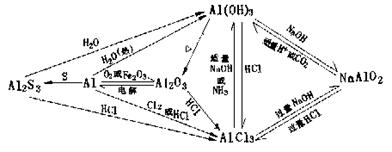 |
2.Al元素
注意
(1)Al(OH)3为何既能与酸又能与强碱液反应?
这是因为Al(OH)3在水中同时存在两种电充平衡:
AlO2—+H++H2O Al(OH)3 Al3++3OH—
 ①酸式电离
②碱式电离
①酸式电离
②碱式电离
促进② 促进①
抑制① 只能存在于中 抑制②
[H+]↗ 性或弱酸性或 [OH—]↗
弱碱性环境中
(2)注意AlO2—、Al(OH)3、Al3+转化条件及所需量的关系,即铝室双三角关系
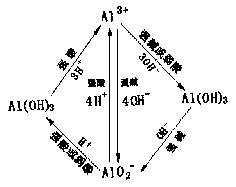 |
规律:左右物质的量相对称,对应边强弱相呼应
(四)制取Al(OH)3的可能途径及最佳选择
(1)铝盐与碱液反应
①Al3+ Al(OH)3 AlO2—
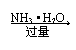
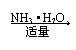
②Al3+ Al(OH)3 不溶解
(2)偏铝酸盐与酸反应:
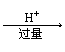
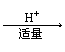
①AlO2— Al(OH)3 Al3+
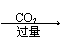
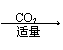
②AlO2— Al(OH)3 不溶解
(3)双水解反应:
①Al3++3AlO2—+6H2O=4Al(OH)3↓
当nAl3+:nAlO2—+1 :3时,不用其它试剂即可将Al元素全部转成Al(OH)3沉淀。
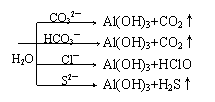
②Al3+
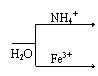 |
Al(OH)3+NH3↑
③AlO2—
Al(OH)3+Fe(OH)3(两种沉淀)
思考:如何将a mol AlCl3和b mol NaAlO2 溶液中的Al元素全部合理地转化成Al(OH)2?(提示:注意试剂用量)
(五)典型的图像分析及应用
以Al元素为核心的图像丰富多彩。析图或作图时不仅要注意加入酸或碱的强弱,而且要注意所加入的量或滴加顺序,正因滴加顺序不同可转产生的现象不同,故可用相互滴加法来临别试剂如
![]() AlCl3 NaAlO2
AlCl3 NaAlO2
NaOH HCl
若产生沉淀有多种,则应细细分析相关量间的关系。要持别关注沉淀是否同步完全,沉淀物是否溶于所加入的过量试剂中。同时要注意纵生标的物理量意义。对于一些复杂问题可先分解后组合,进行图像的叠加工作。抓住杂些关键点(如最高点,最低点,转折点)和变化趋势,才能较顺利地解决图像问题。
现将基本或重要的有关图像归纳如下:
(1)含1molAlCl3的溶液中滴加NaOH (2)含1molAlCl3的溶液中通入NH3
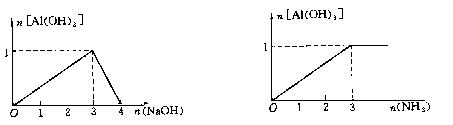 |
(3)含1molNaOH的溶液中滴加AlCl3 (4)含1molNH3的氨水滴加AlCl3
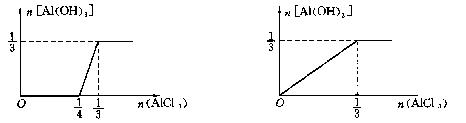 |
(5)含1molNaAlO2的溶液中滴加HCl (6)含1molNaAlO3的溶液中通入CO2
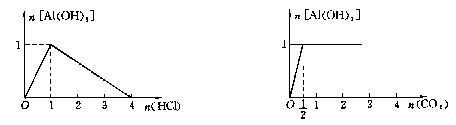 | |||
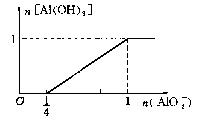 | |||
(7)1molHCl溶液中滴加NaAlO2
(8)含各1molMg2+、Al3+混合液中滴加NaOH溶液
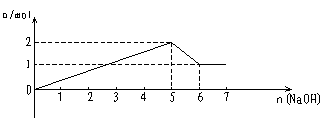 |
(9)含各1molMg2+、Al3+、NH4+混合液中滴加NaOH溶液
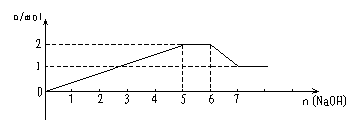 |
(10)含1molKAl(SO4)2的溶液中滴加Ba(OH)2溶液:
![]() A13+ ~
A13+ ~ ![]() Ba(OH)2
~Al(OH)3
Ba(OH)2
~Al(OH)3
SO42— ~ Ba(OH)2 ~ BaSO4 Al(OH)3、BaSO4求能同步沉淀完全
![]() mol
mol ![]() mol
mol ![]() mol
mol
①当加入![]() molBa(OH)2时
molBa(OH)2时
生成沉淀 1.0mol 78g
BaSO4 1.5mol 349.5g
总 2.5mol 427.5g
②当加入Ba(OH)2 2mol时
![]() Al(OH)3已完全溶解
Al(OH)3已完全溶解
BaSO4 2mol 总质量466g
图像如下:
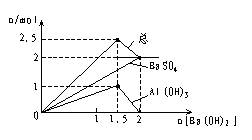 | 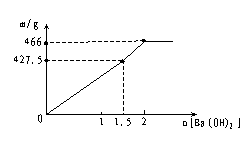 | ||
三、典型例析:
例1. 7.5gMg、Al合金投入到200Ml5mol·L—1的盐酸中,使其完全溶解,然后逐滴加入4mol·L—1NaOH溶液。问当加入NaOH溶液多少mL时产生沉淀的质量最大?
解析:要使沉淀质量最大,即Mg(OH)2和Al(OH)3沉淀完全时,此时溶液中酸或碱均不能过量,溶液中溶质仅为NaCl,根据Na+、Cl—的来源及守恒原理可知:
HCl ~ NaOH ~ NaCl
1mol 1mol
0.2L×5mol/L VL×4mol/L
即 0.2×5=V×4. V=0.25L=250mL
此类方法我们称之为“终态求解法”,抓住某个状态的特征,不追究具体过程。此法可大大简化解题过程。
例2.现有20g16%的氢氧化钠溶液和20mL 2mol/L的硫酸,若用它们与足量的铝屑反应生成氢氧化铝,理论上最多可生成多少氢氧化铝?
![]()
![]() 解析:生成氢氧化铝有三个途径:
解析:生成氢氧化铝有三个途径:
![]()
![]() (1)Al
Al2(SO4)3
Al(OH)3
(1)Al
Al2(SO4)3
Al(OH)3
![]() (2)Al
NaAlO2
Al(OH)3
(2)Al
NaAlO2
Al(OH)3
![]()
![]()
![]() (3)Al
Al2(SO4)3
(3)Al
Al2(SO4)3
Al NaAlO2
通过比较可以确定生成氢氧化铝最多的方法为(3)
n(NaOH)=0.08mol n(H2SO4)=0.04MOL
NaOH ~ Al ~NaAlO2
0.08mol 0.08mol
H2SO4 ~ ![]() Al ~
Al ~ ![]() Al2(SO4)3 ~
Al2(SO4)3 ~
![]() Al3+
Al3+
0.04mol
![]() mol
mol
Al3+ + 3AlO2— + 6H2O = 4Al(OH)3
1mol 3mol 4mol
![]() mol
0.08mol
mol
0.08mol
![]() mol
mol
![]()
恰好反应
m[Al(OH)3]=
![]() mol×78g/mol
mol×78g/mol
=8.32g
答:理论上最多可Al(OH)38.32g
巩固练习
(一)选择:
1.将下列金属分别放入冷的浓硝酸中,不能继续发生反应的是( )
A.镁 B.铝 C.铜 D.银
2.下列物质地中,只能由单质直接化合而制得的是( )
A.FeCl3 B.CuS C.Al2S3 D.FeS
3.自然界的镁、铝主要的存在形式是( )
A.游离态 B.化合态 C.合金 D.氧化态
4.下列不属于更水的是( )
A.矿泉水 B.地下水 C.蒸馏水 D.海水
5.主要成分的镁盐的物质是( )
A.冰晶石 B.重晶石 C.光卤石 D.明矾
6.欲从含少量Al3+的FeCl3溶液中除去Al3+,最好应加入的试剂是( )
A.NaOH溶液和盐酸 B. KOH溶液和稀H2SO4
C.氨水和盐酸 D.碳酸铵
7.为了除去MgCl2酸性溶液中的少量Fe3+,可在加热条件下加入一种试剂,过滤后,再加适量盐酸,这种试剂是( )
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
8.在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大( )
A.AlCl3 B.HCl C.CO2 D.NaHSO4
9.镁、铝都是较活泼的金属,下列描述正确的是( )
A.镁的硬度比铝稍大,熔沸点都比铝高
B.镁、铝都能跟稀盐酸、稀硫酸、强碱反应
C.镁在点燃条件下可以跟二氧化碳起反应,铝在一定条件下可以跟氧化铁发生氧化-还原反应
D.铝热剂是镁条、铝粉和氧化铁的混合物
10.在下列物质的水溶液中,加入稀H2SO4或AlCl3溶液时,都会有沉淀生成的是( )
A.BaCl2 B.Ba(OH)2 C.Na2CO3 D.NaAlO2
11.镁粉在焰火、闪光粉中是不可少的原料,工业制造镁粉是将镁蒸气在气体中冷却,下列可作为冷却气体的是( )
(1)空气 (2)CO2 (3)Ar (4)H2 (5)N2
A.(1)(2) B.(2)(3) C.(3)(4) D.(4)(5)
12.把等质量的金属镁分别放在(1)纯氧气中(2)空气中 (3)二氧化碳气体中,充分燃烧得到固体物质的总质量依次分别是W1、W2、W3,三者的大小关系是( )
A.无法判断 B.W1一定小于W3 C.W3一定大于W2 D.W1等于W3
13.将5克某金属加入100毫升4摩/升的硫酸溶液中,当硫酸浓度降到原浓度的一半时(设溶液体积不变),金属还没有全部溶解,该金属可能是( )
A.铝 B.锌 C.铁 D.镁
14.现有Al(OH)3和Mg(OH)2的混合物,欲使Mg(OH)2溶解,Al(OH)3不溶解,可加入的物质是( )
A.(NH4)2SO4饱和溶液 B.NaOH溶液 C.盐酸 D.氨水
15.把0.1mol铝投入到100mL 3mol/L的NaOH溶液中充分反应后,再滴入1mol/L的H2SO4溶液120mL,其结果是( )
A.溶液的pH值<7 B.得到澄清透明溶液
C.沉淀未能完全溶解 D.先有白色沉淀生成,后逐渐溶解
16.向明矾溶液里滴入Ba(OH)2溶液,当SO42—沉淀完全时,铝元素的存在形式是( )
A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中
B.一部分为 Al(OH)3沉淀,一部分以AlO2—形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以AlO2—形式存在于溶液中
17.既能跟明矾溶液反应,又能跟适量NH4HSO4溶液反应生成白色沉淀的是( )
A. FeCl3溶液 B.NaHCO3溶液 C.KalO2溶液 D.Ba(OH)2溶液
18.冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是( )
A.熔融的MgO不导电 B.MgO分子间作用力很大
C.MgO熔点高 D.MgO属原子晶体
19.将物质的量都为amol的Na和Al一同放入mg足量水中,所得溶液的密度为dg/cm3,则此溶液的物质的量浓度为( )
A.![]() mol/L
B.
mol/L
B.![]() mol/L
mol/L
C.![]() mol/L
D.
mol/L
D.![]() mol/L
mol/L
20.现有20mLMgCl2和AlCl3的混合溶液,其中[Mg2+]=0.2mol/L、[Cl—]=1.3mol/L.要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4mol/L NaOH溶液( )
A.140mL B.120mL C.100mL D.80mL
二、填空题
21.在水溶液中铝元素可以__________或__________两种离子存在,若以__________离子存在水pH值必小于7,若以___________离子存在于水溶液中,pH值必大于7,将分别含有上述离子的两种溶液混和时,析出白色沉淀物,发生反应的离子方程式是__________。
22.有阳离子Al3+、Na+、Mg2+、Ba2+和阴离子CO32—、AlO2—、Cl—、OH—相互形成化合物A、B、C、D、E。试根据其主要性质填写下列分子式。并按要求写出有关离子方程式。
(1)A可由明矾和氨水反应而制得。A________,离子方程式______________。
(2)B微溶于水,可溶于稀H2 SO4,而生成无色澄清溶液,且放出气体。
B___________,离子方程式___________________。
(3)C的水溶液的PH值大于7,通入过量CO2气体可产生沉淀。
C____________,离子方程式___________________。
(4)D的水溶液的PH值小于7,与C溶液混和只产生一种沉淀。
D____________,离子方程式___________________。
(5)E的水溶液的PH值大于7,与D溶液混和产生白色沉淀和气体。
E____________,离子方程式___________________。
23.下图分别表示向I中的溶液逐渐加入(或通入)Ⅱ中的试剂的物质的量(横坐标)与产生沉淀的量(纵坐标)之间的关系。
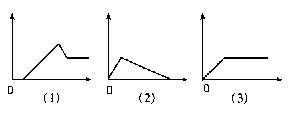 | 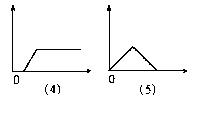 |
Ⅰ溶液:A饱和和石灰水B 氯化铝溶液C 偏铝酸钠溶液D 酸化的氯化铝、氯化镁溶液E 氢氧化钠溶液
Ⅱ溶液:a氢氧化钠溶液 b稀盐酸 c氨水 d二氧化碳 e氯化铝溶液
试将图号对应的溶液标号填入下表(注意:答案不能重复)
| 图号 | (1) | (2) | (3) | (4) | (5) | |
| 答 | Ⅰ | |||||
| 案 | Ⅱ | |||||
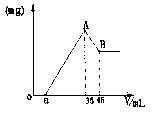 24.准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)
24.准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2)
放入盛有100mL某浓度的硫酸溶液的烧杯中,充分反应后过
滤,向滤液中加入10mol/L的NaOH溶液,产生的沉淀的质
量m与加入NaOH溶液的体积V的关系如右图所示。请填
空回答:
(1)H2SO4溶液的物质的量浓度为_________.
(2)若a=2.3mL,用于沉淀Fe3+消耗NaOH溶液的体积是________mL。铝土矿各组成成分的质量分数:
Al2O3%________,Fe2O3%________,SiO2%_________.
(3)a值的范围应是__________,在这个范围内,a值越大,______含量越小。
(三)计算
25.有一块金属钠投入到盛有100毫升氯化镁和氯化铝的混合注溶液的烧杯中,发现烧杯中沉淀先多后少,反应完毕后收集到标准状况下的氢气13.44升,同时得到21.4克沉淀,将些沉淀溶于过量苛性钠溶液中,发现沉淀减轻了15.6克。求原混合溶液中Mg2+、Al3+及Cl—的物质的量浓度
参考答案
(一)1.B 2.C 3.B 4.C 5.C 6.A 7.D 8.A 9.C 10.D
11.C 12.B、C 13.A、D 14.A 15.C 16.D 17.C、D 18.C
19.C 20.D
(二)21.Al3+,AlO2—,Al3+,AlO2—,Al3++3AlO2—+6H2O==4Al(OH)3↓
22.(1)A:Al(OH)3 Al3++3NH3·H2O===Al(OH)3↓+3NH4+
(2)B:MgCO3 MgCO3+2H+===Mg2++CO2↑+H2O
(3)C:NaAlO2 2AlO2 —+CO2+3H2O==2Al(OH)3↓+3CO32—
(4)D:AlCl3 Al3++3AlO2—+6H2O==4Al(OH)3↓
(5)E:Na2CO3 3CO32—+2Al3++3H2O==2Al(OH)3↓+3CO2↑
23.
| D | C | B | E | A |
| a | b | c | e | D |
24.(1)1.75mol/L (2)2.7,85%,12%,3% (3)1.625<a<5, Fe2O3
25.C(Al3+)=3mol/L C(Mg2+)=1mol/L C(Cl—)=11mol/L