高三化学基本概念和基本理论
1、某元素R的最高价含氧酸的化学式为HaROa+3,该酸的式量为M,则R的最
高正价数为 _________,R的相对原子质量为 _________________,a的数值可
能是 _______ 。
2、某非金属X的最高化合价为+m,它的最高价氧化物所对应的酸分子中有b
个氧原子,则这种酸的化学式为 _____________;该酸和碱反应最多生成 ____
______种酸式盐。
3、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它
们混合反应时,即产生大量氮水和水蒸气,并放出大量热。已知 0.4mol 液态肼
与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652kJ的热量。
(1)反应的热化学方程式为
________________________________________
(2)已知H2O(液)=H2O(气)-44kJ,则 16 克液态肼与液态双氧水反应
生成液态水时放出的热量是 __________ kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个
很大的优点是 _____________________________。
4、已知:A(气)+ B(气)= C(气)+ Q1 (Q1>0)
D(气)+ B(气)= E(气)+ Q2 (Q2>0)
又知Q1>Q2,若A和D的混合气体1mol完全与B反应,放热Q3,则A和D
的物质的量之比是 ____________________。
5、录像用的高性能磁带中的磁粉, 主要原料之一是由三种元素组成的化学式
为 COxFe3-xO3+x的化合物。 已知氧为-2 价,钴(Co)和铁可能是呈现+2
价或+3价,且上述化合物中,每种元素都只能有一种化合价,则x值为 ____,
铁的化合价为________价,钴的化合价为_______。
6、硝酸铅 [Pb(NO3)2] 的稀溶液中, 滴入几滴稀 Na2SO4溶液生成白色
PbSO4沉淀,再滴入数滴饱和 CH3COONa 溶液,微热,并不断搅动,沉淀慢慢
溶解。发上发生的都是复分解反应,写出反应过程的离子方程式
________________________________ ________________________________,
试推测第二步离子反应反发生的原因是 __________________________________
_________________。
7、将0.05mol·L-1Ca(H2PO4)溶液与0.15mol·L-1NaOH溶液等体积混合,
搅拌后静置,充分进行反应。请写出反应的离子方程式:
__________________________________________________________。
8、海水是提取溴的重要资源,从海水中提取溴的方法是:
(1)在 pH=3.5 的海水中通氯气将Br-转变为Br2;
(2)通空气将Br2从海水中吹出,并用Na2CO3溶液吸收;
(3)用硫酸酸化吸收有足量溴的碳酸钠溶液,使单质Br2分离析出。
写出上面每个步骤所发生反应的离子方程式。
① _______________________________________;
② _______________________________________;
③ _______________________________________。
9、(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,请写出发生
反应的离子方程式:________________________________________。
(2)在以上中性溶液中,继续滴加 Ba(OH)2溶液, 请写出此反应的离
子方程式:___________________________。
| 10、在 |
| 的反应中,每3mol的BrF3 |
中被水还原的BrF3的物质的量是 ________ 氧化产物与还原产物物质的量之比为_
__________。
| 11、在一定条件下, |
| 和 | I- | 发生的离子方程式如下: |
![]()
| (1) |
| 中R元素的化合价是 _________。 |
(2)R元素的原子最外层的电子数是 _________。
12、配平下列化学方程式或离子方程式,并回答有关问题。
① _____ Fe3P+_____ HNO3 ─ _____ Fe(NO3)3+_____ H3PO4 +
_____ NO+ _____ __________
② 上述反应中,若有21mol电子转移时,生成是H3PO4是______mol,被还
原的硝酸是 _____ g。
③ 上述反应中,当生成1.8mol Fe3+时,放出NO的体积(标准状况下)
是 ________ L,消耗的HNO3是 _______ mol。
(2)① ____ P +____ CuSO4+ ____ H2O ─ ____ Cu3P+___ H3PO4
+____ H2SO4
②上述反应中,1molCuSO4氧化P的物质的量为 _______ mol。
(3) _______ KIx + ____ CL2 + ____ H2O ─ ____ KCl + ____HIO3
+ _______ _________
若KIx与CL2的系数比为1:8,则x值为 ______ 。
| (4) _____ Clm+_____ OH- ─ _____Cl-+______ |
|
H2O
(5) _______ Na2Sx + ______ NaClO + _____ NaOH ─ _______
Na2SO4+ __________ NaCl+______ H2O
若 Na2Sx 在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试比
求得的x值写出该多硫化钠的化学式 _______ 。
(6) ____ KClO4 + _____ CrCl2 + ____ H2SO4 + ____H2O ─ _____
H2Cr2O7+_____ Cl2↑+_____ K2SO4
① 氧化剂是 _______ ,还原剂是 _______ ,氧化产物是 ____________;
② 若反应过程中,有0.5molCl2被还原出来,则有 ____molCrCl2发生了
反应,并有 _____mol 电子发生了转移。
| (7) _______ |
| +_____________ |
| +_____________ H+ =__ |
_____RO2 + ______ Mn2++_________H2O
| 上述反应中,若0.2mol |
| 离子参加反应时共转移0.4mol电子。 |
① x值= ________ ;
② 参加反应的氢离子的物质的量为 _________ ;
③ 若RO2在常温下为气体,则R属于 _________ 族元素。
13、Na2SO3中有+4 价的硫, 它既有氧化性又有还原性。现有试剂:溴水、
硫化钠溶液、Na2SO3溶液、稀H2SO4、NaOH 溶液、氨水、稀HNO3。
(1)要证明Na2SO3具有还原性,应选用的试剂有______;现象是_____
_______________,反应的离子方程式是_____________________________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有 _____________; 现象
是__________________,反应的离子方程式是________________________。
14、已知下列几个反应,判断还原剂中还原性从强到弱的顺序是
________________________________
(1)2H2SO3+O2=2H2SO4
(2)2Na2SO3+O2=2Na2SO4
|
| (3) |
|
15、用 Na2SO3 和硫粉在水溶液中加热反应,可制得Na2S2O3。10℃和70℃
时,Na2S2O3在100g水中的溶液度分别为60.0g和212g。常温下,从溶液中析出
的晶体是Na2S2O3·5H2O。Na2S2O3在酸性溶液中立即完全分解:
Na2S2O3+2HCl = S↓+SO2↑+H2O+2NaCl
现取15.1Na2SO3溶于80.0mL水中。另取5.00g 1硫粉,用少许乙醇润湿后(以
便硫能被水浸润), 加到上述溶液中。用小火加热至微沸,反应约1小时后过
滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
(1)若加入的硫粉不用乙醇润湿,对反应的影响是______。(填写选项的字母)
A、会降低反应速度 B、需要提高反应温度
C、将增大反应体系析pH值 D、会减少产量
(2)反应1小时后过滤,其目的是 _______________。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质
是_________。它是由_______________而产生的。如果滤液中该杂质的含量不
很低,其检测的方法是_________________________________________________。
(4)设Na2SO3跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体
积约30mL,该溶液是否达到饱和?试通过计算说明。(70℃时,Na2S2O3饱和溶
液的密度为1.17g/cm3)。
(5)若要计算在100℃时将溶液蒸发至体积为30.0mL,再冷却至10℃时所能得
到的Na2S2O3·5H2O的质量,你认为 ______(填写一个选项的字母)
A、前面提供的数据已经足够
B、还需要提供100℃时溶液的密度(1.14g/cm3)
C还需要提供结晶后剩余溶液的体积(10.0mL)
(6)根据第(5)小题你的选择(如选A则直接计算,如选B或C则可选用其
数据),计算以10℃,30.0mL溶液中结晶出的Na2S2O3·5H2O的质量。
16、将一定温度下溶解度小于100g的某物质不饱和溶液分成甲、乙两份。甲份
的质量占1/5。已知甲乙两份之一蒸发掉 m克溶剂或另一份溶液中加入Mg溶质
完全溶解后都可成为该温度下的饱和溶液。则该物质在此温度下的溶解度为__
_______。
17、常温下,将20.0g14%的NaCl溶液和30.0g24%的NaCl溶液混合,得到
密度为1.15g/cm3的混合溶液。
(1)该混合溶液的质量分数是 ______。
(2)该溶液的物质的量浓度是 ______mol/L。
(3)在1000g水中溶解______molNaCl才能使其浓度与上述混合溶液的浓
度相等。
| 18、向强碱性的热溶液中加入足量硫粉,发生反应生成S2-和 |
| ;生成物 |
| 继续跟硫粉作用生成 |
| 和 |
| 。过滤后除去过量的硫,向滤液中加入一定 |
| 量的强碱后再通入足量的SO2,SO2跟 |
| 反应也完全转化为 |
| 请回答: |
(1)写出以上各步反应的离子方程式
① ____________________________________,
② ____________________________________,
③ ____________________________________,
④ ____________________________________,
(2)若有amol硫经上述转化后,最终完全变为Na2S2O3,至少需SO2和NaOH
的物质的量分别是 ① ____________,② ____________。
(3)若原热碱液中含NaOH 6mol,则上述amol硫的转化过程里生成的 Na2Sx中
的X值为_______。
19、在周期表中,同一主族元素化学性质相似,但是会发现有些元素的化学性
质和它在周期表中左上方和右下方的另一主族元素性质相似,如锂与镁,铍与铝
等 ,这称为对角线规则。请回答下列问题:
(1)锂在空气中燃,除生成 _______ 外,也生成微量的 _________。
(2)铍的最高氧化物的水化物的化学式是 ________ 属 ______化合物,证明这
一结论的有关离子方程式是 _________________________________。
(3)若已知反应Be2C+4H2O=2Be(OH)2+CH4↑,则AL4C3遇强碱溶液反应
的离子方程式是 _______________________________。
20、今有A、B、C、D四种元素。其中A元素为1826年法法国青年发现。他
在研究海水制盐时,于剩余的副产物苦卤中通入氯气后发现溶液颜色变深。若进
一步提取,可得一种红棕色液体,有刺鼻的臭味。B、C、D均为短周期元素。D
原子核内的质子数正好等于C原子核内质子数的两倍,而它们最外电子层上电子
数的2倍。则四种元素是:
A _______ B_______ C_______ D_______。
写出由上述元素组成的单质或化合物相互作用生成沉淀的二个反应方程式
(1)_________________________________________
(2)_________________________________________
21、今有A、B、C、D四种短同期元素,它们的核电荷数依次增大。A与C、
B与D分别是同族元素。B、D 两元素的质子数之和是A、C两元素质子数之和
的两倍。这四种元素中有一种元素的单质易溶解于CS2溶剂中。则四种元素是:
A_______、 B_______、 C_______、 D________。
写出两种均含四种元素的化合物相互反应放出气体的化学方程式
____________________________________________
22、AxByCz是由A、B、C三种处于不同短周期的元素组成的化合物。已知:
(1)x、y、z均为正整数,且x+y+z=13。
(2)取0.05mol该化合物与过量的水反应,产生2.4g气体M,同时生成0.05
mol白色胶状沉淀R,且R既能溶于强酸又能溶于强碱。
(3)同温同压下,20mL由B、C两元素组成的M气体,完全燃烧时需40mL
O2,燃烧产物为CO2和H2O,通过分析判断可知3种元素分别是A、___
______、B______、C______,气体M的化学式是_______,该化合物的化学
式是 __________。
23、X、Y、Z三种常见的短周期元素,可以形成、等化合物。已知Y离子和
Z的离子有相同的电子层结构,X离子比Y离子多一个电子层。试回答:
(1)X离子的结构简图____________;
(2)写出工业上由XY2制取XY3的化学方程式____________________;
(3)Z2Y对应水化物的碱性比LiOH________;
(4)Z2Y2的电子式为____________,其中含有_______键和________键。
Z2Y2溶在水中的化学反应方程式__________________________;
(5)Z2X属于______晶体,它与水反应的离子方程式为:
__________________________。
| 24、可逆反应 |
| 在四种不同情况下的反应 |
速率分别为:①VA=0.15mol/L·S ②VB=0.6mol/L·S ③VC=0.4mol/L·S
④VD=0.45mol/L·S,则该反应在不同条件下的反应速率最快的是______。(填
序号)
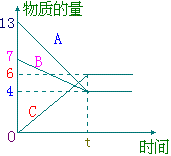
25、某温度时,在VL密闭容器中A、B、C三种物质的物质的量随时间的曲线如
右下图所示。由图中数据分析:
| (1)该反应的化学方程式为 __________________; (2)求时间 t时B的转化率 __________________; (3)反应开始至ts,C的平均反应速率 __________________; | |
26、A、B两容器极易导热,A容器不变,B容器的活塞可上下滑动,保持内外
压强相等,在相同条件下,将等量的NO2 压入容积相同的A、B两容器中进行反
应:![]() (用大于、小于、等于、增加、减小)回答下列问题:
(用大于、小于、等于、增加、减小)回答下列问题:
(1)反应起始时,两容器中生成N2O4的速率关系是______;
(2)反应达平衡时,两容器中生成N2O4的速率关系是______;
(3)反应达平衡后,NO2转化率大小关系是αA______αB;
(4)反应过程中____容器中反应先达平衡,在均达平衡后,分别向两容器
中充入等量的氩气,会造成平衡动的容器是____平衡移动后,NO2 转化率
将______;
(5)达平衡时两容器中分子总数nA______nB;
(6)达平衡时两容器中的压强PA______PB。
27、在一定温度下,把4 molA气体和5 mol气体通入一个固定容积的密闭容器
| 中,发生以下反应: |
| 当此反应进行到 |
一定程度时,反应混合物就处于化学平衡状态。 现在该容器中,维持温度不变,
令a、b、c、d 分别代表初始加入的A、B、C、D的物质的量,如果、取不同的数
值,它们必须满足一定关系,才能保证达到平衡时完全相同,请填写下列空白:
(1)a =0,b=0时,则c=_____, d=_____。
(2)若a=1,则c=_____,d=_____。
(3)a、b、c 取值必须满足的一般条件是(请用两个方程式表示,其中一
个只含a和c,另一个只含b和c)。
28、用0.1mol/LNaOH溶液做导电性实验, 然后逐渐滴加入等体积0.1mol/L
CH3COOH溶液,随着醋酸溶液的加入,电流计的读数会_______其原因是____
______________。
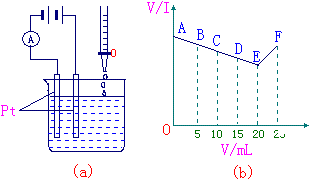
| 29、有一实验如右下图所示,将 30mL 0.1mol/LBa(OH)2溶液置于烧 杯中,然后边搅拌边慢慢加入 0.1mol/L由第3周期某元素形成的某 酸溶液25mL。加入酸溶液的体积V和 安培计的读数的坐标图如图(b) |
|
(1)此酸的化学式为_________;
(2)处于C点时,溶液中导电的阳离子主要是____________;
(3)处于F点时,溶液中导电的阴离子主要是___________;
(4)烧杯中刚加入酸时,观察到的现象是____________________;
(5)上图(b)中,从A→E电流强度I变小的主要原因是________________
_________________________。
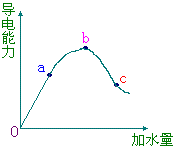
30、在一定温度下,冰醋酸加不稀释过程中,溶液的导电能力如右下图所示,
请回答:
| (1)“O”点导电能力为0的理由是 ________________________________; (2)a、b、c三点溶液pH值由小到大 的顺序为_______________________; (3)a、b、c三点中电离度最大的是 ___________; | |
(4)若使C点溶液中[Ac-]增大,溶液的pH值也增大,可采取的措施是
①_________________;②________________;③_________________。
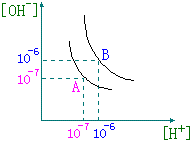
31、设水的电离平衡曲线如右下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃
时,水的电离平衡状态到B点,则此时水的离子积从_________增加到_________;
| (2)将pH=8的Ba(OH)2溶液与 pH=5时的盐酸混合,并保持100℃的恒 温,欲使混合溶液pH=7,则Ba(OH)2与 盐酸的体积比为__________; (3)已知AnBm的离子积=[Am+]n [Bn-]m式中的[Am+]n和[Bn-]m表示 | |
离子的物质的量浓度。在某温度下,Ca(OH)2的溶解为0.74g,其饱和溶液密度
设为1g/cm3,其离子积为____________;
(4)若在室温下平均每n个水分子只有一个水分子发生电离,则n值是 __
__________;室温时10mL水中含有氢氧根离子约有___________个;
(5)常温时0.1mol/LHNO3和0.01mol/LHAc中水的电离度的关系是_____(填
>、<、=等符号);
(6)常温时pH值相同的HNO3和HAc中水的电离度的关系是_____;
(7)常温时0.3mol/L的H2SO4和0.6mol/L的NaOH中水的电离度的关系是____;
(8)pH=10的NaOH溶液与pH=10的NaCN溶液中水的电离度之比是_____;
(9)pH=4的HCl溶液与pH=4的NH4I溶液中水的电离度之比是______;
(10)pH=6的HCl溶液和pH=6的NH4Cl溶液,其中水电离出的[H+]分别
为xmol/L和 ymol/L,则x/y的比值为__________。
32、25℃时,将某强酸和某强碱溶液按1:10的体积比混合后溶液恰好呈中性,
则混合前此强酸与强碱溶液的pH值之和是_________
33、将pH值为6的盐酸与pH值为4的盐酸等体积混合后,溶液中的氢氧根离子的
物质的量浓度约是__________________。
34、已知百里酚酞的变色范围是9.4~10.2。相同物质的量浓度的三种稀溶液:
NaH2PO4的pH=4.7;Na2HPO4的pH=10;Na3PO4的pH=12。今有0.5g某种磷
酸的钠盐水合物溶于50mL0.1mol/L的H2SO4溶液中,稀释至100mL。取出1/5该溶
液(以百里酚酞作指示剂)需0.1mol/L的NaOH溶液26.4mL中和,则钠盐水合
物的化学式为_____________。
35、与[H+][OH-]=K=1.0×10-22类似,FeS饱和溶液中[Fe2+][S2-]=Ksp,
已知某温度下Ksp=6.25×10-18。
(1)饱和FeS溶液的物质的量浓度为______________;
(2)又知H2S饱和溶液中,[H+]2[S2-]=K=1.0×10-22,现将适量FeS投
入其饱和溶液中,要使溶液里[Fe2+]达到1mol/L,则应将溶液的pH值
调节为______________。
36、在25℃时,有pH值为x的盐酸和pH值为y的NaOH溶液,取VxL该盐酸
同该NaOH溶液中和,需VyLNaOH溶液,问:
(1)若x+y=14时,则Vx/Vy=_________(填数值);
(2)若x+y=13时,则Vx/Vy=_________(填数值);
(3)若x+y>14时,则Vx/Vy=_________(填表达式),
且Vx_____Vy(填>、<或=); (题中的x≤6,y≥8。)
37、有 a、b、c、d 四种一元酸的溶液,通过如下实验:(1)物质的量深度相
同的a、c溶液分别滴加甲基橙溶液,a溶液变黄色,c溶液不变色; (2)物质的
量浓度相同的b、c的钠盐相比较。b的钠盐溶液pH值小于c的钠盐溶液pH值;
(3)a酸跟d的钠盐反应生成d 酸和a的钠盐。据此确定四种酸的酸性强弱的顺
序是________________________________。
38、浓度均为0.1mol/L的八种溶液:①HNO3、②H2SO4、③Na2CO3、④Ba(OH)2、
⑤KOH、⑥CH3COONa、⑦NH4Cl、⑧NaCl则溶液的pH值由小到大的顺序是(填
序号)_________________________________________。
39、0.1mol/L Na2S溶液中离子浓度由大到小的顺序是
________________________________。
40、0.1mol/L NaHCO3溶液中离子浓度由大到小的顺序是
________________________________。
41、将等体积的0.4mol/LCH3COONa溶液与0.2mol/LHNO3溶液相混合,混合液中
各种离子浓度由大到小排列的顺序是_____________________________。
42、将0.2mol/L的Ba(OH)2溶液和0.15mol/L的NaHCO3溶液等体积混合后,溶液
中各种离子浓度由大到小排列的顺序是______________________________。
43、将6g铁粉放入到100mL4mol/L的HNO3中,充分反应放出NO气体后,溶液中
各种离子浓度由大到小排列的顺序是_______________________________。
44、有甲、乙。丙三瓶等体积等物质的量浓度的NaOH溶液。若将甲蒸发掉一
半水,在乙中通入少量CO2,丙不变,然后用某浓度H2SO4溶液滴定,完全反应
后,甲、乙、丙三瓶NaOH溶液所需H2SO4溶液的体积关系是________________。
(甲、乙、丙三种溶液分别用=、>、<、表示)
45、用0.1mol/L NaOH溶液滴定100mL 0.1mol/L HCl溶液时,若滴定误差在
±0.1%以内,当反应完毕后溶液的pH值变化范围是__________________。
46、称取NaOH、Na2CO3的混合物wg,溶于水中,加入酚酞为指示剂,用物质
的量浓度为M的盐酸滴定,耗用V1L时酚酞变为无色,此时发生的化学反应方程式
是(1)____________________________________;若混合再以甲基橙为指示剂,
用HCl继续滴定,当耗用V2L盐酸时甲基橙变为橙红色, 此时发生的化学方程式
是(2)_____________________________________。 混合物中NaOH的百分含量
为__________________,Na2CO3的百分含量为___________________。
47、有A、B、C、D四种金属。将A与B用导线联结起来,浸入电解质溶液里,
B不易被腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐
溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它
们的活动性由强到弱的顺序是_____________________。
48、银器皿日久表面逐渐变黑色,这是由于生成硫化银。有人设计用原电池原
理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变
黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在
此原电池反应中,负极发生的反应为_______________;正极发生的反应为______
______;反应过程中产生臭鸡蛋气味,原电池总反应方程式为_________________
_____________________。
49、用惰性电极电解某金属硫酸盐时,在阴极上析出ag金属,同时在阳极上析
出0.8g气体。如果该金属的原子量为b,则金属的化合价是__________。
50、用惰性电极电解50mLAgNO3溶液,通电进行电解后,当溶液的pH值从6.0变
为3.0时(体积无变化)。则此时电极上析出银的质量为__________毫克。
1. a+6; M-17a-48; 1。
2. H2b-mXOb; 2b-m-1。
3. (1)N2H4(液)+2H2O2=N2(气)+4H2O(气)+641.63kJ
(2)408.815;(3)产物不会造成环境污染。
4. (Q3-Q2):(Q1-Q3)
5. 1; +3; +2。
| 6. Pb2++ |
| =PbSO4+ |
|
PbSO4+2CH3COO-=Pb(CH3COO)2
反应生成的醋酸铅是弱电解质,破坏了PbSO4的溶解平衡。
| 7. 3Ca2++6 |
| +9OH-=Ca3(PO4)2↓+ |
| +3 |
|
+9H2O
8. (1)Cl2+2Br-=Br2+2Cl-
| (2)3Br2+3 |
| =5Br | -+ |
| +3CO2↑ |
| (3)5Br-+ |
| +6H+=3Br2+3H2O |
| 9. (1)2 |
| +Ba2++2OH-=2H2O+BaSO4↓+ |
|
| 或2H++ |
| +Ba2++2OH-=2H2O+BaSO4↓ |
| (2)Ba2++ |
| =BaSO4↓ |
10. 4 / 3 mol; 2:1。
11. +5价; 7。
12.(1)①3、41、9、3、14、16、H2O ②1.5、441
③62.72、8.2
(2)①11、15、24、5、6、15 ②0.2
(3)2、5x+1、6x、2、2x、10x、Hcl; 3。
(4)2n、 2mn、 m(2n-1)、 m、 mn。
(5)1、 3x+1、 2x-2、 x、 3x+1、 x-1; Na2S5
(6)12、 14、 6、 1、 7、 20、 6
① KClO4、CrCl2、H2Cr2O7和Cl2;0.5mol、1.17mol、7mol。
(7)5、 4x-6、 12x-8、 5x、 4x-6、 6x-4
① 2 ② 0.64mol ③ ⅣA
13.(1)溴水 溴水的橙红色褪去。
|
|
| +Br2+H2O=2H++ |
| +2Br | - |
(2)硫化钠溶液和稀H2SO4 有淡黄色沉淀产生。
| 2S2-+ |
| 6H+=3S↓+3H2O。 |
14. Na2SO3>H2SO3>SO2。
15.(1)A、D (2)除去过量硫粉
(3)Na2SO4; Na2SO3被空气氧化;
取少量溶液,加稀盐酸至酸性后,过滤除去S,再加BaCl2溶液。
(4)不饱和 (5)B (6)23.2g。
16. 25g
17.(1)20% (2)3.93 (3)4.72
| 18.(1)①3S+6OH -=2S 2 -+ |
| +3H2O |
| ②S 2 -+(x-1)S= |
| ③ |
| +S= |
|
| ④2 |
| +2(x+1)SO2+2(2x-1)OH-=(2x+1) |
|
+(2x-1)H2O
(2)amol 2amol (3)a/3
19.(1)Li2O Li3N
(2)Be(OH)2 两性 Be(OH)2+2H+=Be2++2H2O
| Be(OH)2+2OH -= |
| +2H2O |
(3)Al4C3+12H2O=3Al(OH)3↓+3CH4↑
| Al(OH)3+OH -= |
| +2H2O |
| 或Al4C3+3OH -=4 |
| +3CH4↑ |
20. Br、 H、 O、 S
(1)H2S+Br2=2HBr+S↓
(2)2H2S+O2=S↓+2H2O
21. H、 O、 Na、 S
NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O
22. Al、 C、 H、 CH4、 Al(CH3)3。
23.(1)硫离子结构示意图 +16 2 8 8
| (2) |
|
(3)强
| (4) |
| 离子键 非极性键 |
2Na2O2+2H2O=4NaOH+O2↑
| (5)离子晶体 |
|
24. D
| 25.(1) |
| (2)42.9% (3)6/V mol/L·s |
26.(1)等于 (2)小于 (3)小于
(4)B、B、减小 (5)大于 (6)小于
27.(1)4mol、6mol (2)3mol、4.5mol
(3)a+c=4 20=4b+5c
28. 不变 溶液中离子浓度不变。
29.(1)H3PO4 (2)Ba2+
| (3) |
| (4)有白色沉淀生成 |
(5)生成难溶的Ba3(PO4)2和难电离的水,使溶液中离子
浓度降低。
30.(1)在“0”点处醋酸未电离,无离子存在。
(2)在稀释过程中[H+]=[Ac-],导电能力越强,说明
溶液中[H+]、[Ac-]越大,pH值越小,故pH值由小到大
的顺序为:b<a<c。
(3)加水量越多,醋酸浓度越小,电离度越大,故电离度
最大的是C点。
(4)①加入NaOH固体 ②加入Na2CO3固体
③加入镁锌等金属 或加入NaAc固体。
31.(1)10-14 10-12 (2)2:9 (3)0.004
(4)55.6×107 6.02×1014 (5)小于 (6)等于
(7) 等于 (8)10-6 (9)10-6 (10)10-2
32. 13。
33. 2×10-10 mol / L
34. NaH2PO4·2H2O。
35.(1)2.5×10-9mol / L (2)2.4
36.(1)1 (2)1/10 (3)10a+b-14; >。
37. b >c >a >d。
38. ②①⑦⑧⑥③⑤④ ②=④<①= ⑤<⑧<⑥<⑦<③。
39. [ Na+ ]>[ S2- ]>[ OH- ]>[ HS- ]>[ H+ ]
| 40. [ Na+ ]>[ |
| ]>[ |
| ]>[ OH- ]>[ H+ ] |
| 41. [ Na+ ]>[ CH3COO- ]>[ |
| ]>[ H+ ]>[ OH- ] |
42. [ OH- ]>[ Na+ ]>[ Ba2+ ]>[ H+ ]
| 43. [ |
| ]>[ Fe3+ ]>[ Fe2+ ]>[ H+ ]>[ OH- ] |
44. 甲=丙=乙
45. 4.3~9.7
46.(1)NaOH+HCl=NaCl+H2O
Na2CO3+HCl=NaCl+NaHCO3
(2)NaHCO3+HCl=NaCl+CO2↑+H2O
[40M(V1-V2)/w]×100%; [106MV2/w]×100%。
47. D A B C
48. Al-3e=Al3+ Ag2S+2e=2Ag+S2-
2Al+3Ag2S+6H2O=2Al(OH)3↓+6Ag+3H2S↑
49. b/10a
50. 54