高三化学模拟试卷
第I卷(选择题,共70分)
可能用到的原子量:H 1 Li 7 Be 9 C 12 N 14 O 16 Na 23 Mg 24 S 32 K 39
一、选择题(本题包括5小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.据报道,用![]() 合成的
合成的![]() 有很好的抗癌治癌作用。下列叙述正确的是
有很好的抗癌治癌作用。下列叙述正确的是
A.![]() 与
与![]() 互为同位素 B.
互为同位素 B.![]() 与
与![]() 互为同分异构体
互为同分异构体
C.![]() 的质子数与中子数相等 D.
的质子数与中子数相等 D.![]() 与
与![]() 的核外电子数相差1
的核外电子数相差1
2.“神舟五号”飞船发射成功,表明我国载入航天技术已达到世界先进水平。在运送飞船的某些火箭推进器中盛有液态肼![]() 和液态氧化剂
和液态氧化剂![]() ,它们充分混合反应后的产物之一是
,它们充分混合反应后的产物之一是
A.氮气 B.氧气 C.氨气 D.氢气
3.物质发生化学反应时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是
A.①②③⑤ B.②⑤⑥ C.④⑤⑥ D.①②⑤
4.2003年诺贝尔化学奖授予了美国科学家Peter Agre和Roderick Mackinnon以表彰他们在“水通道”和“离子通道”的研究成就。Mackinnon教授的研究内容主要是Na+、K+体积很接近,但在生物体内呈现的差别却高达1万倍,他革命性的让科学家观测Na+、K+在进入离子通道前、通道中以及穿过通道后的状态,可为病人在“离子通道”中寻找具体的病因,并研制相应药物。下列关于钠、钾的说法正确的是
A.单质钠的密度比钾的密度小 B.钠和钾在空气中燃烧的产物都是过氧化物
C.钠和钾都是短周期元素 D.钠和钾的合金[ω(K)=50%-80%]在室温下呈液态
5.用0.01mol·L-1NaOH溶液完全中和pH=3的下列溶液各100mL。需NaOH溶液的体积最大的是
A 盐酸 B 硫酸 C 高氯酸 D 醋酸
二、选择题(本题包括10小题,每小题5分,共50分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分。)
6.下列说法中,正确的是(用NA表示阿伏加德罗常数值)
A 常温常压下,1mol氖气含有的核外电子数是20NA
B 32g氧气和32g臭氧所含氧原子数都为2NA
C 18g水中所含的电子数是8NA
D 标准状况下,1L戊烷完全燃烧后生成的二氧化碳的分子数是5NA/22.4
![]() 10.可逆反应的正、逆反应速率可用各反应物或生成物的浓度
10.可逆反应的正、逆反应速率可用各反应物或生成物的浓度
变化来表示。下列各关系中能说明反应已达到平衡状态的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
11.某溶液中水电离出的![]() 该溶液中肯定不能大量共存的是
该溶液中肯定不能大量共存的是
A.![]()
![]()
![]()
![]() B.
B.![]()
![]()
![]()
![]()
C.![]()
![]()
![]()
![]() D.
D.![]()
![]()
![]()
![]()
已知:晶体可以分为分子晶体、离子晶体、原子晶体等,在以下两个题目中,分别对不同晶体的组成、微粒间的作用力以及晶体的几何构型等进行了描述,请做出选择:
12.下列关于只含非金属元素的化合物的说法正确的是
A 一定是共价化合物,且只能构成分子晶体;
B 其晶体不可能是离子晶体,因为微粒间的作用力只有分子间作用力;
C 其晶体不可能是原子晶体,原子晶体只有非金属单质,没有化合物;
D 可能是离子化合物。
13.有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为
A 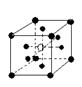 B
B 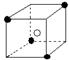 C
C 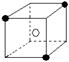 D
D 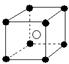
14.将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中以下各 正确的是
A C(NO3-)>C(OH-)>C(NH4+)>C(Ba2+)
B C(NO3-)>C(Ba2+)>C(OH-)>C(NH4+)
C C(Ba2+)+ C(NH4+)+ C(H+)= C(NO3—)+ C(OH—)
D 2 C(Ba2+)+ C(NH4+)+ C(H+)= C(NO3—)+ C(OH—)
15.下列除去杂质的方法正确的是
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
| C | Fe | I2 | / | 加热 |
| D | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
16.下列离子方程式中正确的是
A 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-→BaSO4↓+2H2O
B NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-→NH3↑+H2O
C 苯酚钠溶液中通入少量CO2:![]() -O-+CO2+H2O→
-O-+CO2+H2O→![]() -OH+HCO3-
-OH+HCO3-
D FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2→2Fe3++Br2+4Cl-
17.铝和镓的性质相似,如M(OH)3 都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝矿,如Al2O3 中。用NaOH 溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3 沉淀,而NaGaO2 留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为
A、镓酸酸性强于铝酸 B、铝酸酸性强于镓酸
C、镓浓度小,所以不沉淀 D、Al(OH)3 是难溶物
18.反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)已达平衡。若增大压强,平衡移动,但混合气体的平均相对分子质量不变。下列说法正确的是
CO(NH2)2(s)+H2O(g)已达平衡。若增大压强,平衡移动,但混合气体的平均相对分子质量不变。下列说法正确的是
A、原混合气体的平均相对分子质量为30
B、原混合气体的平均相对分子质量为18
C、起始时,NH3与CO2的体积比为13:14
D、起始时,NH3与CO2的体积比为14:13
第II卷(非选择题,共80分)
三、(本题包括2小题,共26分)
16.(4分)可用于加热的玻璃仪器有
①烧杯、②烧瓶、③试管、④锥形瓶、⑤表面皿、⑥坩埚
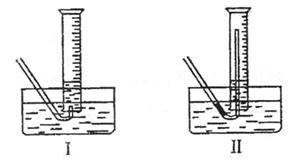
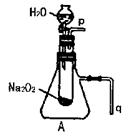 17.(22分)高一新教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
17.(22分)高一新教材中有一演示实验,用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二, 。Na2O2跟水反应的化学方程式是 ,
其中还原剂是 ,氧化剂是 。
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是:
用以验证第二条结论的实验方法是:
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,往试管中滴入酚酞试液,发现溶液先变红后褪色。为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂: 。
现象: 。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中否含有H2O2,其实验方法为:称取2.6g Na2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论。
|
①测量气体体积时,必须待试管和量筒内的气体都冷却至室温时进行,应选用上图装置中的(忽略导管在量筒中所占的体积) (填序号),理由是
。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为
(选填“100mL”“200mL”“500mL”或“1000mL”)。
四、(本题包括2小题,共18分)
18.(6分)X、Y、Z三种元素位于周期表前20号元素之中。
已知:①XY2加水生成Y2Z2和化合物D; ②X的氧化物加水也生成D;
③ Y的氧化物有两种。
请填空:(1)X、Y的元素符号为:X 、Y 。
(2)反应①的化学方程式为 。
19.(12分)如图,B为常见金属或非金属单质,有下列转化关系:
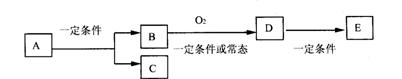
请回答以下问题:
①若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是_________;E的电子式为_________。
②若E在标准状况下为易挥发的晶体,且溶于水显酸性,则B是________;工业上D转化为E的一定条件是________。
③若C是水,B是有机化合物,且是同系物中相对分子质量最小的物质,E能使紫色石蕊试液变红色。则A是_______;A、B、D、E中易溶于C的物质是______________(填字母)。
五、(本题包括1小题,共14分)
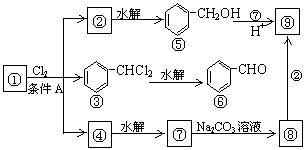 20 通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:
20 通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:
右图是9个化合物的转变关系:
(1)化合物①是 它跟氯气发生反应的条件A是
(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨,⑨的结构简式是 ,
名称是 。
(3)化合物⑨是重要的定香剂,香料工业上常用化合物②和⑧直接合成它。此反应的化学方程式为
。
(4) 四氯甲烷的水解产物的结构式为 。该物质是否会造成环境问题
(若是,填造成什么样的问题,若否,填不会造成环境问题)
六、(本题包括2小题,共22)
21.(10分)现在由等物质的量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。不要求写计算过程)
(1)该混合物中NaHCO3与KHCO3的质量之比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 mol·L—1。
(3)如果盐酸过量,生成CO2的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道
。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是 。
22.(12分)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称: 。
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数)
化学试题参考答案与评分标准
1.C 2.A 3.D 4.D 5.D 6.CD 7.A 8.D 9.B 10.BD 11. 12.A 13.AC 14.A 15.AD
16.(2分)①②③
17.(20分)(1)该反应是放热反应(1分);
2Na2O2+2H2O 4NaOH+O2↑(2分);Na2O2(1分);Na2O2(1分)
(2)将带火星的木条靠近导管口P处,木条复燃(3分);将导管q浸入水中,反应过程中导管口有气泡冒出(3分)
(3)MnO2(2分);气泡迅速产生,能使带火星的木条复燃(1分)(或Na2S溶液;溶液变浑浊。只要合理均可给分)
(4)①Ⅱ(1分) 防止气体冷却时发生倒吸现象(2分) ②500mL(3分)
18.(6分)(1)Ca C
(2)CaC2+H2O![]() C2H2↑+Ca(OH)2
C2H2↑+Ca(OH)2
19.(本小题10分)
①则A是_____NaCl____;
②则B是____S_ __;D转化为E的一定条件是 催化剂、加热。 。
③则A是___CH3CH2OH____;A、B、D、E中易溶于C的物质是_ A、D、E____(填字母)。
20、(1) ;光照
![]()
![]() (2)
;苯甲酸苯甲酯
(2)
;苯甲酸苯甲酯
(3)
(4)O=C=O,温室效应
21.(8分)
(1)84:100(或21:25) (2)![]() (3)
(3)![]() (4)盐酸的物质的量浓度(其他合理答案也给分) 5)
(4)盐酸的物质的量浓度(其他合理答案也给分) 5)![]() 8
8
22.(12分)(1)碳酸锂,碳酸钠,碳酸铍,碳酸镁
(2)mA/MA=mB/MB+mC/MC(或MB<MA<MC;MC<MA<MB 以及其它合理答案=
(3)2种 Li2CO3 MgCO3
(4)MgCO3,BeCO3,Na2CO3 1.05