高三化学七校联考试卷
考试时间:120分钟,共150分
可能用到的原子量: H: 1 O: 16 N: 14 Na: 23 Cl: 35.5 C: 12 K: 39 Al:27 S: 32 Fe: 56 Mg: 24 Cu: 64 P:31
第I卷(选择题,共72分)
一、选择题(本题共8小题,每小题4分,共32分。每小题只有1个选项符合题意)
1、人们把食品分为“绿色食品”、“蓝色食品”、“白色食品”等,绿色植物通过光合作用转化的食品叫做“绿色食品”,海洋提供的食品叫做“蓝色食品”,通过微生物发酵制得的食品叫做“白色食品”。下列物质属于“白色食品”的是
A、面粉 B、食醋 C、海带 D、菜油
2、下列五种粉末状物质:硅酸、氧化镁、碳酸钠、硫酸铝、氢氧化铝,为了鉴别它们,除了蒸馏水外,还必须使用的一组试剂是:
A、NaOH溶液和CO2 B、盐酸与NaOH溶液
C、盐酸与CO2 D、氯化钡溶液与硫酸
3、下列除去杂质的方法正确的是
A、除去N2中的少量的CO:通过足量的灼热的CuO粉末,收集气体
B、除去SO2中的少量的C2H4:通过足量的溴水,收集气体
C、除去AlCl3溶液中的少量CaCl2:加适量Na2CO3溶液,过滤
D、除去MgCl2溶液中少量的FeCl3:加足量MgO,过滤
4、1g炭与适量的水蒸气反应生成CO和氢气,需要吸收10.9KJ的热量,则下列热化学方程式正确的是:
A、C+H2O=CO+H2;△H=+131.2KJ/mol
B、CO(g)+H2(g)=C(s)+H2O(g);△H= —131.2KJ/mol
C、C(s)+H2O(g)=CO(g)+H2(g);△H=+10.9KJ/mol
D、C(s)+H2O(g)=CO(g)+H2(g);△H= —131.2KJ/mol
5、在标准状况下,下列溶液:①含1molNaOH的500mL溶液,②含1molH2SO4的稀硫酸,③含1molHCl的稀盐酸,④含H2SO4、Mg(NO3)2各1mol的500mL溶液,分别与1mol铝充分反应,生成H2由多到少的顺序为:
A、①>②>③>④ B、①=②=④>③
C、①>②=④>③ D、②>③>④>①
6、物质A2SO4的饱和溶液VmL密度为dg/mL,C(A+)=pmol/L,溶液的质量分数为a%,溶液的式量为M,溶解度为s,则下列表达式正确的是:
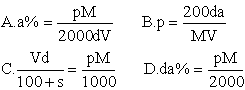
![]()
![]() 7、有一未完成的离子方程式为:
+ XO3—+ 6H+= 3X2 + 3H2O,据此判断:X元素的最高化合价为:
7、有一未完成的离子方程式为:
+ XO3—+ 6H+= 3X2 + 3H2O,据此判断:X元素的最高化合价为:
A、+1 B、+4 C、+5 D、+7
8、浓度不等的两种硫酸溶液等质量混合后,溶液的质量分数为a%,而等体积混合后,溶液的质量分数为b%;浓度不等的两种氨水等质量混合后,其质量分数为a%,而等体积混合后,溶液的质量分数为c%,那么a、b、c数值的关系是
A、a>b>c B、b>a>c C、c>b>a D、c>a>b
二、选择题(本题共10小题,每小题4分,共40分。每小题有1个或两个选项符合题意)
9、下列物质中,不含(X2n-)原子团的是
A、Mg3N2 B、CaO2 C、Na2S2 D、MgC2
10、关于浓硫酸的说法正确的是
A、浓硫酸的物质的量浓度可通过用PH试纸测其PH值来确定
B、浓硫酸可干燥各种酸性气体
C、实验室可用浓硫酸与浓盐酸混合的方法制氯化氢气体
D、浓硫酸与木炭在加热时反应所得气体通入BaCl2溶液,始终得不到沉淀
11、在水溶液中可能大量共存,通入足量氨气后,得到透明溶液的是
A、Ba2+、Na+、Br-、HCO3— B、Cl-、NO3-、K+、Mg2+
C、Na+、K+、Ag+、NO3- D、Al3+、HCO3-、K+、SO42-
12、某溶液可能含有Fe3+、Fe2+、Cl-、Br-。往其中加入足量氯水后分三份
①第一份加入KSCN溶液出现红色 ②第二份加入苯,上层出现橙红色
③第三份加硝酸银,出现白色沉淀 则原溶液中,肯定存在的离子是
A、Fe3+ B、Fe2+ C、Cl- D、Br-
13、下列离子方程式书写正确的是
A、向苯酚钠溶液为通入少量的CO2:C6H5O-+CO2+H2O=C6H5OH+HCO3-
B、用氨水吸收少量的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
C、硝酸铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D、硫酸铁溶液中加入过量的铜粉:2Fe3++3Cu=2Fe+3Cu2+
![]() 14、设NA表示阿伏加德罗常数,下列有关叙述不正确的是
14、设NA表示阿伏加德罗常数,下列有关叙述不正确的是
A、在标准状况下,VL水含有的氧原子个数为
B、常温常压下,1mol碳烯(:CH2)所含电子总数为8NA
C、1LPH=1的水溶液中,水合氢离子数为0.1NA
D、1molOH-在电解过程中被氧化,提供电子的数目为NA个
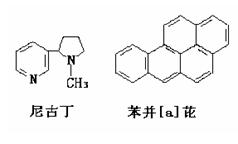 15、对尼古丁和苯并[a]芘的分子组成与结构描述正确的是
15、对尼古丁和苯并[a]芘的分子组成与结构描述正确的是
A、尼古丁为芳香族化合物
B、尼古丁的分子式为C10H14N2
C、苯并[a]芘分子中含有苯环结构单元,是苯的同系物
D、尼古丁分子中的所有碳原子一定不在同一平面上,苯并[a]芘分子中所有氢原子可能都在同一平面上
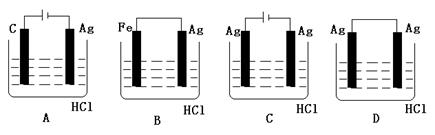 16、某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是
16、某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是
17、A+、B+、C-、D-四种离子两两组成可溶性盐,其中:AC盐与BD盐溶液PH=7,BC盐溶液PH>7,则下列说法不正确的是
A、AD盐溶液PH>7 B、在AC盐溶液中:[A+]+[AOH]=[C-]+[HC]
C、将AD盐和BC盐等物质的量混合溶于水,溶液PH=7
D、相同条件下,酸电离程度一定是:HD>HC
18、PH值均为2的盐酸和醋酸各100mL,分别稀释2倍,再分别加入0.03g锌粉,在相同条件下充分反应,有关叙述正确的是
A、醋酸与锌反应放出的氢气多 B、放出氢气酸醋酸与盐酸一样多
C、醋酸与锌反应速率快 D、盐酸和醋酸与锌反应的起始速率一样
第II卷(非选择题,共78分)
| 题号 | 三 | 四 | 五 | 六 | 总分 | 核分人 |
| 得分 | ||||||
| 阅卷人 |
三、(本小题包括2小题,共22分)
19、(1)(5分)通常实验室把金属钠保存在装有一定量 的大口试剂瓶中,现需要观察金属钠在空气中被氧化的过程,具体实验中需要用到的实验用品有 、 、 、 。
(2)(5分)现有一瓶醋酸,要测定其中已电离的CH3COOH分子的占原溶液中醋酸分子总量(包括已电离和未电离的)的百分率,其实验方案如下:(1)先测定溶液的PH,其操作方法是 ,测量溶液PH值的目的是 。
(2)再做 实验(填写实验名称),目的是 。将以上测定所得数据进行处理即可达到实验目的。
20、(12分)氧化二氯是棕黄色刺激性气体,熔点:—116℃,沸点:3.8℃。氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1:100),同时反应生成次氯酸溶液。制备出之后要冷却成固态以便操作和贮存,制备少量Cl2O,是用干燥的氯气和HgO反应(还生成HgO•HgCl2)。装置示意如图,铁架台和夹持仪器已略去)
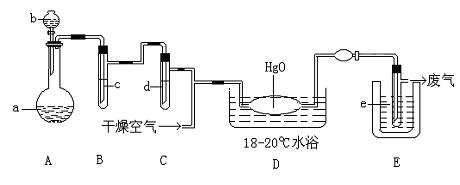
(1)A中盛有的固体深色试剂a是 ,分液漏斗中试剂b是
(2)B中盛有液体c是 ,C中的液体d是
(3)D中所发生反应的化学方程式是
(4)E中的保温瓶中盛有致冷剂,它应是 (在干冰、冰水、液态空气中选择),在E的内管得到的氧化二氯中可能含有杂质是
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是
,用这些不同的连接方式的主要理由是 。
四、(本小题包括2小题,共20分)
21、(11分)A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2。A、B、D可组成离子化合物,该晶体化学式为B4A3D2,其水溶液呈弱酸性。B与D可形成一种极易溶于水的碱性气体X。B与C可形成极易溶于水的酸性气体Y。已知X分子与B2A分子中的电子数相等。Y分子与最简式为BA的分子中的电子数相等。请回答:
(1)写出元素的名称:A , C
(2)Y分子是 分子(填极性或非极性)。
(3)写出下列反应的化学方程式并标明电子转移的方向和数目
①C2+(BA)n→A2
②C2+X(过量)→D
(4)B4A3D2水溶液呈酸性,写出其呈酸性的离子方程式
(5)已知液态X与B2A相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为:
22、(9分)A、B、C、D是中学化学中常见的四种化合物,它们分别由两种元素组成。甲、乙、丙是单质,甲、丙、A、C、D常温下均为气体,B为液体。这些单质和化合物之间存在如下关系:
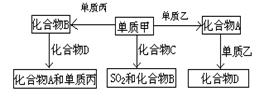
⑴写出B物质的分子式: 。
⑵写出下列A物质的电子式:
⑶写出单质甲跟化合物C反应,生成SO2和化合物B的化学方程式 。
⑷在密闭容器中,化合物B跟化合物D在高温下生成A和单质丙的反应是可逆反应,其化学方程式为 ;反应达平衡后,若增大体系的压强,该平
衡 (填向左移动、向右移动、不移动);其理由是 。
五、(本小题包括2小题,共18分)
23、(8分)某有机物含C、H、N、O四种元素,下图为该有机物球棍模型。
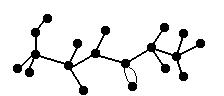
(1)该有机物的化学式为 ,结构简式为 。
(2)该有机物可能发生的化学反应有(填序号)
①水解 ②加聚 ③取代 ④消去 ⑤酯化
(3)该有机物发生水解反应的化学方程式为
24、(10分)青霉素(C16H18N2O4S)的结构简式为
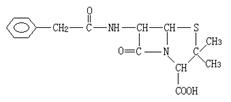
它是人们经常使用的一种抗生素,但是经过多年的使用,不少病菌对青霉素产生了抗药性,为此科学家又研制了一种新的青霉素—氨苄青霉素来代替青霉素。
下图是由青霉素制取氨苄青霉素的合成路线:
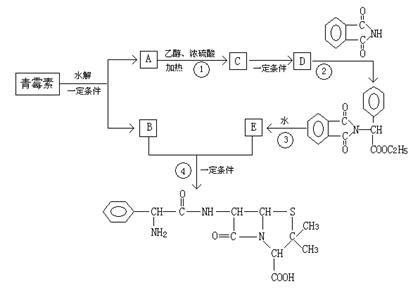
已知:有机物分子中和![]() 相连的碳原子称为α—碳原子,其上面连着的氢原子称为α—氢原子,在一定条件下,α—氢原子易被取代。请回答下列问题:
相连的碳原子称为α—碳原子,其上面连着的氢原子称为α—氢原子,在一定条件下,α—氢原子易被取代。请回答下列问题:
(1)从下列选项中,写出反应①②③④的反应类型:
① ②
③ ④
(2)写出D的结构简式
(3)写出反应①、③的化学方程式
①
③
六、(本小题包括2小题,共18分)
25、(8分)将等物质的量的氧化铝、氧化铁的混合物溶于100mL硫酸中,而后逐滴加入1.00mol/lNaOH溶液。当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加。当NaOH的体积V2=650mL时,沉淀量达到最大值,继续滴加NaOH时,沉淀量逐渐减小。当V3≥750mL时,沉淀量不再改变。
计算(1)所用硫酸的物质的量浓度。
(2)混合物中氧化铝的质量
26、(10分)将多磷酸钠溶液通过氢型阳离子交换柱,进行Na+与H+的交换,得到多磷酸,其结构为:
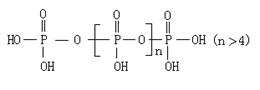
交换后的溶液用0.1 mol/L的NaOH溶液滴定。在消耗NaOH溶液42.0mL和50.00 mL时各有一个滴定终点。请回答:
(1)有两个滴定终点的原因是 。
(2)求结构中的n值。
高三化学试卷答案
答案
1、B 2、B 3、D 4、B 5、A 6、D 7、D 8、B
9、A 10、CD 11、C 12、D 13、AB 14、A 15、BD
16、C 17、A 18、 BC
19. (1)(5分)煤油 镊子,小刀,滤纸,玻璃片
(2)(2分)用干燥玻璃棒沾取溶液滴在PH试纸上,对照比色卡,读出PH值
(1分)目的是得到溶液中的H+的物质的量浓度
(1分)酸碱中和滴定实验,(1分)目的是溶液中的醋酸的物质的量浓度
20.(1)(1分)高锰酸钾 , (1分)浓盐酸
(2)(1分)饱和食盐水 , (1分)浓硫酸(3)(2分) 2Cl2 +2HgO=Cl2O ↑+ HgOHgCl
(4)(1分)液态空气, (1分)氯气
5)(2分)ABC间的连接可以用橡胶管,而DE间不行. (2分) 因为与有机物接触会爆炸
 21. (1)(2分) 氧, 氯 (2)(1分)极性分子
21. (1)(2分) 氧, 氯 (2)(1分)极性分子
(3)(4分)
①
 ②
②
![]() (4)(2分) NH4++H2O NH3H2O+H+
(4)(2分) NH4++H2O NH3H2O+H+
![]() (5)(2分) 2NH3 NH4++
NH2-
(5)(2分) 2NH3 NH4++
NH2-
![]() 22. (1)A.CO2 B.H2O
C.H2S ,甲O2,
丙H2 (2)略。(3)2 H2S+3
O2==2SO2+2 H2O
22. (1)A.CO2 B.H2O
C.H2S ,甲O2,
丙H2 (2)略。(3)2 H2S+3
O2==2SO2+2 H2O
(4)CO+ H2O(g) CO2+ H2 不移动,反应前后气体体积相同。
23 .
(1)(1分)C5H11NO2,(1分)结构简式为HOCH2CH2NHCOCH2CH3
(2)(4分)①③④⑤
(3)(2分)HOCH2CH2NHCOCH2CH3+ H2O→HOCH2CH2NH2+ CH3 CH2COOH
24. ① ②(1分) 取代(1分) 取代
 ③ (1分) 取代 ④(1分) 取代
③ (1分) 取代 ④(1分) 取代
(2)(2分)
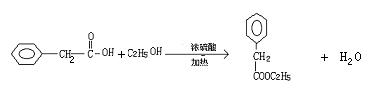 3)
3)
①(2分)
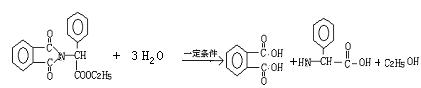
③ (2分)
25. (4分)硫酸的物质的量浓度3.25moL/L
(4分)氧化铝的质量5.1g
26. (1) (2分)有两个滴定终点的原因是从分子结构看,分子中含有两类不同的羟基,按电离顺序不同,出现2个滴定终点。
(2)求结构中的n值。
(4分)①1mol — 4mol ②1mol — n mol (4分)
x (50-42)×10-3×0.1=8×10-4 mol 2×10-4 4.2×10-3
x=2×10-4mol n=21