高考化学第一轮总复习试卷(一)
化学反应及其能量变化
第I卷 (选择题 共60分)
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.“摇摇冰”是一种即用即冷的饮料。吸食时将饮料罐隔离层中的化学物质和水混合后摇动即制冷。该化学物质是( )
A.氯化钠 B.生石灰 C.固体氢氧化钠 D.固体硝酸铵
2.人体血红蛋白中含有![]() 离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使
离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使![]() 离子转变成
离子转变成![]() 离子,生成高铁血红蛋白而丧失与
离子,生成高铁血红蛋白而丧失与![]() 结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A.酸性 B.碱性 C.氧化性 D.还原性
3.下列选项中说明乙醇作为燃料的优点的是( )
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境 ③乙醇是一种再生能源 ④燃烧时放出大量热量
A.①②③ B.①②④ C.①③④ D.②③④
4.最近,科学家用一种称为“超酸”的化合物![]() 反应,使
反应,使![]() 获得一个质子,得到一种新型离子化合物
获得一个质子,得到一种新型离子化合物![]() 。该反应看起来很陌生,其实在反应类型上可以跟中学化学里某个熟悉的化学反应相比拟。该化学反应是( )
。该反应看起来很陌生,其实在反应类型上可以跟中学化学里某个熟悉的化学反应相比拟。该化学反应是( )
A.![]()
B.![]()
C.![]()
D.![]()
5.R、X、Y和Z是四元素,其常见化合价均为+2价,且![]() 与单质R不反应:
与单质R不反应:![]() ;
;![]() 。这中种离子被还原成0价时表现的氧化性大小符合( )
。这中种离子被还原成0价时表现的氧化性大小符合( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
二选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分)
6.化学反应中的能量变化,通常表现为热量的变化,如![]() 的反应要吸收热量,在化学上叫做吸热反应。其原因是( )
的反应要吸收热量,在化学上叫做吸热反应。其原因是( )
A.反应物所具有的总能量高于生成物所具有的总能量
B.反应物所具有的总能量低于生成物所具有的总能量
C.在化学反应中需要加热的反应就是吸热反应
D.在化学反应中需要降温的反应就是放热反应
7.制造太阳能电池需要高纯度的硅。工业上由粗硅制高纯度硅可能过以下反应实现:
①![]() ②
②![]()
下列有关叙述错误的是( )
A.2个反应都是氧化还原反应 B.2个反应都是置换反应
C.反应①Si是还原剂 D.上述2个反应互为可逆反应
8.航天飞机用铝粉与高氯酸铵(![]() )的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:
)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:
![]() 。下列对此反应的叙述中错误的是( )
。下列对此反应的叙述中错误的是( )
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
9.下列反应的离子方程式正确的是( )
A.铝片跟氢氧化钠溶液反应:![]()
B.硫酸镁溶液跟氢氧化钡溶液反应:![]()
C.碳酸钙跟醋酸反应:![]()
D.铜片跟稀硝酸反应:![]()
10.a mol铜跟含b mol![]() 的硝酸溶液恰好完全反应,则被还原的
的硝酸溶液恰好完全反应,则被还原的![]() 的物质的量一定是( )
的物质的量一定是( )
A.(b-2a)mol B.b/4mol C.2a/3mol D.2amol
11.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
12.下列叙述中,正确的是( )
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素的化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
13.在硫酸铜溶液中加入碘化钾溶液,有白色沉淀物生成,溶液的颜色则由蓝色变为棕黄色,经分析证明白色沉淀是碘化亚铜。表示这个氧化还原反应的离子方程式是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
14.已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
![]()
如果分别用等物质的量的这些物质氧化足量的KI,得到![]() 最多的是( )
最多的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
15.下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 冰醋酸 | 福尔马林 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C | 单甘油酯 | 混甘油酯 | 苛性钾 | 氢硫酸 | 碳酸钙 |
| D | 重钙 | 普钙 | 氯化钠 | 次氯酸 | 氯气 |
第II卷(非选择题 共90分)
三、(本题包括2小题,共17分)
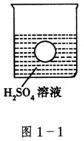
16.(7分)如图1-1所示,在一烧杯中盛有![]() 溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯里缓缓注入
溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯里缓缓注入![]() 溶液至恰好完全反应,试回答:
溶液至恰好完全反应,试回答:
(1)在此实验过程中,观察到的实验现象有:①__________________;②__________________。
(2)写出实验中反应的离子方程式__________________________________。
17.(10分)在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝,这是因为_________________,有关反应的离子方程式是______________________________。
在上述蓝色溶液中,滴加足量的![]() 溶液,蓝色逐渐消失,这是因为_________________,有关反应的离子方程式是______________________________。
溶液,蓝色逐渐消失,这是因为_________________,有关反应的离子方程式是______________________________。
从以上实验可知,![]() 的氧化性由强到弱的顺序是_________________。
的氧化性由强到弱的顺序是_________________。
四、(本题包括3小题,共30分)
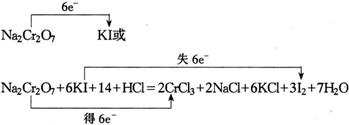
18.(11分)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可以不再向环境排放该种有害物质。例如:
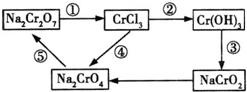
(1)在上述有编号的步骤中,需要还原剂的是_____________,需用氧化剂的是_____________。(填编号)
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是_____________(填化学式)。
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目;
![]() _____________
_____________
19.(10分)硼氢化钠(![]() )是一种离子化合物,具有很强的还原性,被称为“万能”还原剂。
)是一种离子化合物,具有很强的还原性,被称为“万能”还原剂。
(1)硼氢化钠中的阴离子是_____________(用化学符号表示),共中B、H两元素的化合价分别是_____________。
(2)已知将![]() 放入水中,可以生成偏硼酸钠和氢气,表示这个反应的离子方程式是_____________。
放入水中,可以生成偏硼酸钠和氢气,表示这个反应的离子方程式是_____________。
(3)![]() 可以从含
可以从含![]() 的碱性溶液中回收黄金,其离子方程式是_____________。
的碱性溶液中回收黄金,其离子方程式是_____________。
20.(9分)某主族元素R的单质可被稀硝酸氧化为![]() ,
,![]() 最外层有两个电子,在碱性条件下,
最外层有两个电子,在碱性条件下,![]() 可被
可被![]() 氧化成带一个单位负电荷的含氧酸根的阴离子,该阴离子在酸性条件下能将
氧化成带一个单位负电荷的含氧酸根的阴离子,该阴离子在酸性条件下能将![]() 氧化成
氧化成![]() ,同时本身又被还原为
,同时本身又被还原为![]() 。试写出有关反应的离子方程式(不必确定R为何元素):
。试写出有关反应的离子方程式(不必确定R为何元素):
(1)______________________________________;
(2)______________________________________;
(3)______________________________________。
五、(本题包括2小题,共25分)
21.(13分)把煤作为燃料可以通过下列两种途径:
途径I:![]()
途径II:先制水煤气:
![]() 再燃烧水煤气:
再燃烧水煤气:
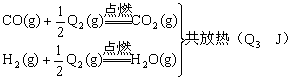
试回答下列问题:
(1)判断两种途径放热:途径I放出的热量______________(填“大于”、“等于”、“小于”)途径II放出的热量。
(2)![]() 的数学关系式是______________。
的数学关系式是______________。
(3)由于制取水煤气反应里,反应物所具有的总能量______________生成物所具有的总能量,那么在化学反应时,反应物应需要______________能量才能转化为生成物,因此其反应条件为______________。
(4)简述煤通过途径II作为燃料的意义。
_________________________________________________________________________
______________________________________________________________________________。
22.(12分)某河道两旁有甲乙两厂,它们排放的工业废水中,共含![]() 六种离子。
六种离子。
甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是______________、______________、______________。
乙厂的废水中含有另外三种离子。如果加一定量______________(选填:活性炭、硫酸亚铁、铁粉)可以回收其中的金属______________(填写金属元素符号)。另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的______________(填写离子符号)转化为沉淀。经过滤后的废水主要含______________,可用来浇灌农田。
六、(本题包括2小题,共18分)
23.(9分)三聚氰酸![]() 可用于消除汽车尾气中氮氧化物(如
可用于消除汽车尾气中氮氧化物(如![]() )。当加热至一定温度时,发生如下分解:
)。当加热至一定温度时,发生如下分解:![]() 异氰酸,其结构是H—N=C=O)能和
异氰酸,其结构是H—N=C=O)能和![]() 反应生成
反应生成![]() ,
,![]() 。
。
(1)写出HNCO和![]() 反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
(2)如按上述反应式进行反应,试计算吸收1.0kg![]() 气体所消耗的三聚氰酸的质量。
气体所消耗的三聚氰酸的质量。
24.(9分)(1)据了解,我国正在兴建的三峡工程将提供的水力发电功率相当于3000万千瓦的火力发电站。因此,三峡建设将有助于控制( )
A.温室效应 B.白色污染
C.城市污水的任意排放 D.长江中、下游的洪涝灾害
(2)已知1g炭粉(C)在氧气中完全燃烧放出热量32.8kJ(与1g原煤相当),试写出相关的热化学方程式:_____________________________。
(3)若以火力发电,要达3000万千瓦的功率,每年至少需耗原煤多少万吨?(每年按365天计,![]() )
)
参 考 答 案
1.D 固体硝酸铵溶解时吸热。
2.D 中毒是![]() 、解毒是将
、解毒是将![]() 。
。
3.D 燃烧都是氧化反应;乙醇可用淀粉制取,属再生能源。
4.C 实质是“获得一个质子,形成离子化合物”。
5.A ![]() 与R不反应说明氧化性
与R不反应说明氧化性![]() ,由
,由![]() 。
。![]() 可得氧化性
可得氧化性![]() ,
,![]() 。
。
6.B 化学反应的能量变化主要取决于反应物和生成物所具有的总能量的相对大小。而不论是放热反应还是吸热反应都需在一定的条件下才发生。
7.D 可逆反应是正、逆反应在相同条件下进行。
8.D ![]() 在反应中
在反应中![]() ,既是氧化剂也是还原剂。
,既是氧化剂也是还原剂。
9.C A项、D项电荷不守恒。B项还有![]() 沉淀生成。
沉淀生成。
10.A 反应后未被还原的![]() 以
以![]() 存在,因铜与硝酸恰好反应,则被还原的
存在,因铜与硝酸恰好反应,则被还原的![]() 为(b-2a)mol。
为(b-2a)mol。
11.A 注意“发生氧化还原反应”,![]() 即
即![]()
12.AD 此类题关键是找反例。如A项反例有![]() ;D项有
;D项有![]() 。
。
13.D 注意:CuI不溶于水应写化学式,且满足电荷守恒,得失电子守恒。
14.B 由电子得失![]() ;
;![]() ;
;![]() ;
;![]() 。得到的电子数越多,则氧化的KI越多。
。得到的电子数越多,则氧化的KI越多。
15.B A项中的盐酸为混合物,C项中的碳酸钙为电解质,D项中的氯气是单质,不属非电解质。
16.(1)①溶液里产生白色沉淀;②小球下沉至烧杯底部。
(2)![]()
17.![]() 被氧化为
被氧化为![]() ,
,![]() 遇淀粉变蓝色;
遇淀粉变蓝色;![]() ;
;![]() 被
被![]() 还原成
还原成![]() ;
;![]() ;
;![]()
18.(1)①;④ (2)![]() (3)1;6;14;2;2;6;3;7;
(3)1;6;14;2;2;6;3;7;![]()
19.(1)![]() ;+3;-1
;+3;-1
(2)![]()
(3)![]()
20.(1)![]()
(2)![]()
(3)![]()
21.(1)等于
(2)![]()
(3)低于;吸收;高温
(4)固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少![]() 和烟尘对大气造成的污染,而且燃烧效率高,也便于输送
和烟尘对大气造成的污染,而且燃烧效率高,也便于输送
22.![]() ;铁粉;Ag;
;铁粉;Ag;![]()
23.(1)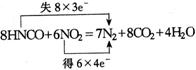 HNCO中N元素被氧化,
HNCO中N元素被氧化,![]() 中N元素被还原。
中N元素被还原。
(2)依据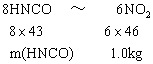
求得m(HNCO)=1.0kg×8×43/(6×46)=1.2kg
24.(1)AD
(2)![]() ;△H=-393.6kJ
;△H=-393.6kJ
(3)![]()
解之得 x=2884.4(万吨)