高考化学模拟试卷一
第I卷(选择题,共72分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Si 28 P 31 Cl 35.5 Na 23 K 39
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.为防“非典”,室内空气可用0.8%的过氧乙酸(C2H4O3)喷雾消毒。过氧乙酸不稳定,有刺激性很强的醋酸气味。则过氧乙酸的结构简式可能是 ( )

2.下列说法确有例证的是 ( )
①两种弱酸反应生成两种强酸;②某弱碱通过反应生成某强碱;③两种弱酸盐反应生成两种强酸盐;④有单质参与的反应不一定是氧化还原反应。
A.②④ B.①③ C.①②③ D.①②③④
3.下列合成溴化钾的方法中,最合理的是 ( )
A.KCl![]() KBr B.Br2
KBr B.Br2![]() FeBr3
FeBr3![]() KBr
KBr
C.Br2![]() KBr D.KOH
KBr D.KOH![]() KI
KI![]() KBr
KBr
4.下列点燃氢气的装置中既安全又正确的是(从右端尖嘴处点火,液体均为水)
( )
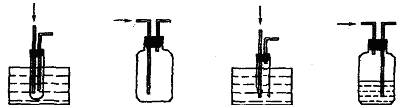
A B C D
5.某含结晶水的无色透明晶体,可能是明矾或草酸晶体,下列有诸位同学设计的鉴别实验方案,其中正确的组合是 ( )
①检验K+ ②检验Al3+ ③用胶体性质检验 ④用石蕊试液检验 ⑤用把加热分解产物通入石灰水中的方法检验 ⑥用碳酸钠溶液检验 ⑦用酸化的高锰酸钾溶液检验 ⑧用蓝黑墨水检验
A.全部正确 B.其中6个正确
 C.可用NaHCO3溶液鉴别 D. 其中5个正确
C.可用NaHCO3溶液鉴别 D. 其中5个正确
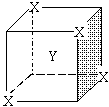
6.某离子晶体晶胞结构如右图所示,X位于立方体的顶点, Y位于立方体的中心,晶体中距离最近的两个X与一个Y形成的夹角记为∠XYX,下列物质共价键之间的夹角中有与∠XYX相同的是
( )
A. 干冰 B. 乙炔 C. 乙烯 D.甲烷
7.关于氢键,下列说法正确的是 ( )
A.每一个水分子内含有两个氢键
B.冰、水和水蒸气中都存在氢键
C.没有氢键就没有生命
D.H2O是一种非常稳定的化合物,这是由于氢键所致
8.在反应:Fe2(SO4)3+6KSCN![]() 2Fe(SCN)3+3K2SO4 达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是
( )
2Fe(SCN)3+3K2SO4 达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是
( )
A.KSCN B.K2SO4 C.NaOH D.FeCl3
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1 mol共价键(或其逆过程)时释放(或吸收)的能量。已知H—H键的键能为436 kJ/mol,Cl—Cl键的键能为243 kJ/mol,H—Cl键的键能为431 kJ/mol,则H2(g)+Cl2(g)=2HCl(g)的反应热(ΔH)等于 ( )
A. -183 kJ·mol—1 B. 183 kJ·mol—1
C. -862 kJ·mol—1 D. 862 kJ·mol—1
10.某无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是
( )
A.Cl-、Mg2+、NO3—、K+ B. HCO3—、K+、NO3—、SO42—
C.SO42—、Cl-、CO32—、Na+ D. NH4+、Cl-、Na+、Ba2+
11.下列说法正确的是 ( )
A.53.5gNH4Cl中含有H-Cl键的个数为4NA
B.12g石墨中含有C-C键的个数为4NA
C.12g金刚石中含有C-C键的个数为4NA
D.60gSiO2中含有Si-O键的个数为4NA
12.下列反应的离子方程式正确的是 ( )
A.氟气通入水中:2F2+2H2O=4F-+4H++O2
B.向小苏打溶液中加入过量的石灰水:
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C.硫氢化钠溶液与碘反应:HS-+I2=S+2I-+H+
D.FeBr2溶液与足量Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
13.已知化合物A
(C4Si4H8) 与立方烷(C8H8)的分子结构相似,如下图,则C4Si4H8的二氯代物的同分异构体数目为
( )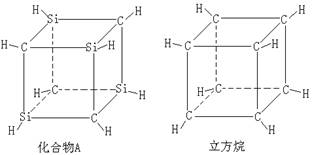
A.3 B.4 C.5 D.6
14.现有pH=a和pH=b的两种HCl溶液,已知b=a+2,将两种溶液等体积混和后,所得溶液的pH接近于 ( )
A. a-lg2 B. b-lg2 C. a+lg2 D. b+lg2
15.将羧酸的碱金属盐电解可生成烃类化合物,例如:
|
2CH3COOK+2H2O=====CH3—CH3↑+2CO2↑+H2↑+2KOH
![]()
|
( )
A.在阴极放出的气体是CO2
B.加热后有不溶于水的油状物生成
C.混合液蒸干后得到的固体是KOH
D.混合液蒸干后得到的固体是KCl
16.30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是 ( )
A.c(H+)·c(OH-)>1×10-14 B.c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S) D.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
17.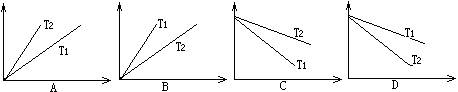 在一容积可调的密闭容器内使乙烯和活性炭接触,一部分乙烯被活性炭吸附,使压强减小,吸附总伴随着热的放出。在一定温度下,单位质量的活性炭中所吸附的乙烯的质量(用纵坐标表示)随压强的改变(用横坐标表示)所应有的关系正确的是(图中T1、T2表示温度,且T1>T2)
( )
在一容积可调的密闭容器内使乙烯和活性炭接触,一部分乙烯被活性炭吸附,使压强减小,吸附总伴随着热的放出。在一定温度下,单位质量的活性炭中所吸附的乙烯的质量(用纵坐标表示)随压强的改变(用横坐标表示)所应有的关系正确的是(图中T1、T2表示温度,且T1>T2)
( )
18.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,经测定Na2O2无剩余,则最后固体的物质的量为 ( )
A.1~2mol之间 B.1~4mol之间 C.2~4mol之间 D.大于4mol
第II卷(非选择题,共78分)
![]() 三、(本题包括2小题,共22分)
三、(本题包括2小题,共22分)
19.(9分)(1)右图是中学化学实验中的一种常用装置,若要在仅盛有少量水的水槽的条件下检查其气密性(不得使用任何导管、橡皮管,且不得拔下橡皮塞等),其操作方法和现象是________________________。
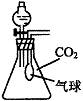 (2)在体积为250mL的锥形瓶内装有20mL H2O,同时收集满CO2气体,再加入一定量的金属钠后迅速塞紧瓶塞,其气球的变化有三种情况
(2)在体积为250mL的锥形瓶内装有20mL H2O,同时收集满CO2气体,再加入一定量的金属钠后迅速塞紧瓶塞,其气球的变化有三种情况
①当气球无变化时,锥形瓶中溶质为 ;
②当气球膨胀时,锥形瓶中溶质为 ;
③当气球瘪凹时,锥形瓶中溶质为 。
20.(13分)乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
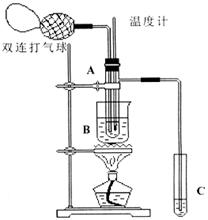
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;当试管A内的主要反应完成后温度计水银球的位置应在___________________,目的是_____________________________;
(3)烧杯B的作用是___________________________;烧杯B内盛装的液体可以是____________(写出一种即可);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。
该方案为___________________________________________________________。
四、(本题包括2小题,共18分)
21.(6分)已知下列几种烷烃的燃烧热如下:
| 烷 烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 燃烧热/(kJ·mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 |
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ。
(1)试写出乙烷气体燃烧的热化学方程式_______________;
(2)计算该天然气中甲烷的体积分数___________________;
(3)由上表可总结出的近似规律是_____________________。
22.(12分)A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,它们之间存在如下图的所示的转化关系。由此推断:
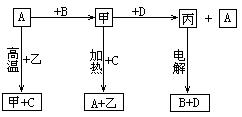
(1)元素A有可变化合价,则A单质的名称_________,甲的化学式为________,乙的电子式为_________。
(2)试判断A和C的还原性强弱(在通常条件下):A________C(填“大于”、“小于”)。
(3)写出甲和D反应的化学方程式_____________________________。
(4)写出D与烧碱溶液反应的离子方程式_______________________。
五、(本题包括2小题,共18分)
23.(8分)化合物CO、HCOOH、OHC-COOH分别燃烧时,消耗O2和生成的CO2的体积比都是1:2。后两者的分子式可以分别看成是(CO)(H2O)和(CO)2(H2O),也就是说只要分子式符合[(CO)m(H2O)n](m和n为正整数)的各种有机物,它们燃烧时消耗的O2和生成的CO2的体积比总是1︰2。现有一些含C、H、O三种元素的有机物,将它们在足量空气中燃烧,再将所得的混合气体(包括水蒸气)通过Na2O2层(反应完全),发现实际消耗O2的(燃烧消耗O2的体积减去气体通过Na2O2层后生成的体积)与生成CO2的体积之比为1︰4。
(1)在满足已知条件的有机物中,相对分子质量最小的化合物的分子式是 ;
(2)这些有机物满足的通式是 ;
(3)某两种碳原子数目相同的上述有机物,若它们的相对分子质量分别为a和b(a<b),则a和b满足的一般关系式是 。
24.(10分)已知R—CH=CH2+H2O![]() RCHOHCH3。现有含C、H、O的有机物A—F,相互之间的转化关系如下图所示:
RCHOHCH3。现有含C、H、O的有机物A—F,相互之间的转化关系如下图所示:
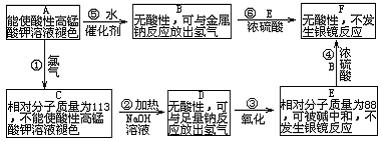
(1)化合物A→F相互转化的关系中属于取代反应的有_______(填反应序号);
(2)化合物A和F的结构简式为:A______,F________。
六、(本题包括2小题,共20分)
25.(8分)10℃时取100g水配制氯化钾的饱和溶液,又取50g水加入35.4g硝酸钠配成溶液,然后将两种溶液混合,发现有晶体析出。试通过计算指出晶体是什么物质? 已知10℃时几种物质的溶解度(g/100g水)为:
| NaNO3 | NaCl | KNO3 | KCl |
| 80 | 35.8 | 20.9 | 31 |
26.(12分)在NO2和O2的混合气体中,NO2所占的体积分数为x。用容积为50mL的容器盛满该混合气体并倒立于水中,足够长的时间后,容器内剩余VmL气体。
(1)试确定x的取值范围与剩余气体体积V的函数关系:V=f(x)。
(2)若最终剩余10mL气体,则原混合气体中NO2的体积分数是多少?
(3)若原50mL混合气体中含有少量N2(小于1mL),请判断在上述条件下,这些N2的存在对第(2)题的计算结果有无影响。
参考答案
一、(本题包括8小题,每小题4分,共32分)
1.A 2.D 3.B 4.C 5.C 6.D 7.C 8.B
二、(本题包括10小题)
9.A 10.AB 11.D 12.C 13.B 14.C 15.D 16.AD 17.A 18.B
三、(本题包括2小题,共22分)
19.(1)将装置倒置使A、B两管都浸入水中,两手紧贴烧瓶外壁,若导管口有气泡出现,把手移开,随后导管A、B中均形成一段水柱,说明装置不漏气。(3分)
(2)①Na2CO3(2分) ②Na2CO3与NaHCO3或NaHCO3 (2分)
③NaOH与Na2CO3(2分)
20.(1)![]() (2分)
(2分)
(2)试管A的反应液中(1分) 略低于试管A的支管口处(1分) 收集含乙酸的馏分(1分)
(3)使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C(3分) 乙二醇或甘油(只写一个)(2分)
(4)方法一:将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸。
方法二:把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成(答案合理均正确)。(3分)
四、(本题包括2小题,共18分)
21.(1)2C2H6(g)+7O2(g)![]() 4CO2(g)+6H2O(l);△H= —3119.6kJ/mol (2分)
4CO2(g)+6H2O(l);△H= —3119.6kJ/mol (2分)
(2)72% (2分)
(3)烷烃分子中每增加一个CH2,燃烧热平均增加660kJ/mol 左右 (2分)
22.(1)铁(1分) Fe3O4(1分)
![]() (2分) (2)大于(2分)
(2分) (2)大于(2分)
(3)3Fe3O4+8Al![]() 9Fe+4Al2O3 (3分)
9Fe+4Al2O3 (3分)
(4)2Al+2OH—+2H2O=2AlO2—+2H2↑ (3分)
五、(本题包括2小题,共18分)
23.(1)C2H2O (2分) (2)(C2O)mH2n(2分)
(3)b-a=2k(k为自然数)(4分)
24.(1)②④⑥ (4分)
(2)A:CH3CH=CH2(3分) F:CH3COCOOCH(CH3)2(3分)
六、(本题包括2小题,共20分)
25.(1)原来的硝酸钠溶液是不饱和溶液,混合后溶剂增加,硝酸钠更不饱和;原来氯化钾是饱和溶液,混合后也变为不饱和,因而硝酸钠、氯化钾不会成为晶体析出。
(2分)
(2)混合溶液中的4种离子,也可能结合成硝酸钾、氯化钠成为晶体析出。
NaNO3+ KCl== KNO3+ NaCl
85 74.5 101 58.5
x 31 y z
x=35.4(g) 恰好反应完全
y=42.0(g) (1分)
z=24.3(g) (1分)
(3)已知10℃时氯化钠的溶解度为35.8g,硝酸钾的溶解度为20.9g。150g水中最多溶解NaCl的质量为W,KNO3的质量为m
则100:150=35.8:w w=53.7(g) 53.7>24.3(不会有NaCl晶体析出)(2分)
100:150=20.9:m m=31.4(g)
31.4<42.0,可知析出晶体硝酸钾10.6g。 (2分)
26.混合气体在溶液中发生的反应可能有:①4NO2+O2+2H2O=4HNO3;②3NO2+H2O=2HNO3+NO。 (2分)
(1)若x≤80%,剩余气体可能为0或全部为O2,可认为只发生反应①,则有:V=50-(50x+50x/4)=50-62.5x (2分)
若x>80%,上述反应①和反应②均会发生,则有:
V=![]() {50-[(1-x)×50+(1-x)×50×4]}=
{50-[(1-x)×50+(1-x)×50×4]}=![]() (250x-200)
(2分)
(250x-200)
(2分)
(2)当x≤80%时,有:10=50-62.5x得x=64% (1分)
当x>80%时,有:10=![]() (250x-200)得x=92%
(1分)
(250x-200)得x=92%
(1分)
(3)假设混合气中有1mLN2,在x=64%时,![]() ,仍然是O2过量,故在题设条件下少量N2的存在对计算所得NO2的体积分数(64%)没有影响。
(2分)
,仍然是O2过量,故在题设条件下少量N2的存在对计算所得NO2的体积分数(64%)没有影响。
(2分)
若剩余的10mL气体是NO和N2,则其中只有9mLNO,故发生反应①后剩余NO2的体积应为27mL,反应①中消耗的NO2的体积=![]() 17.6mL。所以混合气体中NO2的实际体积分数=
17.6mL。所以混合气体中NO2的实际体积分数=![]() =89.2%<92%。即在题设条件下,少量N2的存在使计算所得NO2的体积分数偏小。
(2分)
=89.2%<92%。即在题设条件下,少量N2的存在使计算所得NO2的体积分数偏小。
(2分)
| 题号 | 难度 | 命题意图 | 学生的典型错误 |
| 1 | 0.8 | 须关注社会,关注身边的事 | 不能分析清楚过氧键的位置而错选C |
| 2 | 0.6 | 从隐性角度考查氧化还原反应的知识 | 学生储备知识不够(如HClO与H2SO3的反应及相应的盐发生氧化还原反应)而错选A |
| 3 | 0.7 | 结合所学知识分析化工生产的合理性 | 忽略Fe3+与CO32-发生双水解反应而错选D |
| 4 | 0.5 | 考查对实验装置的理解能力 | 不理解“防爆”原理而错选 |
| 5 | 0.7 | 对新教材草酸性质的考查 | 不了解草酸的性质而错选A、B、D |
| 6 | 0.5 | 空间想像能力的考查 | 对不同结构的正四面体空间构型(如P4、CH4)掌握不透而错选B |
| 7 | 0.4 | 能否正确理解物质结构中的分子间作用力 | 认为氢键是化学键而不是分子间作用力而错选B |
| 8 | 0.5 | 浓度对化学平衡移动的影响 | 没有从离子反应的角度去分析而错选A、C、D |
| 9 | 0.6 | 考查学生的自学能力,通过阅读理解键能与反应热的关系 | 不能得出“反应热等于拆开反应物分子需要吸收的能量与形成生成物分子所放出能量的代数和”的关系而错选 |
| 10 | 0.65 | 考查离子共存问题 | A中由于NO3-离子的存在,在酸性条件下不可能产生H2 |
| 11 | 0.5 | 阿伏加德罗常数的又一种考查方式 | 不了解常见晶体的结构而错选 |
| 12 | 0.65 | 离子方程式的书写 | 不熟悉元素化合物的知识而错选 |
| 13 | 0.6 | 同分异构体的书写 | 由于机械类比而错选A |
| 14 | 0.65 | pH的定量计算 | 没有掌握近似计算而错选 |
| 15 | 0.4 | 电化学与有机化学的结合 | 没有考虑卤代烃在碱性条件下水解而错选B、C |
| 16 | 0.65 | 离子浓度的大小比较 | 没有掌握水的离子积常数意义而漏选A |
| 17 | 0.65 | 化学平衡图像分析 | 没有把题给文字翻译成化学方程式而错选 |
| 18 | 0.5 | 过量问题计算 | 不能分析清楚CO2、H2O与Na2O2反应情况而错选 |
| 19 | (1)0.7 | 化学基本实验操作 | 学生的迁移能力不够 |
| (2)0.6 | 通过结论分析条件,考查学生的逆向思维能力 | ||
| 20 | 0.65 | 综合实验 | 实验的设计、评价是一个重点、难点,学生的得分普遍不高 |
| 21 | 0.6 | 考查学生的数据处理能力 | 不能从图表中提炼取有效信息,没有掌握燃烧热的概念 |
| 22 | 0.6 | 无机框图题的考查 | 没有重视常见物质的置换反应而找不到解题的突破口 |
| 23 | 0.7 | 以有机物的推断为载体,对学生收敛与发散思维能力的考查 | 部分学生由于被已知条件迷惑而进入死故同 |
| 24 | 0.65 | 有机物的推断与合成 | 本题得分率为0.448,区分度为0.693,与预期值相符 |
| 25 | 0.6 | 溶解度计算 | 不清楚易溶于水的盐的溶解平衡,故本题得分率不高 |
| 26 | 0.7 | 综合讨论型计算 | (1)(2)问与预期值相符,(3)问零分者众多,全卷分数高的考生本题也得分高 |