高考化学试测题3
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题),共青团20分。试测时间100分钟。
可能用到的数据:H 1 C 12 N 14 O 16 Na 23 Mg 24 Cl 35.5 Zn 65
第 Ⅰ 卷
(共两大题,16小题,54分)
注意:本卷的答案必须全部填写在“答题卷”中,(“答题卷”)在试卷最后。
一、选择题(每小题3分,共30分。每小题有一个或两个选项符合题意。若正确答案只是一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个正确的给1分,选两正确的给3分,但只要选错1个,该小题就为0人分)
1、某无色透明溶液,在滴加甲基橙后呈红色。在该溶液中能够大量共存的离子组是
A、K+ Na+ MnO4- NO3- B、NH4+ Mg2+ K+ SO42-
C、Ca2+ Ba+ NO3- Cl- D、Ba2+ Zn2+ CH3COO- Cl-
2、将pH=11的NaOH溶液和Ph=3的醋酸溶液以等体积混合后,所得溶液中[Na+]和[CH3COO-]的正确关系是
A、 [Na+]>[CH3COO-] B、 [Na+]=[CH3COO-] C、 [Na+]<[CH3COO-] D、 不能确定
3、已知:aM2++bO2+4H+=cM3++dH2O,则系数c的值是
A、 1 B、 2 C、 3 D、 4
4、要除去CO2气体中所含的少量HCl气体,最好的方法是将混合气通过
A、 NaHCO3溶液 B、 Na2CO3溶液 C、 饱和石灰水 D、 氨水
5、 根据反应(1)~(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是
⑴Cl2+2KI=2KCl+I2 ⑵2FeCl2+Cl2=2FeCl3 ⑶2FeCl3+2HI=2FeCl2+2HCl+I2 ⑷H2S+I2=S+2HI
A、 H2S>I2>Fe3+>Cl2 B、Cl2> Fe3+ > I2 > H2S
C、 Fe3+ > Cl2 > H2S > I2 D、Cl2>I2>Fe3+> H2S
6、 相同物质的量浓度的下列物质(1)~(4)的溶液,其pH值从大到小的正确顺序是
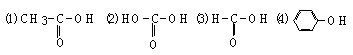 |
A、 ⑵>⑷>⑶>⑴ B、 ⑶>⑴>⑵>⑷ C、 ⑷>⑵>⑴>⑶ D、 ⑷>⑶>⑵>⑴
7、 已知:4NH3+5O2=4NO+6H2O,若反应速度分别用![]() 、
、![]() 、
、![]() 、
、![]() (mol/L·min)表示,则正确的关系是
(mol/L·min)表示,则正确的关系是
A、4/5![]() =
=![]() B、5/6
B、5/6![]() =
=![]() C、3/2
C、3/2![]() =
=![]() D、4/5
D、4/5![]() =
=![]()
8、 把1LpH=3的醋酸溶液加水稀释至10L后,下列叙述中正确是
A、电离度增大 B、[H+]增长 C、 [OH-]增长 D、 [CH3COO-]增大
9、 为了使Na2S溶液中[Na+]/[S2-]的比值变小,可加入的物质是
A、适量盐酸 B、适量NaOH溶液 C、适量KOH溶液 D、适量KHS溶液
10、某单质X能从盐的溶液中置换出单质Y,由此可知
A、当X、Y都是金属时,X一定比Y活泼
B、当X、Y都是非金属时,Y一定比X活泼
C、当X是金属时,Y可能是金属,也可能是非金属
D、当X是非金属时,Y可能是金属,也可能是非金属
二、选择题(每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只是一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个正确的给2分,选两个正确的给4分,但只要选错1个,该小题就为0分)。
11、某温度时,化合物甲的饱和溶液mg中含有溶质ag,化合物乙的饱和溶液mg中含有溶质bg。则在此温度时,甲、乙两化合物的溶解度之比是
A、 ![]() B、
B、
![]() C、
C、
![]() D、
D、 ![]()
12、用以下三种途径来制取相等质量的硝酸铜:铜跟浓硝酸反应;铜跟稀硝酸反应;铜先跟氧气反应生成氧化铜,氧化铜再跟硝酸反应。 以下叙述正确的是
A、三种途径所消耗的铜的物质的量相等
B、三种途径所消耗的硝酸的物质的量相等
C、所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2)
D、所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
13、由(NH4)2SO4和MgSO4组成的混合物共192g,溶于水中配成10L溶液。测得此溶液中[SO42-]为0.15mol/l,则原混合物中NH4+离子的物质的量是
A、 0.1mol B、 0.5mol C、 1mol D、 2mol
14、一真空密闭容器中盛有1molPCl5,加热到200℃时,发生如下反应 PCl5(g)≒PCl3(g)+Cl2(g)反应达到平衡时,PCl5所占体积百分比为M%。若在同一温度和同一容器中,最初投入的是2molPCl5,反应平衡时PCl5所占体积百分比为N%。则M和N的正确关系是
A、 M>N B、 N>M C、 M=N D、 无法比较
15、某温度时,把1mol/LN2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。则下列说法正确的是
A、 前4s中以N2O4的浓度变化表示的平均反应速度为0.01mol/L·s
B、 在4s时容器内的压强为开始时的1.2倍
C、 在平衡时容器内含N2O40.4mol
D、 在平衡时容器内含NO21.6mol
16、某金属元素最高价氟化物的分子量为M1,其最高价的硫酸盐的分子量为M2。若此元素的最高正价为n,则n与M1、M2的关系可能是
A、n=![]() B、n=
B、n=![]() C、n=
C、n=![]() D、n=
D、n=![]()
第 Ⅱ 卷
(共四大题,8小题,共66分)
三、(本大题共两小题,共15分)
17、(4分)先选择填空,再简要说明作此选择的理由。
⑴某试管内装有约占其容积1/10的溶液,则溶液的体积是(用字母回答) 。
A 约1mL B 约3mL C 无法判断 因为
⑵拟在烧杯中于加热条件下配制某溶液,应选择的烧杯是(用字母回答) 。
A 400mL烧杯 B 250mL烧杯 C 100mL烧杯 D 50mL烧杯
因为 。
18、(12分)已知乙醇可以和氯化钙反应生成微溶于水的CaCl2·6C2H5OH。有关的有机试剂的沸点如下:CH3COOC2H5 77.1℃ C2H5OC2H5(乙醚) 34.5℃ C2H5OH 78.3℃ CH3COOH 118℃ 实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇与少量浓硫酸混合,然后经分液漏斗边滴加醋、边加热蒸馏。得到含有乙醇、乙醚、醋酸和水的乙酸乙酯粗产品。
⑴反应中加入乙醇是过量的,其目的是: 。
⑵边滴加醋酸、边加热蒸馏的目的是: 。
将粗产品再经下列步骤精制:
⑶为除运河其中的醋酸,可向产品中加入(填字母)。A 无水乙醇 B 碳酸钠粉末 C 无水醋酸钠
⑷再向其中加入饱和氯化钙溶液,振荡。其目的是: 。
⑸然后再向其中加入无水硫酸钠,振荡。其目的是: 。
最后,将经过上述处理后的液体放入另一干燥的蒸馏瓶内,再蒸馏。弃去低沸点馏分,收集76~78℃沸程之间的馏分即得。
四、(本大题共17分)
19、(17分)用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。Na2S2O3在酸性溶液中立即完全分解:Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl
15.1gNa2SO3现取溶于80.0mL水。另取5.00g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中。用小火加热至微沸,反应约1h后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O晶体。
⑴若加入的硫粉不用乙醇润湿,对反应的影响是 。(填写选项的字母,可以多选,但选错要倒扣。)
A 会降低反应速率 B需要提高反应温度 C将增大反应体系的pH值 D会减少产量
⑵反应1h后过滤,其目的是 。
⑶滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。它是由 而产生的。如果滤液中该杂质的含量不很低,其检测的方法是: 。
⑷设Na2SO3跟硫粉完全反应,当交将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明。(70℃时,Na2S2O3饱和溶液的密度为1.17g/cm3)
⑸若要计算在100℃下将溶液蒸发至体积为30.0mL,再冷却至10℃时所能得到的Na2SO3·5H2O的质量,你认为 。(填写一个选项的字母)
A 前面提供的数据已经足够。 B还需要提供100℃时溶液的密度(1.14g/cm3)。 C还需要提供结晶后剩余溶液的体积(10.0mL)。
⑹根据第(5)小题你的选择(如选(A)则直接计算,如选(B)或(C)则可选用其数据),计算从10℃、30.0mL溶液中结晶而出的Na2S2O3·5H2O的质量。
五、(本大题共3小题,共17分)
20、(6分)吗啡和海洛因都是严格查禁的毒品。吗啡分子含C 71.58%、H 6.67%、N 4.91%、其余为O。已知其分子量不超过300。试求:⑴吗啡的分子量;⑵吗啡的分子式。
已知海洛因是吗啡的二乙酸酯。试求:⑴海洛因的分子量;⑵海洛因的分子式。
答:吗啡的分子量是 、分子式是 。
海洛因的分子量是 ,分子式是 。
21、(6分)A是一种可以作为药物的有机化合物。请从下列反应图式中各有机化合物的关系(所有无机产物无已略去未写),推测有机化合物A、B、C、E、F的结构简式。(Ф代表苯基)
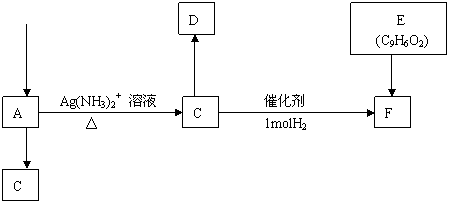 ФCHO
NaOH,乙醇溶液
ФCHO
NaOH,乙醇溶液
![]() CH3CHO
CH3CHO
NaOH溶液,△,去水 Br2—CCl4溶液
2molH2 催化剂
2molH2,
催化剂
答:A是 ;B是 ;C是 ;E是 ;F是 。
22、(5分)某碳氢化合物A。是无色晶体,熔点为130~131℃。结构分析证实,在A的分子中:⑴有8个碳原子;⑵每个碳原子都以3个键长相等的单键分别跟其它3个碳原子相连。⑶只有一种碳—碳—碳—键角。请⑴写出化合物A的分子式;⑵判断分子中有没有烯键;⑶写出分子A的结构式(只要求写出碳的骨架,不需要写出C、H的元素符号)。
答:A的分子式是 ,分子中 烯键(填有或没有)。
A的结构式是:
六、(本大题2小题,共17分)
23、(8分)已知,向Zn2+离子溶液中滴加氨水,生成Zn(OH)2白色沉淀;但是氨水过量时,沉淀又溶解,生成了Zn(NH3)42+。此外,Zn(OH)2既可溶于盐酸,也可溶于过量NaOH溶液中,生成ZnO22-,所以Zn(OH)2是一种两性氢氧化物。
现有4组离子,每组有2种金属离子。请各选用1种试剂,将它们两者分开。可供选用的试剂有:A 硫酸 B 盐酸 C 硝酸 D 氢氧化钠溶液 E 氨水(填写时用字母代号)
请填写下表:
| 离子组 | 选用的试剂(代号) | 沉淀物的化学式 | 保留在溶液中的离子 |
| ⑴Zn2+和Al3+ | |||
| ⑵Zn2+和Mg2+ | |||
| ⑶Zn2+和Ba2+ | |||
| ⑷Fe3+和Al3+ |
24、(9分)在一个固定体积的密闭容器中,保持一定温度,进行以下反应:
H2(g)+Br2(g)≒2HBr(g)
已知加入1molH2和2molBr2时,达到平衡后生成amolHBr(见下表“已知”项)。在相同条件下,且保持平衡时各组分的摩尔分数不变,对下列编号(1)~(3)的状态,填写表中的空白:
| 编号 | 起始状态(mol) | 平衡时HBr物质的量 (mol) | ||
| H2 | Br2 | HBr | ||
| 已知 | 1 | 2 | 0 | a |
| ⑴ | 2 | 4 | 0 | |
| ⑵ | 1 | 0.5a | ||
| ⑶ | m | N(n≥2m) | ||
参考答案:
第Ⅰ卷
一、(每小题3分,共30分)
1 B C 2 C 3 D 4 A 5 B 6 C 7 C D 8 A C 9 C D 10 A C
二、(每小题4分,共24分)
11 D 12 A D 13 D 14 B 15 B D 16 A B
第Ⅱ卷
三、(两小题,共15分)
17、(1)(C)。题目并没有指明试管的大小规格(mL)(每空1分,共2分)
(2)(C)。选用烧杯的容积应比所配溶液的体积大一倍为最佳选择。(每空1分,共2分)
18、⑴增加一种反应物,有利于酯化反应向正方向进行 (3分)
⑵蒸出生成物,有利于酯化反应向正方向进行 (3分)
⑶(B) (1分)
⑷除去粗产品中的乙醇 (2分)
⑸除去粗产品中的水 (2分)
四、(本大题共17分)
19、⑴ A、D(各1分,共2分)
⑵除去过量的硫粉 (1分)
⑶Na2SO4、由Na2SO3被空气氧化,(每空1分)取出少许溶液,加稀盐酸至酸性后,过滤除去S,再加BaCl2溶液 (2分)
⑷若反应得到的Na2S2O3在70℃时配成饱和溶液,其体积为x,则
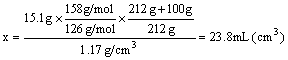
而23.8mL<30mL,所以蒸发后的溶液尚未达到饱和 (3分)
或:[解法2]
若该溶液是饱和溶液,其所含的Na2S2O3的质量为x,则
![]() (1分)
(1分)
而按题意,完全反应得到的Na2S2O3的质量为:
![]()
所以溶液尚未达到饱和。 (2分)
⑸ B(1分)
⑹溶液中水的质量![]() (2分)
(2分)
设析出的Na2S2O3·5H2O的质量为x,
则列式  (列式3分)
(列式3分)
解之 x=23.2g (1分)
五、(本大题共3小题,共17分)
20、吗啡分子量285,分子式C17H19NO3(前空1分,后空2分,共3分)
海洛因分子量369,分子式C21H23NO5(前空1分,后空2分,共3分)
21、A是ΦCH=CHCHO,B是ΦCH2CH2CH2OH,C是ΦCH=CHCOOH,
E是ΦC≡CCOOH,F是ΦCH2CH2COOH。(A2分,其余各空各1分,共6分)
22、⑴C8H8 (1分) ⑵ 没有 (1分)
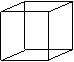 |
⑶ (3分)(本题共5分)
六、(本大题共2小题,共17分)
23、⑴ E,Al(OH)3,Zn(NH3)42+
⑵ D,Mg(OH)2,ZnO22-
⑶ A BaSO4,Zn2+
⑷ D,Fe(OH)3,AlO2- 每组全对给2分,共8分)
24、⑴ 2a (1分)
⑵ 0, 0.5(各1分)
⑶ 2(n-2m) ,(n-m)a(各3分) (本题共9分)