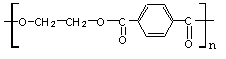高考化学试测题9
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,共124分,考试 时间100分钟。可能用到的原子量H 1 C 12 O 16 Na 23 Mg 24 Al 27 K 39
第I卷(共两大题,12小题,共48分)
一、选择题(本题包括6小题,每小题只有一个选项符合题意)
1.在短周期元素中,原子最外电子层只有1个或2个电子的元素是 ( )
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
2.某元素最高价氧化物对应的水化物的分子式是H4RO4,则其气态氢化物的分子式是( )
A.RH4 B.RH3 C.H2R D.HR
3.将1mol·L-1H2SO4溶液100mL与质量分数为10%的NaOH溶液50g混合均匀后,滴入甲基橙指示剂,此时溶液的颜色是 ( )
A.浅紫色 B.黄色 C.红色 D.无色
4.已知硼化物BxHyz-与B10C2H12的电子总数相同,则BxHyz-的正确表达式为 ( )
A.B9H152- B.B10H142- C.B11H132- D.B12H122-
5.为了除去苯中混有的少量苯酚,下面的实验正确的是 ( )
A.在分液漏斗中,加入足量2mol·L-1NaOH溶液,充分振荡后,分液分离
B.在分液漏斗中,加入足量2mol·L-1FeCl3溶液,充分振荡后,分液分离
C.在烧杯中,加入足量的浓溴水,充分搅拌后,过滤分离
D.在烧杯中,加入足量冷水,充分搅拌后,过滤分离
6.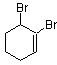 的系统命名的名称是 ( )
的系统命名的名称是 ( )
A.1,2-二溴-2-环己烯 B.1,2-二溴-1-环己烯
C.1,6-二溴-1-环己烯 D.2,3-二溴-1-环己烯
二、选择题(本题包括6小题,每小题4分,共24分,每小选两个题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分。若正确答案包括两个选项,只选一个,且正确的,给2分,选两个且都正确的,给4分,但只要选错一个,该小题就为0分)
7.下列物质混合后,有气体生成,最终又有沉淀或固体的是 ( )
A.过量氢氧化钠溶液和明矾溶液 B.少量电石和过量碳酸氢钠溶液
C.过氧化钠和少量氧化亚铁溶液 D.铜片和三氯化铁溶液
8.下列关于![]() 、
、![]() 、
、![]() 的说法正确的是 ( )
的说法正确的是 ( )
A.它们的化学性质相同 B.它们是碳元素的三种同位素
C.它们是碳元素的三种单质 D.它们是碳元素的同素异形体
9.由短周期元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,则下列说法正确的是 ( )
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数相等
C.A是第2周期第IIIA族的元素 D.B是第3周期IVA族的元素
10.设NA为阿伏加德罗常数,如果ag某气态双原子分子的分子数为P,则bg该气体在标准状况下的体积V(L)是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
11.一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是 ( )
2NH3(g)达到化学平衡状态的标志是 ( )
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.N2,H2和NH3的物质分数不再改变
C.N2与H2的物质的量之和是NH3的物质的量2倍
D.单位时间里每增加1molN2,同时增加3molH2
12.在天平的左右两边各放一个烧杯,加入足量盐酸并使天平保持平衡,向左边烧杯中加入 14.4gMg,向右边烧杯中加入14.4gAl,此时天平不再平衡,下述操作可使天平恢复平衡的是 ( )
A.右边加0.45gAl B.左边加0.98gMg
C.左边加入14.4gMg,向右边加15.3gAl D.左边加14.4gMg,右边加14.85gAl
第II卷(共四大题,9小题,共76分)
三、(本大题共2小题,共19分)
13.(4分)在中学实验中学过的可用于分离或提纯物质的方法很多,如重结晶、过滤、盐析……,请将分离或提纯下列各混合物最适宜的方法的名称填入括号内
①除去生石灰中混有的石灰石 ( )
②除去碘中混有的碘化钠固体 ( )
③除去乙醇中溶解少量的食盐 ( )
④除去氢氧化铁胶体中混有的氯离子 ( )
14.(15分)一支干燥的小试管中,装有少量白色物质(约占试管容积的![]() ),已知该白色物质是碳酸氢铵、碳酸氢钠、碳酸钠、和氯化钠中的一种,现通过加热试管中的固体,只用蒸馏水、石蕊试纸或pH试纸进行鉴定。
),已知该白色物质是碳酸氢铵、碳酸氢钠、碳酸钠、和氯化钠中的一种,现通过加热试管中的固体,只用蒸馏水、石蕊试纸或pH试纸进行鉴定。
(1)按照顺序写出主要步骤及操作要点(使用酒精灯和试管的方法不必叙述,其它要点说清楚)
(2)填写下表:
| 白色物质 | 判断依据 | 有关化学方程式(或离子方程式) |
| 碳酸氢铵 | ||
| 碳酸氢钠 | ||
| 碳酸钠 | ||
| 氯化钠 |
四、(本大题共3小题,共21分)
 15.(8分)某温度(t℃)时,水的KW=10-13,则该温度(填大于、小于或等于) 25℃,其理由是 。将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,
15.(8分)某温度(t℃)时,水的KW=10-13,则该温度(填大于、小于或等于) 25℃,其理由是 。将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,
(1)若所得混合液为中性,则a∶b ;
(2)若所得混合液的pH=2,则a∶b ;
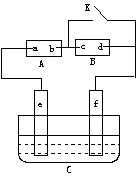
16.(7分)如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为______________极
(2)滤纸B上发生的总化学方程式为:________________________________
(3)欲在电镀槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极e上发生的反应为:___________________________________,电极f上发生的反应为:_____________________,槽中盛放的镀液可以是_________________或_________________(只要求填两种电解质溶液)。
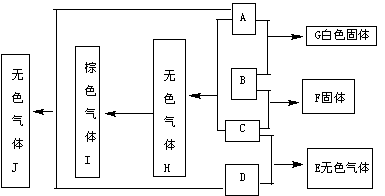 17.(6分)下图中每一个方框内的字母代表一种物质,常温常压下,A、B、C、D、均为单质,且B为金属,其它三个为双原子分子的气体,它们在一定条件下,发生图中所示的化合反应,得到化合物E、F、G、H、I和J,这些化合物在常温常压下的状态及颜色已在图中注明,
有关反应的化学计量数为:
17.(6分)下图中每一个方框内的字母代表一种物质,常温常压下,A、B、C、D、均为单质,且B为金属,其它三个为双原子分子的气体,它们在一定条件下,发生图中所示的化合反应,得到化合物E、F、G、H、I和J,这些化合物在常温常压下的状态及颜色已在图中注明,
有关反应的化学计量数为:
(1)A与B按物质的量之比n(A)∶n(B)=1∶2完全反应生成G
(2)B与C按物质的量之比n(B)∶n(C)=3∶1完全反应生成F
(3)C与D按物质的量之比n(C)∶n(D)=1∶3完全反应生成E
请填空:
(1)物质B是 ,物质D是
(2)B与C反应生成F的化学方程式为:
(3)A与H反应生成I的化学方程式为: 。
18.(8分)已知四种丁醇在催化剂存在下跟空气反应的情况如下:
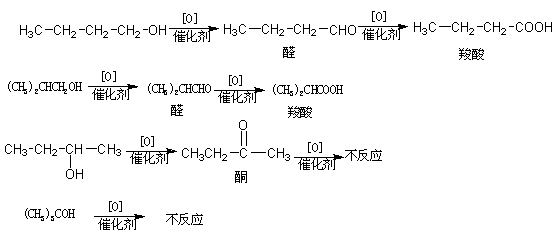 (1)各种戊醇在这样条件下,可能得到多少种酮,请写出其结构简式 。
(1)各种戊醇在这样条件下,可能得到多少种酮,请写出其结构简式 。
(2)各种戊醇在这样条件下,可能得到多少种醛,请写出其结构简式 。
(3)始终不反应的戊醇的结构简式是 。
19.请将下列高分子材料合成的单体的结构简填入下表(有的项可能不止一个原料)
| 编号 | 名称 | 结构简式 | 单体 |
| 例 | 涤纶 (的确良) |
|
|
| 1 | 异戊橡胶 |
| |
| 2 | 锦纶 (尼龙6) |
| |
| 3 | ABS树脂 |
|
六、(本题共2小题,共20分)
20.(10分)现有等物质的量的NaHCO3和KHCO3的混合物ag与100mL盐酸反应。题中涉及的气体体积以标准状况计,填空时可以用带字母的分式表示。
(1)该混合物中NaHCO3和KHCO3的质量比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的浓度为 mol·L-1
(3)如盐酸过量,生成CO2体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需知道
。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则ag固体混合物与足量的盐酸完全反应时生成CO2的体积(V)范围是 。
21.1mol丁烷(气)与不足量的氧气共贮于一固定容器中,压强为p,点火燃烧后,回到室温,得到水若干(其体积可不计)和CO2和CO两种气体,总压强降为0.557p,试求:
(1)生成的水的质量;
(2)反应前氧气的物质的量;
(3)反应后气体中CO2和CO的物质的量;
参考答案
一、(每小题4分,共24分)
1.D 2.A 3.C 4.D 5.A 6.C
二、(每小题4分,共24分)
7.B C 8.A B 9.B D 10.D 11.B 12.A C
三、(2小题,共19分)
13.①加热分解 ②升华 ③蒸馏 ④渗析 (每空1分,共4分)
14.(1)①先将小块蓝色石蕊试纸用蒸馏水润湿后粘在玻璃棒的一端;均匀加热试管,再将火焰固定在放固体部分加热,同时通过玻璃棒将试纸对准试管口附近。(1分)
②如果加热固体不分解,且蓝色试纸不变色(进一步证明固体没有分解),待试管冷却至室温后,向其中加入适量蒸馏水,振荡试管,待固体溶解后,把小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒沾取试管中的溶液沾在试纸的中部,检验溶液的酸碱性。(2分)
(2)
| 白色物质 | 判断依据 | 有关化学方程式 (或离子方程式) |
| 碳酸氢铵 | 固体全部分解,试管中没有残留固体 | NH4HCO3 |
| 碳酸氢钠 | 固体全部分解,蓝色石蕊试纸变红 | 2NaHCO3 CO2+H2O (或CO2+H2O |
| 碳酸钠 | 固体不分解,蓝色石蕊试纸不变色;加不后得到无色透明溶液,pH试纸变篮色。 |
|
| 氯化钠 | 固体不分解,蓝色石蕊试纸不变色;加不后得到无色透明溶液,pH试纸不变色。 | NaCl |
(种物质判断依据和方程式全正确给3分,共12分)
四、(3小题,共21分)
15.大于(2分) 水的离解反应:H2O![]() H++OH-是吸热反应,升温有利于水的离解,使KW增大(2分)
H++OH-是吸热反应,升温有利于水的离解,使KW增大(2分)
(1)10∶1(2分)
(2)9∶2(2分)
16.(1)正(2分)
(2)2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH(2分)
H2↑+Cl2↑+2NaOH(2分)
(3)Zn—2e=Zn2+ , Zn2++2e=Zn,ZnSO4溶液或ZnCl2溶液 (3分)
17.(1)Mg(镁),H2(氢) (每空1分,共2分)
(2)3Mg+N2![]() Mg3N2(2分)
Mg3N2(2分)
(3)O2+2NO![]() 2NO2 (2分)
2NO2 (2分)
五、(2小题,共16分)
18.(1)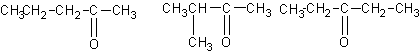
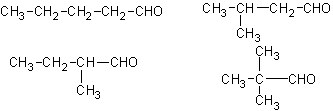
(2)
(3)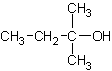 (每式1分,共8分)
(每式1分,共8分)
19.1. 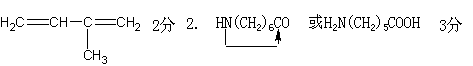
3.![]()
六、(2小题,共20分)
20.(10分)(1)84∶100(2分)
(2)![]() (2分)
(2分)
(3)![]() 或
或![]() (2分)
(2分)
(4)盐酸的物质的量浓度(2分)
(5)![]() (2分)
(2分)
21.(10分)(1)根据C4H10→5H2O,可知1mol C4H10生成5mol水,即90g。
(2)反应后和反应前的压强之笔极为气体的物质的量之比,设反应消耗氧气的物质的量为y,则![]() ,y=6.18mol。
,y=6.18mol。
(3)燃耗后气体物质的量减少:1+6.18-4=3.18mol,设生成CO2的丁烷为amol,生成CO的丁烷为(1-a)mol,则有:
C4H10+6.5O2→4CO2+5H2O Δn
1 6.5 4 3.5
a 3.5a
C4H10+4.5O2→4CO+5H2O Δn
1 4.5 4 1.5
1-a 1.5(1-a)
由题意:3.5a +1.5(1-a)=3.18 解得:a=0.84mol
即丁烷有84%转化为CO2,16%转化为CO,它们的物质的量分别为:n(CO2)=4×84%=3.36mol,n(CO)=4×16%=0.84mol。