高考化学专题复习试卷化学实验方案的设计
第Ⅰ卷 (选择题 共60分)
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.下列气体不能用浓![]() 干燥的是(
)
干燥的是(
)
A.![]() B.
B.![]() C.
C.![]() D.HC1
D.HC1
2.为了除去蛋白质溶液中混入的少量氯化钠,可以采用的方法是( )
A.过滤 B.电泳
C.渗析
D.加入![]() 溶液过滤
溶液过滤
3.下列仪器:①集气瓶、②量筒、③烧杯、④表面皿、⑤蒸发皿、⑥容量瓶、⑦烧瓶,能用酒精灯加热的是( )
A.②③⑤ B.③⑥⑦ C.①③④ D.③⑤⑦
4.下列溶液中,在空气中既不易被氧化,也不易分解,且可以用无色玻璃试剂瓶存放的是( )
A.石炭酸 B.氢硫酸 C.氢氟酸 D.醋酸
5.图19-1装置可用于( )
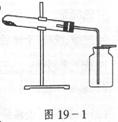
A.加热无水醋酸钠和碱石灰的混合物,制取甲烷。
B.加热氯酸钾和少量二氧化锰的混合物,制取氧气。
C.加热二氧化锰和浓盐酸的混合物,制取氯气。
D.加热氯化铵和消石灰的混合物,制取氨气。
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只要选错一个,该小题就为0分)
6.下列事故处理不正确的是( )
A.金属钠失火可用泡沫灭火器灭火。
B.酒精灯不慎碰翻着火,可用湿抹布盖灭。
C.不慎将浓硫酸沾在皮肤上,立即用水冲洗。
D.苯酚沾在手上,应立即用酒精冲洗。
7.对下列事实的解释正确的是( )
A.浓硝酸的光照下变黄,说明浓硝酸不稳定,且产物有红棕色气体可溶于浓硝酸。
B.向某溶液中加入氯化钡溶液和稀硝酸,有白色沉淀生成,说明该溶液中一定含有![]() 。
。
C.常温下,将铜放入浓硫酸中无明显变化,说明铜在冷、浓硫酸中钝化。
D.氯气使湿润的碘化钾淀粉试纸变蓝,说明氯气与淀粉反应。
8.某溶液含有较多的![]() 和少量的
和少量的![]() ,若用该溶液制取芒硝,可供选择的操作有:①加适量
,若用该溶液制取芒硝,可供选择的操作有:①加适量![]() 溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤。正确的操作步骤是( )
溶液,②加金属Na,③结晶,④加过量NaOH溶液,⑤加强热脱结晶水,⑥过滤。正确的操作步骤是( )
A.②⑥③ B.④⑥①③ C.④⑥③② D.②⑥①③⑤
9.下列各组物质中不易用物理性质区别的是( )
A.苯和四氯化碳 B.酒精和汽油
C.氯化铵和硝酸铵晶体 D.碘和高锰酸钾固体
10.只用胶头滴管和试管,不用其他试剂就可以区别的下列溶液(浓度均为![]() )是(
)
)是(
)
A.![]() 和
和![]() B.稀
B.稀![]() 和
和![]()
C.![]() 和
和![]() D.
D.![]() 和盐酸
和盐酸
11.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸。
B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液。
C.滴定时,没有逐出滴定管下口的气泡。
D.读数时,视线与滴定管内液体凹液面最低处保持水平。
12.实验室制取下列气体时,尾气的处理不正确的是( )
A.制![]() 时,可用NaOH溶液吸收
B.制
时,可用NaOH溶液吸收
B.制![]() 时,可用水吸收
时,可用水吸收
C.制CO时,可用点燃方法
D.制![]() 时,可用浓
时,可用浓![]() 吸收
吸收
13.有两瓶pH为3的酸溶液,一瓶是强酸,一瓶是弱酸,可用来鉴别其中的哪一瓶是弱酸的一组试剂是( )
A.石蕊和水 B.NaOH溶液,pH试纸
C.pH试纸和水 D.酚酞试液和水
14.配制一定物质的量浓度的氢氧化钠溶液,作为测定盐酸浓度的标准溶液,由于以下操作,会造成所测得盐酸浓度偏低的是( )
A.取用已部分潮解的烧碱进行称量
B.称量时砝码放在左盘,并动用游码
C.定容结束时,溶液液面的最高点与刻度处于同一水平面上
D.向容量瓶一次转移氢氧化钠溶液,然后向容量瓶加水至所要的体积
15.某种混合气体,可能含有![]() 、CO、HC1,现把混合气体依次通过足量的
、CO、HC1,现把混合气体依次通过足量的![]() 溶液和灼热的CuO,气体体积都无变化,再通过足量的
溶液和灼热的CuO,气体体积都无变化,再通过足量的![]() 固体,气体体积减小,最后通过灼热的铜网,经充分反应后,气体体积减小,但仍有剩余气体。以下对混合气体组成的判断正确的是(
)
固体,气体体积减小,最后通过灼热的铜网,经充分反应后,气体体积减小,但仍有剩余气体。以下对混合气体组成的判断正确的是(
)
A.一定无![]() ,CO和HC1至少有一种
,CO和HC1至少有一种
B.一定有![]() ,CO和HC1至少有一种
,CO和HC1至少有一种
C.一定有![]() 、CO和HC1
、CO和HC1
D.一定有![]() 、CO,无HC1
、CO,无HC1
第Ⅱ卷 (非选择题 共90分)
三、(本题包括2小题,共18分)
16.(6分)指出使用下列仪器或用品的第一步操作:
(1)用干燥的试纸检验气体的性质。
_________________________________________________;
(2)托盘天平____________________________________________________;
(3)酸式滴定管_______________________________________________________。
17.(12分)已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器。)请填写表中空格,完成由上述混合物得到固体甲的实验设计。
| 序号 | 实验步骤 | 实验操作及注意事项(简述) |
| ① | 溶解 | 将混合物放入烧杯中,加入98% |
| ② | 过滤 | |
| ③ | 稀释(或沉淀) | |
| ④ | 过滤 | |
| ⑤ | 洗涤沉淀 | |
| ⑥ | 检验沉淀是否洗净 |
四、(本题包括3小题,共31分)
18.(6分)下列各种容器,通常应分别用什么方法清洗?
(1)做过碘升华实验的烧杯__________________________________________;
(2)长期存放过三氯化铁溶液的试剂瓶______________________________________
_______________________________________________;
(3)盛过苯酚的容器________________________________________________________。
19.(15分)用下面两种方法可以制得白色的![]() 沉淀。
沉淀。
方法一:用不含![]() 的
的![]() 溶液与用不含
溶液与用不含![]() 的蒸馏水配制的NaOH溶液反应制备。
的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述![]() 溶液时还需加入___________________________。
溶液时还需加入___________________________。
(2)除去蒸馏水中溶解的![]() 常采用______________________的方法。
常采用______________________的方法。
(3)生成白色![]() 沉淀的操作是用长滴管吸取不含
沉淀的操作是用长滴管吸取不含![]() 的NaOH溶液,插入
的NaOH溶液,插入![]() 溶液液面上,再挤出NaOH溶液。这样操作的理由是________________________。
溶液液面上,再挤出NaOH溶液。这样操作的理由是________________________。
方法二:在如图19-2装置中,用NaOH溶液、铁、屑、稀![]() 等试剂制备。
等试剂制备。
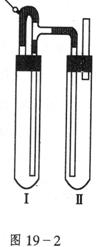
(1)在试管Ⅰ里加入的试剂是__________________________。
(2)在试管Ⅱ里加入的试剂是____________________________。
(3)为了制得白色![]() 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________________________。
沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________________________。
(4)这样生成的![]() 沉淀能较长时间保持白色,其理由是______________________。
沉淀能较长时间保持白色,其理由是______________________。
20.(13分)如图19-3装配好装置,待内外空气压强不变时标注出水银液面的刻度(用红漆)。取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒粉灯点燃迅速移入锥形瓶中并塞紧橡皮塞。硫粉安静地燃烧,水银柱推向左管。当火焰熄灭后,静置,水银柱又慢慢回到原先标定的刻度。
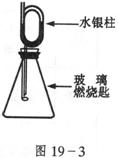
简要回答下列问题:
(1)水银柱推向左管说明什么?___________________________________________
______________________________________;
(2)硫粉未燃尽时火焰就熄灭了,说明_____________________________________
______________________________________;
(3)根据水银柱最后又回到原先标定的刻度,可得到什么结论?
__________________________________________________________________;
(4)根据反应方程式![]() 和上述结论又可推导出什么(或证明什么?)
和上述结论又可推导出什么(或证明什么?)
_____________________________________________________________________。
五、(本题包括2小题,共22分)
21.(10分)实验室里有如下仪器和药品,请设计如下实验的操作步骤要点(“○”可不填满),并指出可能发生的实验现象。
仪器或用品:①试管 ②烧杯 ③玻璃片 ④石棉网 ⑤滤纸
⑥火柴 ⑦镊子 ⑧酒精灯 ⑨药匙 ⑩集气瓶
药品:①金属钠(在煤油中) ②![]() 溶液
③蒸馏水 ④细沙
溶液
③蒸馏水 ④细沙
| 操作步骤要点 | 仪器代号 | 实验现象 | |
| 钠与氯化铝溶液反应 | ① | ① | |
| ② | ② | ||
| ○ | ○ | ||
| ○ | ○ | ||
| ○ | ○ | ||
| ○ | ○ |
22.(12分)如图19-4所示转化关系中,A~L均是中学化学中常见的物质。其中D为金属单质,B在常温常压下为无色液体;G为不溶于水但可溶于酸的白色固体;I为无色气体且能使湿润的红色石蕊试纸变蓝;L为无色气体,遇空气变为红棕色。
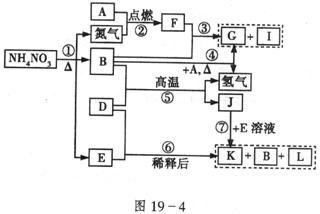
请回答:
(1)构成单质D的元素在周期表中处于____________周期,____________族。
(2)I物质的电子式为_____________,F物质的化学式为____________;它们的晶体类型分别为_______________,_____________。
(3)写出下列反应的化学方程式
③_________________________________________________;
⑤_________________________________________________。
(4)在反应⑤中如果有2mol J物质生成,则反应中转移的电子为_________________mol。
六、(本题包括2小题,共19分)
23.(9分)某无色溶液中可能含有![]() 这几种离子中的若干种,依次进行下列实验,观察到的现象如下:
这几种离子中的若干种,依次进行下列实验,观察到的现象如下:
①用pH试纸检验,溶液的pH>7;②向溶液中滴加氯水无气体产生,再加入![]() 振荡、静置,
振荡、静置,![]() 层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入
层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入![]() 和
和![]() 的混合溶液,只有白色沉淀产生,过滤;④在滤液中加入
的混合溶液,只有白色沉淀产生,过滤;④在滤液中加入![]() 和
和![]() 的混合溶液,有白色沉淀产生。
的混合溶液,有白色沉淀产生。
试回答下列问题:
(1)原溶液中肯定有的离子是_________________,肯定没有的离子是__________________;
(2)分液漏斗的上层液体如何转移到烧杯中?
___________________________________________________________________;
(3)若步骤③改用![]() 和盐酸的混合溶液,对判断①结论有无影响?
和盐酸的混合溶液,对判断①结论有无影响?
___________________________________________________________________;
(4)写出步骤②发生的有关反应的离子方程式_________________________________________________________________________。
24.(10分)某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度![]() 。该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的相对分子质量,拟定的实验步骤如下:
。该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和HX。为了测定RX的相对分子质量,拟定的实验步骤如下:
①准确量取该卤代烷b mL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加稀![]() 酸化,滴加过量
酸化,滴加过量![]() 溶液得到白色沉淀。
溶液得到白色沉淀。
④过滤、洗涤、干燥后称重,得到固体c g。
回答下面问题:
(1)装置中长玻璃管的作用是_______________________________________。
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的________________离子。
(3)该卤代烷中所含卤素的名称是______________,判断的依据是___________________。
(4)该卤代烷的相对分子质量是______________________________________(列出算式)。
(5)如果在步骤③中,加入![]() 的量不足,没有将溶液酸化,则步骤④中所得的c值(填下列选项代码)______________。
的量不足,没有将溶液酸化,则步骤④中所得的c值(填下列选项代码)______________。
A.偏大 B.偏小 C.不变 D.大小不定
参考答案
1.B ![]() 能被浓
能被浓![]() 氧化。
氧化。
2.C 蛋白质溶液为胶体,分离胶体和溶液采用渗析法。
3.D 加热是指直接加热或隔石棉网加热。
4.D 石炭酸、氢硫酸溶液在空气里易被氧化,氢氟酸因能与玻璃中二氧化硅反应而不能用无色玻璃试剂瓶存放
5.B 该装置适宜于固体与固体且需加热,密度比空气大的气体制备。
6.AC Na可与![]() 、
、![]() 反应;浓硫酸溶解时放出大量热,会灼皮肤,应先用布抹去。
反应;浓硫酸溶解时放出大量热,会灼皮肤,应先用布抹去。
7.A B项可能含![]() ,C项“钝化”是因氧化而形成致密的氧化膜。
,C项“钝化”是因氧化而形成致密的氧化膜。
8.B 将![]() ,过量的NaOH用
,过量的NaOH用![]() 除去。
除去。
9.C 选项A可利用其在水中溶解性和密度的大小来区分;选项B和选项D可利用其在水中的溶解性加以区分。
10.BD 根据滴加的顺序不同,产生的现象不同加以区别。B中若将稀![]() 滴入
滴入![]() 溶液中,产生
溶液中,产生![]() ,无明显现象;若将
,无明显现象;若将![]() 溶液滴入稀
溶液滴入稀![]() 中,则有
中,则有![]() 产生。D中
产生。D中![]() 溶液滴入盐酸中,无沉淀产生;而将盐酸滴入
溶液滴入盐酸中,无沉淀产生;而将盐酸滴入![]() 溶液中,则有
溶液中,则有![]() 沉淀产生。
沉淀产生。
11.BD 锥形瓶不能润洗,否则会使测定值偏高。
12.BD B项用水吸收![]() 会生成NO;D项会有
会生成NO;D项会有![]() 生成。
生成。
13.BC 可用等量的NaOH溶液中和酸,pH变化小的为弱酸。或采用稀释的方法:pH变化小的为弱酸。
14.C 盐酸浓度偏低即耗用NaOH溶液少,原NaOH溶液浓度偏大。
15.B 通过![]() 溶液和灼热CuO,气体体积无变化不能确定是否含HC1、CO;但通过
溶液和灼热CuO,气体体积无变化不能确定是否含HC1、CO;但通过![]() 固体,气体体积减小即有
固体,气体体积减小即有![]() 反应,通过灼热铜网剩余气体只能是
反应,通过灼热铜网剩余气体只能是![]() 。
。
16.(1)用蒸馏水润湿试纸;(2)将游码移回零处;(3)检查是否漏水。
17.
| 序号 | 实验步骤 | 简述实验操作 |
| ① | 溶解 | 将混合物放入烧杯中,加入98% |
| ② | 过滤 | 安装好过滤装置,将①的悬浊液沿玻璃棒加入过滤器中过滤 |
| ③ | 稀释(或沉淀) | 在另一烧杯中,放入适量蒸馏水,将②的滤液沿玻璃棒慢慢加入该烧杯中,并不断搅拌 |
| ④ | 过滤 | 重新安装过滤装置,将③的悬浊液沿玻璃棒加入过滤器中过滤 |
| ⑤ | 洗涤沉淀 | 向④的过滤器中注入少量蒸馏水,使水面浸过沉淀物,等水滤出后,再次加水洗涤,连洗几次 |
| ⑥ | 检验沉淀是否洗净 | 用小试管从⑤的漏斗下口取少量洗出液,滴入 |
18.(1)先用酒精清洗,再用水洗 (2)先用盐酸清洗,再用水洗 (3)先用NaOH溶液清洗,再用水洗
19.方法一 (1)稀![]() 铁屑 (2)煮沸 (3)避免生成的
铁屑 (2)煮沸 (3)避免生成的![]() 沉淀接触
沉淀接触![]()
方法二 (1)稀![]() 铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的
铁屑 (2)NaOH溶液 (3)检验试管Ⅱ出口处排出的氢气的纯度。当排出的![]() 纯净的,再夹紧止水夹。 (4)试管Ⅰ中反应生成的
纯净的,再夹紧止水夹。 (4)试管Ⅰ中反应生成的![]() 充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。
充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入。
20.(1)该反应是放热反应,气体受热膨胀;(2)瓶内氧气耗尽;(3)①同温同压下反应消耗的氧气与生成的![]() 体积相同;②压强相同;③物质的量相同;(4)同温同压下,相同体积的气体含有相同的分子数。
体积相同;②压强相同;③物质的量相同;(4)同温同压下,相同体积的气体含有相同的分子数。
21.①用镊子取出钠后用小刀切取一小块 ②用滤纸吸干煤油 ③放入盛有![]() 的小烧杯中 ④盖上玻璃片 ②③⑤⑦ ①剧烈反应 ②熔成光亮的小球
的小烧杯中 ④盖上玻璃片 ②③⑤⑦ ①剧烈反应 ②熔成光亮的小球
③四处游动并发出声响 ④浮在液面上 ⑤溶液中有白色絮状物生成 ⑥白色沉淀最后可能溶解(或减小)成无色溶液
22.(1)四;Ⅷ (2)???;![]() ;分子晶体;离子晶体 (3)
;分子晶体;离子晶体 (3)![]() ;
;![]() (4)16
(4)16
23.(1)![]() ;
; ![]()
(2)打开分液漏斗活塞,将下层液体放出后,关闭活塞,使上层液体从漏斗口倒出
(3)无
(4)![]() ,
,
![]()
24.(1)防止卤代烷挥发(或答冷凝) (2)![]() 、
、![]() 和
和![]() (3)氯;得到的氯化银沉淀是白色的 (4)(143.5×a×b)/c (5)A
(3)氯;得到的氯化银沉淀是白色的 (4)(143.5×a×b)/c (5)A